
Unidade 3 Transformações químicas

Preservação de bens culturais
As pinturas são exemplos comuns de expressão visual da humanidade sôbre si mesma e sôbre o mundo e a realidade em que vive. Muitas vezes, essas obras retratam situações e ideias importantes para determinada época da história e, por isso, são consideradas bens culturais. Entretanto, as obras de arte estão sujeitas a diversas transformações ao longo do tempo, as quais comprometem sua beleza e seus significados. Portanto, conservá-las garante que também sejam preservados registros da história da humanidade.
Uma das fórmas de preservar esses registros é restaurar obras que estão danificadas. Entender as causas do dano, as características dos materiais utilizados na produção das obras e como eles interagem é importante para que o restauro seja bem-sucedido.
Começando a Unidade
- Que aspectos e componentes de uma pintura podem evidenciar um processo de degradação ao longo do tempo?
- Que outros tipos de bem cultural estão sujeitos a transformações ao longo do tempo? Essas transformações são apenas químicas? Se não, que outros tipos podem ocorrer? Dê exemplos.
Por que estudar esta Unidade?
O ciclo de vida de uma planta, o envelhecimento do corpo humano e o desgaste de objetos após seu uso são exemplos cotidianos de que tudo no mundo está em constante transformação. É importante identificar e compreender a estrutura da matéria e as transformações pelas quais ela pode passar.
Respostas e comentários
Objetivos da Unidade
• Reconhecer a presença de transformações químicas no cotidiano e nos contextos industrial e artístico.
• Reconhecer a importância da preservação e da restauração de bens culturais.
• Distinguir mistura e substância.
• Caracterizar substâncias simples e substâncias compostas.
• Elaborar explicações para evidências de transformações químicas.
• Perceber que há transferência de energia envolvida nas reações químicas.
• Compreender os conceitos de reação química, reagente e produto.
• Representar transformações químicas na fórma de modelos de partículas e na fórma de equações químicas.
• Identificar diferentes tipos de reação química.
• Avaliar experimentalmente o princípio da conservação da matéria.
• Aplicar adequadamente as leis ponderais para prever quantidades de reagentes e produtos.
• Compreender o conceito de coeficiente estequiométrico e o princípio de balanceamento de equações químicas.
• Debater do ponto de vista ético questões científicas que impactam a sociedade.
• Reconhecer os impactos positivos e negativos do desenvolvimento científico e tecnológico para a sociedade.
• Valorizar a participação das mulheres na história da Ciência.
Tema contemporâneo transversal (tê cê tê) em foco nesta Unidade
• Saúde: abordar a adulteração de produtos alimentícios e os riscos à saúde, e a importância dos ensaios clínicos para o desenvolvimentos de novos produtos.
Habilidades da Bê êne cê cê em foco nesta Unidade
• ê éfe zero nove cê ih zero dois: Comparar quantidades de reagentes e produtos envolvidos em transformações químicas, estabelecendo a proporção entre suas massas.
• ê éfe zero nove cê ih zero três: Identificar modelos que descrevem a estrutura da matéria (constituição do átomo e composição de moléculas simples) e reconhecer sua evolução histórica.

Respostas e comentários
Orientações didáticas
• Inicie a Unidade apresentando aos estudantes o vídeo ou trechos do livro indicados nas Sugestões de recursos complementares. Com base no vídeo ou na leitura, questione os estudantes sôbre o que eles entendem por transformações químicas e qual é a possível relação entre elas e a degradação e restauração de bens culturais.
• Peça a eles que respondam às questões do Começando a Unidade e discutam as respostas. Pergunte sôbre o papel da Ciência nessa área de atuação e como poderia ser feita a restauração química de uma obra de arte. Por exemplo: identificar a tinta que foi utilizada no momento da pintura para realizar retoques.
Respostas – Começando a Unidade
1. Espera-se que os estudantes sejam capazes de identificar e citar aspectos como côr, textura, brilho, rigidez da tela, rachaduras, entre outros.
2. Espera-se que os estudantes identifiquem bens como esculturas, monumentos, prédios arquitetônicos, livros e composições escritas, entre outros. Esses bens estão sujeitos a transformações químicas (mudanças de côr, textura, brilho, rigidez), físicas (rachadura ou desgaste mecânico) e biológicas (aparecimento de fungos e outros microrganismos). É possível ainda que eles citem outros patrimônios culturais, como a música. Nesse caso, apesar de não haver transformações químicas, físicas ou biológicas diretamente, enfatize que esse tipo de arte está sujeito a outros tipos de transformação, como as culturais, as sociológicas e as antropológicas.
Sugestões de recursos complementares
Vídeo
CURSO de conservação e restauração da . 2015. (5 minutos). Publicado pelo canal TOP Cultura.
Vídeo destacando a interdisciplinaridade que a profissão de restaurador exige.
Disponível em: https://oeds.link/dZBgSZ. Acesso em: 24 agosto 2022.
Livro
MUSEU CASA DO PONTAL (coordenação). Caderno de conservação e restauro de obras de arte popular brasileira. Rio de Janeiro: Associação dos Amigos da Arte Popular Brasileira; Brasília: unêsco, 2008.
Nesse e-book você encontrará diversas informações sôbre conservação e restauro de obras brasileiras, como a conservação preventiva, os procedimentos básicos para conservar e restaurar, entre outras.
Disponível em: https://oeds.link/42VYCj. Acesso em: 9 agosto 2022.

TEMA 1 Substâncias e misturas
Os materiais podem ser formados por uma única substância ou por misturas de substâncias.
Para reverter um processo de degradação de uma obra de arte ou de qualquer objeto é importante descobrir sua composição química, ou seja, de ela é constituída. Os materiais encontrados na natureza ou produzidos de fórma artificial pelo ser humano podem ser classificados em dois grandes grupos: os constituídos por uma única substância e aqueles formados por uma mistura de substâncias.

Substância
Em Química, substância é um material formado por um único tipo de componente, seja ele constituído por um único tipo de aglomerado (por exemplo, molécula) ou por átomos livres. De acôrdo com sua composição, as substâncias podem ser classificadas em simples ou compostas.
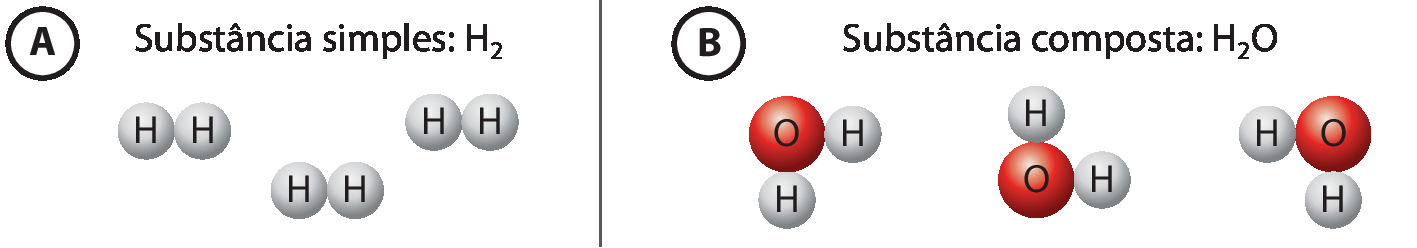
- Substância simples: é formada somente por átomos de um elemento químico. Por exemplo, a substância hélio é constituída de átomos isolados do elemento químico hélio (agá ê), e a substância hidrogênio é formada por moléculas com dois átomos do elemento químico hidrogênio (agádois).
- Substância composta: é formada por átomos de dois ou mais elementos químicos. A água (agádoisóh) é um exemplo de substância composta. As moléculas que compõem essa substância são formadas por átomos dos elementos químicos hidrogênio e oxigênio: dois átomos de hidrogênio e um de oxigênio, mais precisamente.
Substâncias simples e composta
As substâncias podem ser diferenciadas uma das outras pelo conjunto de propriedades específicas, como temperatura de fusão, temperatura de ebulição, densidade, dureza etcétera Para caracterizar uma substância, podemos consultar livros e tabelas que reúnem esses valores de referência, os quais foram determinados sob condições de análise específicas (como pressão e temperatura). Se uma amostra for analisada sob essas mesmas condições e apresentar valores diferentes dos valores de referência, é um indício de que não se trata daquela substância ou de que ela está misturada a outras substâncias.
Respostas e comentários
Orientações didáticas
• Entre os requisitos prévios desta Unidade estão a compreensão de que toda matéria é formada por átomos, o reconhecimento de representações submicroscópicas do modêlo de partículas e o conhecimento de que os átomos se unem por meio de diferentes tipos de ligação química, fundamentais para a definição de substância e para a abordagem do tema transformações químicas. Tendo isso em vista, inicie o Tema solicitando aos estudantes que diferenciem, com base em seus conhecimentos prévios, átomo, molécula, elemento químico, composto, componente e substância. Eles poderão ir à lousa e criar quadro com as definições e uma representação ilustrativa (fórmula química e/ou esquema figurativo) do que eles consideram ser cada um dêsses conceitos. Com base no quadro elaborado será possível verificar as concepções deles sôbre os conceitos e os possíveis equívocos guiando a prática docente.
• Leve modelos de compostos químicos formados com materiais como palitos de churrasco e esferas de isopor. Pode-se usar esferas de cores e tamanhos diferentes para ilustrar diferentes elementos químicos. Represente os constituintes de substâncias simples e compostas, e peça aos estudantes que as analisem conforme as definições já conferidas no quadro feito por eles. Essa proposta possibilita o desenvolvimento de aspectos relacionados à habilidade ê éfe zero nove cê ih zero três da Bê êne cê cê. Identifique os conceitos preliminares dos estudantes sôbre essas definições e guie-os caso estejam equivocados.
• Átomos se combinam – ou não – de diversas maneiras, formando milhões de substâncias. Discuta exemplos de substâncias simples formadas por átomos isolados, como o gás hélio.
• Utilize a fotografia para destacar a importância de se conhecer os constituintes de uma obra artística e, com essa informação, fornecer condições adequadas para diminuir a exposição da obra a degradações, como umidade, temperatura, poluentes atmosféricos, entre outros. Se julgar pertinente, pergunte aos estudantes o que eles imaginam que foi feito para evitar a degradação da obra da fotografia – supõe-se que foi aplicada uma camada de um produto que impeça o processo de ferrugem.
Mistura
Uma mistura é constituída de duas ou mais substâncias diferentes, sejam elas simples ou compostas. Ela é obtida ao combinar-se substâncias em qualquer proporção sem provocar alterações na estrutura de cada uma delas, ou seja, sem que elas reajam entre si.
O ar atmosférico é uma mistura de diferentes gases, como o gás oxigênio (óhdois), o gás nitrogênio (ênedois) e outros, em menor proporção, como o vapor de água. A proporção em volume de gás oxigênio e de gás nitrogênio praticamente não varia: 21% e 78%, respectivamente. Já a proporção de água pode variar regionalmente, por exemplo, de acôrdo com a estação do ano. Nos meses mais úmidos, em determinada região, há mais vapor de água disperso na atmosfera. Portanto, nas misturas (como o ar), a proporção das substâncias que as compõem pode variar. No entanto, a proporção entre os átomos que formam cada substância não muda.
Composição do álcool vendido comercialmente
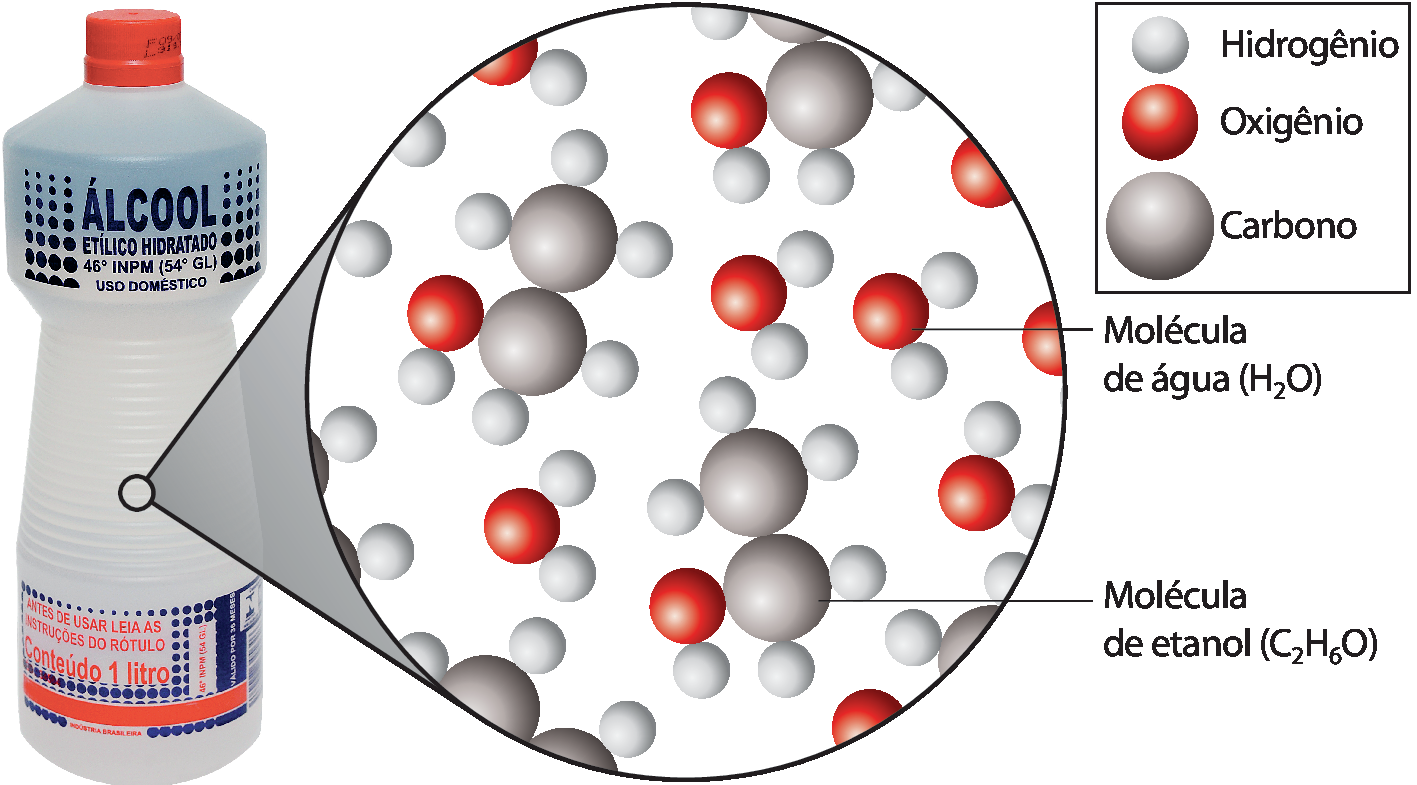
Os materiais que compõem os seres vivos, como a seiva das plantas, também são misturas. O petróleo é uma mistura de diversas substâncias. Muitos dos materiais produzidos pelo ser humano também são misturas, como as ligas metálicasglossário (o aço, o bronze e o latão, por exemplo).

De ôlho no tema
Em um recipiente, há um líquido formado por moléculas do tipo um e do tipo dois. As moléculas do tipo um são formadas por dois átomos A; as do tipo dois são formadas por três átomos: A, B e C.
- Desenhe, de fórma simbólica, o conteúdo dêsse recipiente, imaginando que as moléculas se encontram em igual proporção.
- Nesse recipiente, temos um exemplo de substância ou de mistura de substâncias? Justifique sua resposta.
Versão adaptada acessível
a) Represente, de forma simbólica, o conteúdo desse recipiente, imaginando que as moléculas se encontram em igual proporção.
Orientação para acessibilidade
Aceite diferentes tipos de representação dos estudantes na resposta da atividade.
Respostas e comentários
Orientações didáticas
• Com o conceito de substância bem definido, os estudantes podem diferenciar substância de mistura. Esclareça que em uma mistura estão presentes duas ou mais substâncias; por exemplo, o ar atmosférico e muitos produtos cotidianos, como água mineral, refrigerantes e cosméticos, são misturas.
• Explore com eles a ilustração “Composição do álcool vendido comercialmente” para trabalhar o conceito de mistura, diferenciando-o do conceito de substância. Peça aos estudantes que obtenham a proporção entre os átomos de hidrogênio e de oxigênio na água (2 : 1), e entre esses elementos e o carbono no etanol (6 : 1 : 2). Enfatize que são os tipos de átomo, a quantidade deles e sua proporção que caracterizam cada substância (não consideramos, aqui, o fenômeno da isomeria), e que a proporção entre as substâncias pode variar em uma mistura. No caso do álcool vendido comercialmente, é possível encontrá-lo em diferentes proporções: 54 e 70 , por exemplo.
• Apresente outros exemplos de misturas, como as ligas metálicas. Um anel de ouro, por exemplo, não é formado por uma substância simples, como muitos acreditam. O ouro usado para joalheria é, na verdade, composto de uma liga metálica, geralmente com a presença de ouro, cobre, prata e zinco. É, portanto, uma mistura. Outros exemplos: o bronze é uma mistura de cobre e estanho; o latão é uma mistura de cobre e zinco.
Respostas – De ôlho no tema
a) Esperam-se esquemas de quantidades iguais de moléculas diferentes, que podem ser simbolizadas por círculos coloridos ou com padrões diferentes: as moléculas do tipo um formadas por dois círculos de mesma côr, e as do tipo dois, por três círculos de cores diferentes, sendo que um deles deve ser da mesma côr usada para os átomos da molécula do tipo um (átomo A).
b) As moléculas do tipo um representam uma substância simples; as moléculas do tipo dois, uma substância composta. No recipiente há um líquido composto de duas substâncias e, portanto, trata-se de uma mistura.

TEMA 2 Reações químicas
As substâncias podem se transformar em outras por meio do rearranjo de átomos.
Uma reação química (ou transformação química) ocorre quando as ligações químicas entre os átomos dos reagentes são desfeitas e um novo arranjo de átomos é formado, gerando os produtos, ou seja, substâncias diferentes das iniciais.
Analise a representação a seguir.
Reação entre as substâncias enxofre e oxigênio
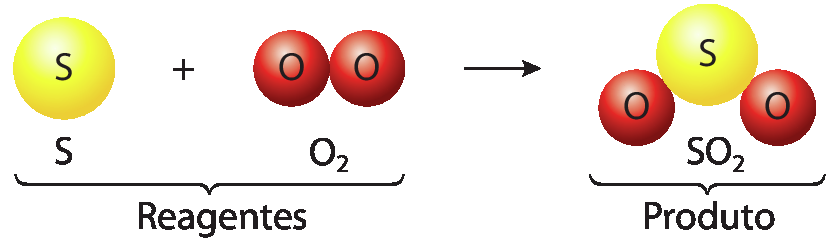
Note que o produto formado na representação da reação química apresentada anteriormente é uma combinação de átomos diferente da dos reagentes iniciais, porém os átomos envolvidos são os mesmos e nas mesmas quantidades. Ou seja, em todas as reações químicas ocorrem rearranjos de átomos, mas o número de átomos se mantém igual.
Durante o processo em que ligações químicas são desfeitas e novas ligações são formadas, existe uma transferência de energia entre o meio reacional e a vizinhança. A quantidade de energia transferida depende dos átomos envolvidos e é específica para cada reação química. Essa diferença de energia ocorre, portanto, em todas as reações químicas, e algumas vezes pode ser observada na fórma de luz, alteração da temperatura, som, eletricidade etcétera

Respostas e comentários
Orientações didáticas
• Inicie a abordagem do tema buscando identificar as concepções prévias dos estudantes sôbre reações químicas. O texto indicado na Sugestão de recurso complementar pode contribuir para esse levantamento. Além disso, sugere-se apresentar a eles exemplos cotidianos de transformações químicas, mostrando evidências das reações; por exemplo, combustão (produção de luz e calor) e formação de ferrugem (formação de sólido e mudança de aspecto). dêsse modo, aproxima-se o tema a ser estudado da realidade do estudante e favorece-se o desenvolvimento da competência específica 3 de Ciências da Natureza para o Ensino Fundamental, prevista pela Bê êne cê cê.
• Para trabalhar a representação das equações químicas, recorra ao esquema “Reação entre as substâncias enxofre e oxigênio“. Ao analisá-lo com os estudantes, ressalte o significado das palavras “reagentes” e “produto”. Identificá-los em uma reação é primordial para o entendimento do restante do conteúdo. Enfatize que, nas reações químicas, os átomos dos elementos químicos envolvidos recombinam-se por meio da ruptura e da formação de novas ligações químicas, produzindo substâncias diferentes, mas mantendo o mesmo número de átomos. Além disso, explique que uma reação química pode acontecer entre reagentes que se encontram em diferentes estados físicos. No exemplo dado, um sólido (enxofre) pode reagir com o gás oxigênio, produzindo outro gás (dióxido de enxofre).
Sugestão de recurso complementar
Artigo
MORTIMER, E. F.; MIRANDA, L. C. Transformações: concepções dos alunos sôbre reações químicas. Química nova na escola, número 2, página 23-26, 1995.
O artigo destaca as concepções prévias dos estudantes sôbre fenômenos de transformação de materiais, sugerindo alternativas para confrontá-las.
Disponível em: https://oeds.link/WU1O7N. Acesso em: 24 agosto 2022.
Alguns tipos de reação química
As reações químicas podem ser classificadas segundo as características que apresentam em comum. Por exemplo, reações em que duas ou mais substâncias interagem e formam uma única substância como produto são chamadas de reação de síntese. A reação química entre as substâncias enxofre e oxigênio, exemplificada anteriormente, é uma reação de síntese.
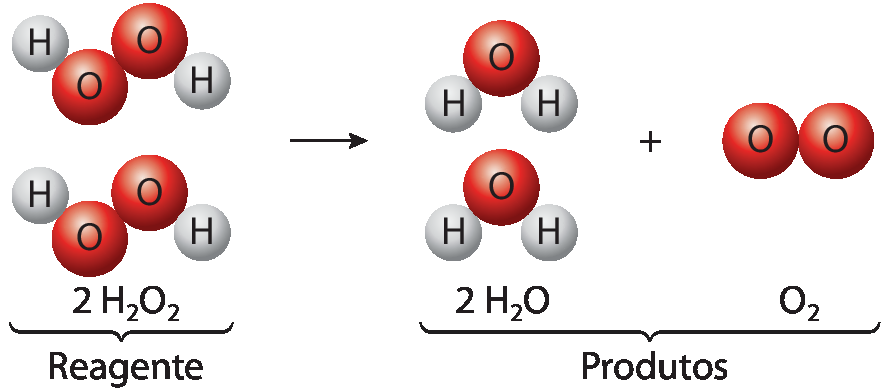
A água oxigenada, produto comercializado em farmácias, é uma solução aquosa de peróxido de hidrogênio. Essa substância se decompõe naturalmente produzindo água e gás oxigênio. Esse tipo de reação, em que uma substância se decompõe em duas ou mais substâncias, é chamado de reação de decomposição.
Reação de decomposição do peróxido de hidrogênio

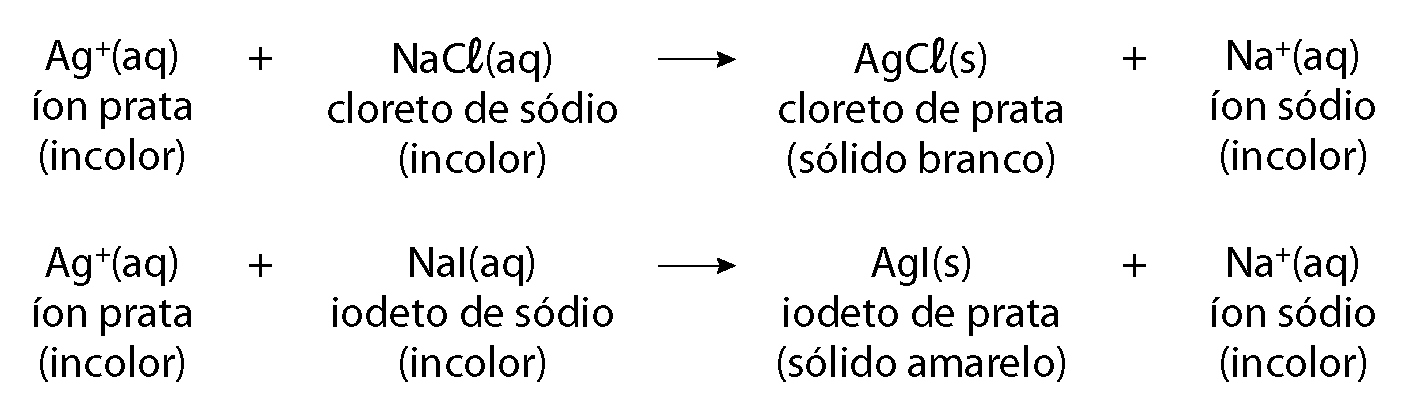
Outro tipo de reação química ocorre quando a mistura de duas substâncias líquidas ou em solução aquosa produz um material sólido, comumente chamado de precipitado. As reações de precipitação podem ser utilizadas para identificar a presença de determinados componentes em uma solução de composição desconhecida.
Por exemplo, a solução aquosa de cloreto de sódio (êne á cê éle) é incolor. Se adicionarmos algumas gotas dessa solução em uma amostra desconhecida e observarmos a formação de um produto sólido de coloração branca, poderemos suspeitar que a amostra desconhecida contém íons prata (á gêmais). Se realizarmos outro teste nessa mesma amostra adicionando gotas de uma solução aquosa de iodeto de sódio (êne áI), que também é incolor, e observarmos a formação de um produto sólido de coloração amarela, poderemos constatar que a amostra contém íons prata (á gêmais).
As equações químicas a seguir representam as reações químicas descritas.

Respostas e comentários
Orientações didáticas
• Apresente alguns dos diferentes tipos de reação química, mas esclareça que existem vários outros tipos, caracterizados de diferentes fórmas nos estudos das reações químicas. Aproveite para representar as transformações por meio das equações químicas, familiarizando os estudantes com essa fórma de representação.
• Destaque a ilustração “Reação de decomposição do peróxido de hidrogênio” e pergunte a eles por que há duas moléculas (e não uma) representadas na posição do reagente. Espera-se que eles percebam que, para a formação dos produtos, é necessária mais de uma molécula de peróxido de hidrogênio, a fim de garantir o mesmo número de átomos antes e depois da decomposição. Ao introduzir a ideia de proporcionalidade e conservação de matéria em uma reação química, o estudante tem a oportunidade de desenvolver aspectos relacionados à habilidade ê éfe zero nove cê ih zero dois da Bê êne cê cê.
• Ao apresentar a reação de precipitação, discuta a diferença entre uma mistura heterogênea e a evidência de uma transformação química. No exemplo, a formação do sólido branco a partir de dois líquidos incolores evidencia a formação de uma nova substância e, portanto, a ocorrência de uma reação química.
• A fim de trabalhar novamente as noções de proporcionalidade e conservação de matéria em uma reação química, você pode fazer perguntas relacionadas a esses temas utilizando as reações exemplificadas e, com isso, oportunizar o desenvolvimento de aspectos relacionados à habilidade ê éfe zero nove cê ih zero dois Por exemplo: “Considerando uma solução aquosa de íons prata, qual seria a quantidade de sólido branco formado se misturássemos quantidades cada vez maiores de cloreto de sódio?”. Espera-se que eles sugiram que a quantidade de sólido obtida seria proporcional à quantidade de cloreto de sódio adicionada. Destaque, nesse caso, que a formação de precipitado ocorre enquanto há íons prata dissolvidos em solução aquosa.
Alguns materiais estão sujeitos a um tipo de reação em que há troca de elétrons entre os átomos dos reagentes para que ocorra a formação de um novo produto. Um prego de ferro, por exemplo, enferruja porque o metal na presença de umidade reage com o gás oxigênio da atmosfera e produz outras substâncias que compõem a ferrugem, o que pode ser observado pela aparência do prego.
Esse tipo de reação, chamada de oxirredução, pode acontecer entre diferentes materiais constituídos de átomos com tendência a doar ou receber elétrons.

As reações de combustão são reações de oxirredução que envolvem dois tipos de reagentes: o combustível (como a madeira, o carvão ou a gasolina) e o comburente (geralmente o gás oxigênio, mas pode acontecer com outras substâncias que tenham grande tendência de receber elétrons, como o gás cloro).
O ser humano faz uso dêsse tipo de reação desde a descoberta do fogo e para diversas finalidades, como aquecer e cozinhar alimentos, iluminar ambientes e movimentar veículos.

Respostas e comentários
Orientações didáticas
• Ao introduzir as reações de oxirredução, pergunte aos estudantes o que eles acreditam ser a ferrugem. É possível que eles a relacionem com a deposição de algo presente no ar sôbre o ferro ou sua simples decomposição. Questione-os quanto à corrosão e à mudança de côr, pedindo que formulem explicações e representem-nas com esquemas figurativos, favorecendo o desenvolvimento da competência geral 2 da Educação Básica e da competência específica 3 de Ciências da Natureza para o Ensino Fundamental, previstas pela Bê êne cê cê. Retome com os estudantes as definições de íons e ligações químicas e reforce que um mesmo elemento químico pode existir na fórma de átomo e de íon. É importante que eles percebam que nessas reações ocorre a transferência de elétrons entre diferentes átomos.
• Ao abordar a reação de combustão, defina-a como uma reação de oxidação na qual uma substância muito reativa e com alta capacidade de receber elétrons, como o gás oxigênio, reage e há liberação de luz e calor (majoritariamente na fórma de fogo). Destaque que para apagar o fogo ou incêndios pode-se fazer o uso de extintores de incêndios. Os extintores à base de gás carbônico, por exemplo, diminuem a quantidade de oxigênio disponível no local aplicado e, com isso, a reação de combustão não consegue se manter e o fogo apaga. Extintores à base de água podem tanto ter essa função quanto diminuir a temperatura do local, fazendo com que a reação de combustão seja interrompida. Cada tipo de extintor de incêndio deve ser utilizado para determinado material combustível. Quando a chama atinge peças elétricas e fios elétricos desencapados, por exemplo, não se deve utilizar extintores à base de água.

Vamos fazer
REGISTRE EM SEU CADERNO
A massa se conserva ou se altera em uma reação química?
Para esta investigação, vamos observar o que ocorre quando um comprimido efervescente é colocado em água. Após ler o procedimento, em dupla, elabore uma hipótese sôbre quais serão os resultados obtidos na atividade.
Material
- 2 comprimidos efervescentes (vitamina C ou antiácido)
- Água
- uma garrafa plástica de 1,5 litro ou de 2 litros com tampa
- uma balança digital com precisão de 0,1 grama
Procedimento
- Coloque água até a metade da garrafa.
- Com a balança, meça e anote a massa inicial do conjunto garrafa com água, comprimido efervescente e tampa.
- Coloque o comprimido na garrafa com a água e tampe-a imediatamente.
- Após o término da reação, meça a massa final do conjunto e anote o resultado.
- Repita todo o procedimento, mas agora sem tampar a garrafa.
Analisar e interpretar
- Qual é o objetivo desta investigação?
- Suas hipóteses iniciais foram confirmadas?
- Explique os resultados obtidos nesta atividade prática.

De ôlho no tema
A formação da ferrugem causa um impacto significativo na economia de um país. Considere que você tenha a tarefa de impedir a formação de ferrugem em um portão de ferro que está exposto ao Sol e às chuvas. O que você faria?
Respostas e comentários
Orientações didáticas
• A atividade proposta na seção Vamos fazer possibilita aos estudantes vivenciar a ocorrência de uma reação química e observar a manutenção e a diminuição da massa na dissolução do comprimido efervescente em sistema fechado e em sistema aberto, respectivamente. dêsse modo, essa atividade pode ser utilizada para introduzir os conceitos de proporcionalidade e conservação de massa, que serão abordados nos Temas subsequentes desta Unidade, favorecendo o trabalho parcial com a habilidade ê éfe zero nove cê ih zero dois.
• Antes de iniciar o procedimento descrito na seção Vamos fazer, peça aos estudantes que respondam à atividade 1 dessa seção. Antes que eles realizem a etapa 2 do procedimento, questione a razão da pesagem antes e após a reação. A execução dessa atividade permite mobilizar a competência específica 2 de Ciências da Natureza para o Ensino Fundamental prevista pela Bê êne cê cê, ao estimular a reflexão e a análise crítica das circunstâncias para elaboração e teste de hipóteses e propor uma solução para o resultado observado.
• Para atingir o objetivo dessa atividade prática, os estudantes devem lidar com valores pequenos de medida, situação em que o cuidado e a precisão se tornam ainda mais importantes.
• Ao fim da prática experimental, peça a eles que revejam e comentem suas previsões. É fundamental discutir com eles a diminuição de massa ocorrida na dissolução do comprimido efervescente em sistema aberto. Conduza a discussão de modo que eles percebam que a diminuição da massa ocorreu em razão da liberação de gás para o ambiente.
Respostas – Vamos fazer
1. O objetivo da atividade é verificar se ocorre a conservação da massa nessa reação química em duas condições diferentes: sistema fechado e sistema aberto.
2. Resposta pessoal. É possível que os estudantes suponham a conservação da massa em ambos os casos, sem levar em conta a perda de massa causada pela saída do gás no sistema aberto. O importante é que revejam suas hipóteses em função dos resultados obtidos.
3. Espera-se que eles relatem a conservação de massa no sistema fechado e a diminuição da massa no sistema aberto e procurem explicar as diferenças observadas pela manutenção do gás em sistema fechado e a perda dele para o ambiente no sistema aberto.
Resposta – De ôlho no tema
Resposta pessoal. Espera-se que os estudantes respondam que devemos impedir o contato do ferro com o ar atmosférico e a água. Isso pode ser feito, por exemplo, com uso de tinta ou de zarcão.

Atividades
TEMAS 1 E 2
REGISTRE EM SEU CADERNO
ORGANIZAR
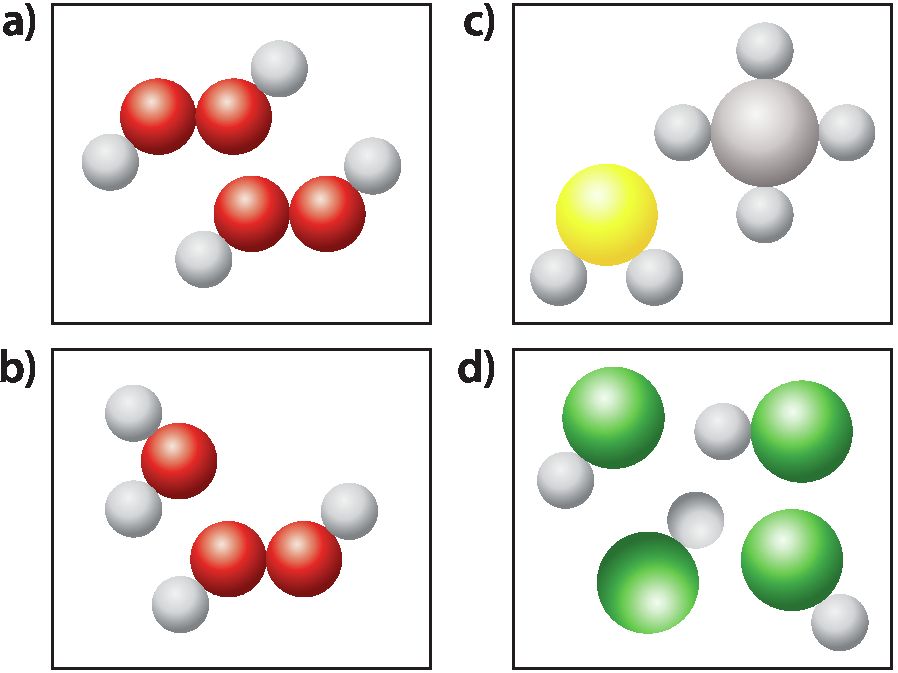
1. Classifique cada uma das representações a seguir em substância ou mistura.
2. O cuproníquel é uma liga metálica formada por cobre (75%) e níquel (25%) que era utilizada na confecção de moedas como a da imagem a seguir.

- Essa moeda é constituída por uma substância simples, uma substância composta ou uma mistura?
3. A água pode ser formada a partir da reação entre gás hidrogênio e gás oxigênio, conforme mostra a representação a seguir.
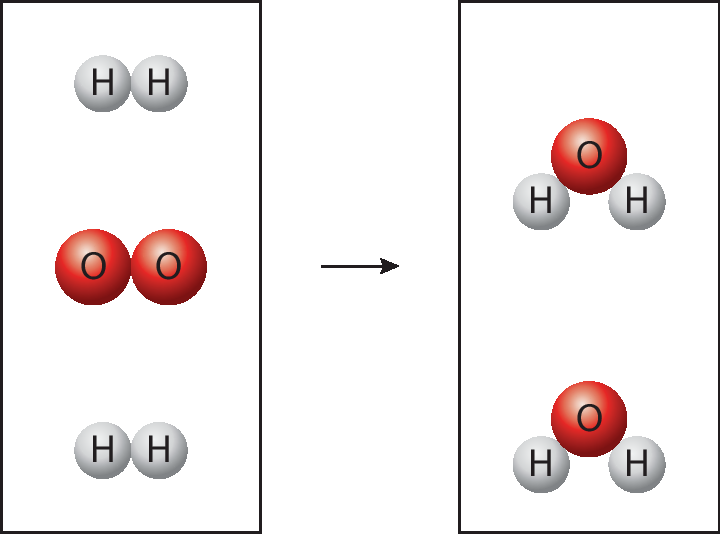
• Para que essa reação ocorra, quais ligações são rompidas e quais são formadas?
ANALISAR
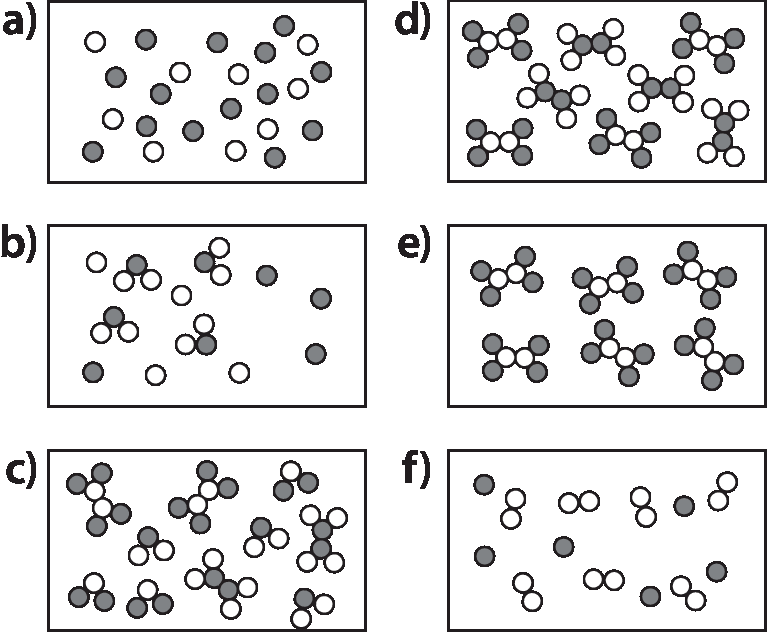
4. Classifique cada uma das representações a seguir em: substância simples; substância composta; mistura de substâncias simples; mistura de substâncias compostas; mistura de substâncias simples e compostas.
5. Em um teste de sala de aula, o professor escreveu na lousa a equação de combustão do gás hidrogênio representada a seguir:

Em seguida pediu aos estudantes que classificassem essa reação em síntese, decomposição ou oxirredução. Os estudantes não chegaram a um consenso sôbre a resposta. Como você classificaria essa reação? Responda utilizando um argumento científico com dado, conclusão, qualificador, apôio, garantia e refutador.
COMPARTILHAR
6. O domínio do fogo representou um importante marco na história da humanidade e teve grande impacto na relação do ser humano com os materiais ao seu redor. A falta de instrução das pessoas sôbre como evitar fogo e o que fazer em casos de incêndios facilita a incidência de acidentes domésticos. O professor dividirá a turma em dois grandes grupos: um deles será responsável por destacar a importância do domínio do fogo e das reações de combustão em vários momentos da história da humanidade; o outro apresentará os cuidados que devemos ter para prevenir incêndios. O professor definirá o dia, a fórma de apresentação e como cada grupo compartilhará as informações pesquisadas.
Respostas e comentários
Respostas – Atividades
1. a) Substância; b) Mistura; c) Mistura; d) Substância.
2. Mistura.
3. As ligações covalentes entre os átomos de hidrogênio na molécula agádois e entre os átomos de oxigênio na molécula O2 são desfeitas, e cada átomo de oxigênio se liga covalentemente a dois átomos de hidrogênio, formando a água (agádoisóh).
4. a) Mistura de substâncias simples. b) Mistura de substâncias simples e compostas. c) Mistura de substâncias compostas. d) Mistura de substâncias compostas. e) Substância composta. f) Mistura de substâncias simples.
5. Resposta pessoal. Espera-se que os estudantes percebam que a reação descrita pode ser classificada tanto como síntese quanto como reação de oxirredução. Avalie também se eles conseguiram indicar todos os elementos de um argumento científico (dado, conclusão, qualificador, apôio, garantia e refutador). A atividade favorece o trabalho com a competência geral 7 da Educação Básica, prevista pela Bê êne cê cê.
6. Oriente os estudantes sôbre o tempo e a apresentação de cada grupo. Se julgar necessário, ajude-os na pesquisa em sites confiáveis (governamentais, de universidades, entre outros) e no uso de matérias jornalísticas e artigos para apresentar dados e a relevância da pesquisa.
Versão adaptada acessível
Se necessário, realize a atividade a seguir com um colega.
Orientação para acessibilidade
Caso haja estudantes cegos ou com baixa visão na turma, oriente-os a realizar a atividade a seguir em duplas com um colega vidente.

Explore
REGISTRE EM SEU CADERNO
Transformando a química em arte
Nesta atividade, vamos explorar a criatividade e a imaginação fazendo uso de ferramentas químicas.
Material
- Tela de pintura (sem revestimento impermeabilizante)
- Objetos metálicos (ferro, cobre, alumínio, zinco etcétera)
- Solução de vinagre 20% (em volume) e sal de cozinha, ou água e um comprimido de permanganato de potássio
- Recipiente retangular (assadeira ou fórma)
- Luvas plásticas
Procedimento
- Dissolva uma colhér de sal de cozinha a cada 100 mililitros de solução de vinagre 20% (em volume) ou um comprimido de permanganato de potássio em 100 mililitros de água.
- Coloque a tela dentro do recipiente. Posicione os objetos metálicos sôbre ela de acôrdo com sua criatividade e sua imaginação.
- Despeje a solução de vinagre e sal de cozinha ou de permanganato de potássio sôbre as peças e aguarde por três dias, sem mexer na tela.
- Ao fim de três dias, retire cuidadosamente os objetos e deixe a tela secar por mais 2 dias ou até estar totalmente seca.

Observar e analisar
- Quais são as evidências de transformações químicas observadas ao fim da composição artística?
- Observe e compare as obras de seus colegas. Quais diferenças podem ser observadas? Como você as explicaria?
Fonte: Elaborado com base em PALMA, M. H. C; TIERA, V. A. O. Oxidação de metais. Química nova na escola, número 18, página 52-54, 2003. Disponível em: https://oeds.link/lKBKDv. Acesso em: 6 agosto 2022.
ATENÇÃO
O permanganato de potássio pode causar irritação, por isso deve-se evitar seu contato com a pele, os olhos e as mucosas. Use luvas ao manusear essa substância, descarte-as ao final do experimento e não se esqueça de lavar as mãos após essa atividade.
Respostas e comentários
Orientações didáticas
• A proposta desta seção Explore é abordar as transformações químicas com um viés artístico, proporcionando aos estudantes um ambiente de exploração da criatividade e de expressão de ideias e sentimentos, além da valorização de manisfestações artísticas diversas. dêsse modo, essa atividade pode ser trabalhada em parceria com o professor de Arte. É importante estimulá-los a trabalhar a criatividade e buscar reconhecer que a criação é um processo cognitivo e emocional. Deve-se discutir a importância das expressões artísticas nos dias de hoje e salientar que não existe obra “melhor” ou “mais bonita”; cada criação é única e reflete o estado individual no momento da confecção. Nessa atividade, o princípio é incentivar os estudantes a criar, imaginar e inovar. É aconselhável uma atividade integrada com os professores de Arte e/ou Filosofia para que sejam discutidos conceitos de arte, beleza e estética. Essa atividade conjunta pode ser realizada durante os dois dias de intervalo em que os estudantes aguardam que a tela esteja totalmente seca. Ao término das atividades, promova uma exposição e estenda o convite aos familiares dos estudantes. Por meio dessa proposta, favorece-se o trabalho com as competências gerais 2, 3, 4 e 9 da Educação Básica previstas pela Bê êne cê cê.
• A solução de vinagre 20% deve ser preparada adicionando-se 40 mL de vinagre a 160 mL de água e distribuída entre os estudantes.
Respostas – Explore
1. Resposta variável. Espera-se que tenha surgido um material colorido que se depositou sôbre a tela com coloração diferente para cada metal e um certo desgaste das peças metálicas.
2. Resposta pessoal. Espera-se que os estudantes percebam que cada metal utilizado gera uma côr diferente. Isso acontece porque cada metal reage com a solução adicionada gerando um produto diferente.

TEMA 3 Leis ponderais
Em uma reação química, a massa se conserva. As massas dos componentes da reação seguem sempre a mesma proporção.
No fim do século dezoito, vários estudiosos se empenhavam em compreender o fenômeno das transformações químicas. Por meio de atividades experimentais controladas envolvendo diferentes reagentes e produtos, foi possível estabelecer leis que regem todas as transformações químicas com base nas massas das substâncias. Essas leis foram chamadas de leis ponderais (do latim : “pêso”).
Lei da conservação das massas
Para explicar as reações químicas observadas experimentalmente, diversos cientistas durante os séculos quinze a dezoito assumiam que a massa empregada no início do experimento se mantinha constante ao longo de todo o processo. Como esse fato só pode ser verificado em um sistema fechado, ou seja, no qual não há troca de matéria entre o meio reacional e a vizinhança havia também aqueles que discordavam da conservação da massa e tinham outras hipóteses, como a teoria do flogisto.
Saiba mais!
TEORIA DO FLOGISTO
Uma porção de madeira, ao queimar, resulta em um produto final com massa menor do que a inicial. Para tentar explicar esse tipo de fenômeno, em meados do século dezessete, o químico e médico alemão (1660-1734) desenvolveu a seguinte teoria: o flogisto, um componente fluido de todo material combustível, era consumido quando a matéria era queimada, sendo absorvido pelo ar atmosférico.
Esse flogisto livre no ar seria mais tarde reabsorvido pela terra para compor novamente a matéria. Essa teoria foi considerada válida por muitos anos, uma vez que servia de explicação para diversas observações experimentais: a perda de massa na combustão de um material (pela perda de flogisto), o não acontecimento de uma reação de combustão quando não há presença de ar (pois o ar seria necessário para absorver o flogisto liberado na combustão) e o fato de uma reação de combustão terminar depois de algum tempo (fim do flogisto componente da matéria).

Respostas e comentários
Orientações didáticas
• Sugere-se iniciar o Tema 3 por meio de uma abordagem histórica. Proponha a leitura sôbre a teoria do flogisto do Saiba mais! Destaque que na época muitos cientistas buscavam explicar fenômenos observados (como a calcinação de metais e a combustão) utilizando em suas explicações o flogisto. Anos se passaram e a ideia do flogisto ganhou novos adeptos e mesmo após os trabalhos de Lavoisier, alguns cientistas não deixaram de acreditar no flogisto.
• Se achar pertinente, utilize trechos do artigo proposto nas Sugestões de recursos complementares para aprofundar esse episódio histórico e abordar o trabalho de lavoziêr.
• Essa fórma de abordagem estabelecida na História da Ciência possibilita, além do trabalho com os conceitos relativos às leis ponderais, destacar a Ciência como conhecimento provisório e produto da construção humana, ou seja, sujeita a interpretações e mudanças ao longo da história, favorecendo o trabalho com a competência geral 1 da Educação Básica e com a competência específica 1 de Ciências da Natureza para o Ensino Fundamental, previstas pela Bê êne cê cê.
• No contexto da percepção da natureza da Ciência e como uma atividade complementar, se houver disponibilidade, apresente aos estudantes o vídeo indicado nas Sugestões de recursos complementares e proponha uma conversa sôbre a necessidade e a importância do método científico. Destaque a participação da Filosofia como impulsionadora da Ciência, demonstrando a relação integrada entre as Ciências Humanas e as Ciências da Natureza no processo de construção e interpretação do conhecimento. Questione-os se existem outras fórmas de fazer Ciência e quais são as vantagens e as limitações do método científico contemporâneo.
Sugestões de recursos complementares
Vídeo
MÉTODO científico. 2016. (6 minutos). Publicado pelo canal Rogério Anton.
Vídeo didático discutindo as origens e as aplicações do método científico.
Disponível em: https://oeds.link/FMFM4B. Acesso em: 9 agosto 2022.
Artigo
PRADO, L.; CARNEIRO, M. C. O episódio histórico das teorias do flogisto e calórico: criando interfaces entre a História e Filosofia da Ciência e o Ensino de Química na busca pela humanização do trabalho científico. História da Ciência e Ensino – Construindo interfaces, volume 18, página 153-180, 2018.
Neste trabalho, os autores apresentam recortes históricos sôbre algumas contribuições de Lavoisier, a teoria do flogisto e a importância da experimentação nos séculos dezessete e dezoito.
Disponível em: https://oeds.link/5sEXXG. Acesso em: 9 agosto 2022.
Até meados do século dezoito, nenhum cientista havia proposto experimentos que comprovassem diretamente essas hipóteses. O físico-químico russo Mikhail Lomonosov (1711-1765) foi o primeiro a observar experimentalmente que a calcinaçãoglossário de metais gerava diferentes massas de produto quando o experimento era realizado em ambientes fechados ou abertos. Entretanto, em razão de alguns equívocos e da falta de conclusões reais registradas e dirigidas à comunidade científica fóra da Rússia, seus resultados acerca da conservação das massas não representaram uma grande descoberta.
Poucos anos depois, com base nos poucos registros experimentais de Lomonosov, o químico francês (1743-1794) provou experimentalmente que a calcinação do mercúrio metálico gerava um produto de mesma massa do sistema inicial e que havia o consumo de algum outro componente do ar nesse processo. Mais tarde, o próprio Lavoisier descobriu e descreveu que esse componente era o gás oxigênio.
Esse mesmo achado também era observado ao aquecer outros compostos metálicos, como o estanho. Com isso, ele finalmente propôs o que hoje conhecemos como a lei da conservação das massas, ou lei de lavoziêr, que afirma que a massa total das substâncias que participam de uma reação química permanece constante ao longo de todo o processo.

Respostas e comentários
Orientações didáticas
• Discuta com os estudantes a presença da mulher na Ciência; antigamente, pouco ou nenhum reconhecimento e incentivo era dado às mulheres cientistas, porém em muitos momentos da história elas contribuíram significativamente para o desenvolvimento científico, como foi o caso de , esposa de lavoziêr.
• Ao abordar a definição da lei da conservação das massas, retome o exemplo “Reação de decomposição do peróxido de hidrogênio” do Tema 2, no qual foram necessárias duas moléculas de peróxido de hidrogênio para se decompor em água e gás oxigênio. Naquele momento, abordou-se em termos de quantidade de átomos, sem classificar essa abordagem. Entretanto, com base nos postulados de Dalton, essa percepção serve de embasamento para o fato de que, se o número de átomos envolvidos é o mesmo, a massa do sistema também será a mesma.
Lei das proporções definidas
Após as definições de Lavoisier acerca da conservação das massas, outro químico francês, (1754-1826), realizou diversos experimentos variando apenas as quantidades em massa de reagentes. Já se sabia que as massas inicial e final permaneceriam as mesmas, mas prust estava investigando se, ao variar as quantidades de algum reagente, poderia haver alteração no consumo de outros reagentes ou na formação dos produtos.
Por exemplo, podemos pensar na reação entre as substâncias mercúrio e oxigênio, estudada por lavoziêr. Hoje, sabe-se que o produto dessa calcinação é o óxido de mercúrio(dois). Se a massa inicial de mercúrio metálico é alterada conforme os dados da tabela a seguir, a massa de gás oxigênio consumida e a massa de óxido de mercúrio(dois) produzida também irão variar, mas mantendo a mesma proporção.
|
Experimento |
Mercúrio metálico (reagente) |
Gás oxigênio (reagente) |
Óxido de mercúrio(II) (produto) |
Proporção entre reagentes e produtos (em massa) |
|---|---|---|---|---|
|
1 |
20 g |
1,6 g |
21,6 g |
12,5 : 1 : 13,5 |
|
2 |
40 g |
3,2 g |
43,2 g |
12,5 : 1 : 13,5 |
|
3 |
160 g |
12,8 g |
172,8 g |
12,5 : 1 : 13,5 |
No caso da reação de calcinação do mercúrio, para cada 12,5 gramas de mercúrio, é necessário 1 grama de gás oxigênio, gerando 13,5 gramas de óxido de mercúrio(dois) (proporção de 12,5 para 1 para 13,5). Com experimentos semelhantes a esse e partindo de diferentes tipos de reagente, Proust provou que a proporção em massa entre reagentes e produtos se mantém constante e definida para toda reação química. Ou seja, ao dobrar a massa de um reagente, é necessário dobrar a massa do outro reagente para que seja formado o dobro do produto. Essa conclusão deu origem à lei das proporções definidas, ou lei de prust.
De ôlho no tema
Quando a água é submetida a uma corrente elétrica, ocorre sua decomposição em gás hidrogênio e gás oxigênio. Ao realizar esse experimento, foram obtidos 2 gramas de gás hidrogênio e 16 gramas de gás oxigênio como produtos da reação. Aplicando as leis de prust e de lavoziêr, realize as atividades a seguir.
- Calcule quantos gramas de água foram utilizados nessa reação.
- Calcule quantos gramas de gás oxigênio seriam formados caso fossem reagidos inicialmente 72 gramas de água. Demonstre por meio das proporções em massa.
Respostas e comentários
Orientações didáticas
• Retomando o exemplo da decomposição do peróxido de hidrogênio, pergunte aos estudantes o que eles esperariam como produtos da reação, caso fossem representadas quatro moléculas de peróxido de hidrogênio na posição de reagentes (em vez de duas). Espera-se que eles intuitivamente sugiram a representação de duas moléculas de gás oxigênio e quatro moléculas de água. Com isso, eles terão deduzido o princípio da lei de Proust.
• É importante fazer a demonstração matemática do cálculo das proporções em massa e explicar que a representação dessa relação leva em consideração a massa do elemento em menor quantidade como o mínimo múltiplo comum dos demais. Assim, tem-se que o gás oxigênio é o composto de menor massa envolvida na reação. A massa inicial era 1,6 grama. Portanto, a razão da proporção é definida a partir de:
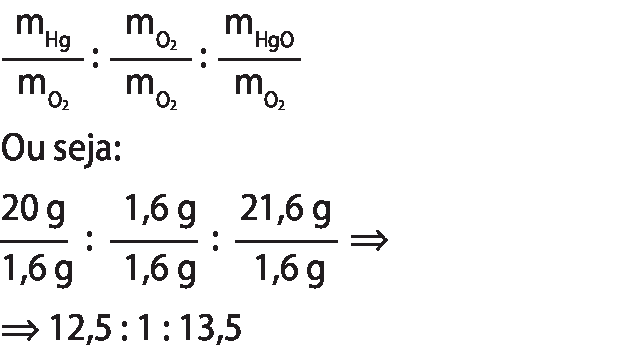
• A compreensão das leis ponderais é pré-requisito para o estabelecimento da proporção entre as massas de reagentes e de produtos de uma reação química; portanto, o estudo do Tema 3 mobiliza parcialmente a habilidade ê éfe zero nove cê ih zero dois, que será complementada no Tema 4.
Respostas – De ôlho no tema
a) Massa (água) = Massa (gás hidrogênio) + Massa (gás oxigênio) = 2 gramas + 16 gramas implica que Massa (água) = 18 gramas.
b)
|
Água (reagente) |
Gás hidrogênio (produto) |
Gás oxigênio (produto) |
Proporção em massa |
|---|---|---|---|
|
18 g |
2 g |
16 g |
9 : 1 : 8 |
|
72 g |
8 g |
64 g |
9 : 1 : 8 |

TEMA 4 Representação e balanceamento de reações químicas
As reações químicas podem ser representadas por equações químicas.
Equações químicas e balanceamento de equações
Equações químicas representam, por meio de símbolos, as transformações químicas. Nelas estão descritas as fórmulas químicas das substâncias que reagem, o estado físico em que se encontram as substâncias e a proporção entre aglomerados de cada substância que participa da transformação.
Considere a reação entre o gás hidrogênio, agádois, e o gás oxigênio, óhdois, para formar água, agádoisóh(éle).
• Em uma equação química, os reagentes e os produtos são expressos por suas fórmulas e seus respectivos estados físicos – sólido , líquido (éle) ou gasoso . Quando a substância ou espécie química está dissolvida em meio aquoso, utiliza-se o símbolo (aq). Reagentes são representados à esquerda de uma seta que indica o sentido da reação. Produtos são representados à direita dessa seta
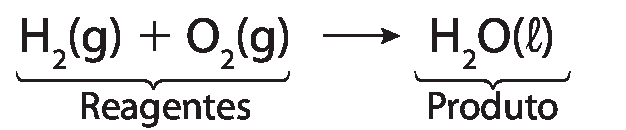
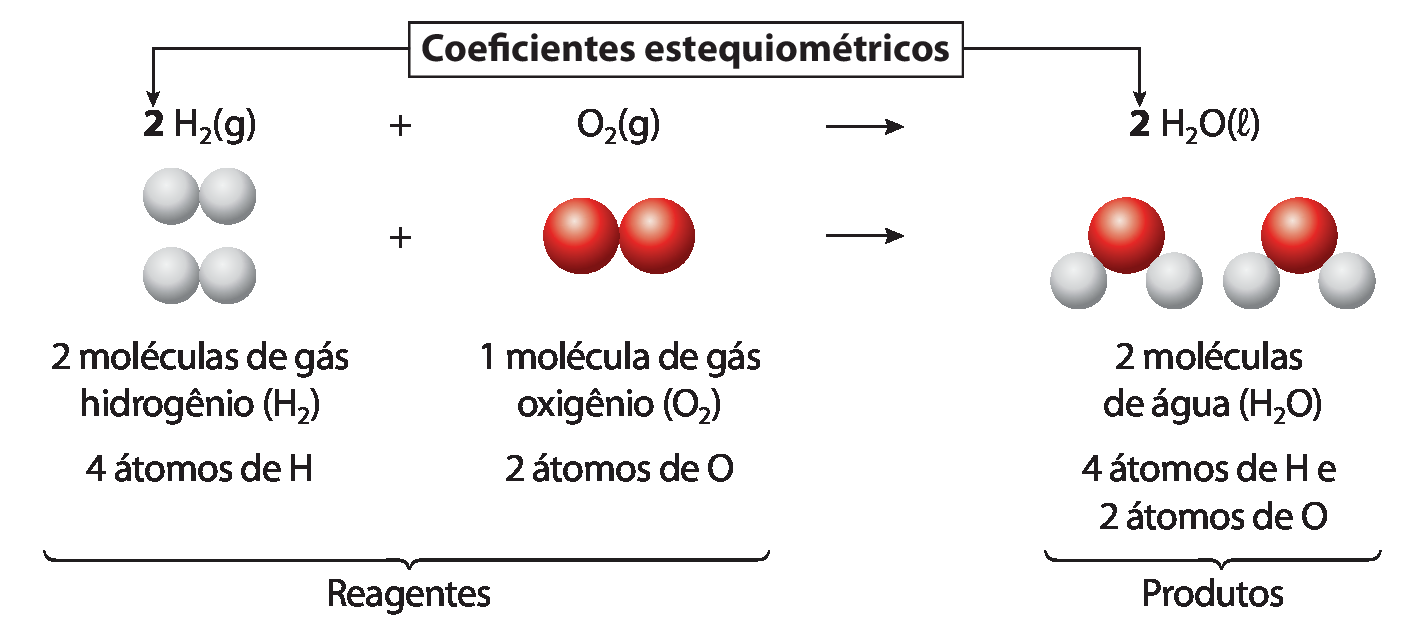
• Para que o número de átomos dos reagentes seja igual ao número de átomos dos produtos, devemos balancear a equação química. Para fazer isso, colocamos um número à frente das fórmulas dos reagentes e dos produtos, chamado coeficiente estequiométrico, que indica as quantidades necessárias para garantir que todos os átomos envolvidos estejam em igual quantidade em ambos os lados da equação. Quando esse número é igual a 1, não é necessário escrevê-lo.
Representação de reação química entre gás hidrogênio e gás oxigênio
Entrando na rede
Na página do PhET Interactive Simulations, disponível em: https://oeds.link/BQFqxg.
Acesso em: 16 agosto 2022.
Respostas e comentários
Orientações didáticas
• No Tema 4, o estudante entrará em contato com a representação e as relações quantitativas previstas pelas equações químicas, possibilitando o desenvolvimento da habilidade ê éfe zero nove cê ih zero dois. Ressalte que uma equação química deve apresentar dois aspectos: um qualitativo (ou seja, deve representar o que está ocorrendo, por meio das fórmulas e indicações de condições e estados físicos) e um quantitativo (a conservação do número de átomos, expressa pelos coeficientes estequiométricos). Se julgar necessário, converse com o professor de Matemática sôbre a melhor maneira de abordar o uso de coeficientes. Ele poderá retomar a propriedade distributiva da multiplicação, que é aplicada também no balanceamento das equações químicas.
• A rigor, os coeficientes estequiométricos designam quantidades em mol. No entanto, estas são proporcionais ao número de átomos, e optamos aqui por essa abordagem para fins de simplificação. Ressalte, porém, que essa é apenas uma interpretação dos coeficientes, e que outras serão apresentadas no Ensino Médio.
• Ao apresentar a ilustração “Representação de reação química entre gás hidrogênio e gás oxigênio”, destaque as diferentes fórmas de representação química: equação química, modêlo de partículas, nomes dos reagentes e dos produtos e fórmulas químicas. Entre essas fórmas de representação, destaque as fórmulas químicas e a equação química como uma linguagem universal, compreendida e utilizada em qualquer lugar do mundo.
• Após introduzir o balanceamento de equações químicas, proponha à turma, como metodologia ativa de ensino, uma gamificação com este conteúdo utilizando a página do PhET Interactive Simulations, indicada no Entrando na rede. Nela há um jôgo com três níveis de dificuldade em que o usuário deve balancear equações químicas, podendo optar por contagem de tempo. Inicialmente, considere se este será um jôgo competitivo ou colaborativo. Depois, estabeleça a dinâmica e as regras com os estudantes. Por exemplo: eles podem ser organizados aleatoriamente em duplas, cada uma tendo que resolver uma quantidade determinada de balanceamentos em um tempo determinado, considerando cada acerto como um ponto. Ao final, podem ser concedidos benefícios aos ganhadores, no caso de um jôgo competitivo, ou benefícios à turma toda proporcionais à quantidade de acertos, no caso de um jôgo colaborativo. Se não houver disponibilidade de computador e internet, o jôgo pode ser feito com as equações e os balanceamentos sendo feitos na lousa.
• Quando a reação química só acontece na presença de condições específicas, como luz e calor, deve-se indicá-las em cima da seta. Por exemplo, a reação de decomposição do carbonato de cálcio sólido, Cê a cê ó, em cal virgem, , e gás carbônico, cê ódois, só acontece sob aquecimento, sendo, assim, representada pela equação:
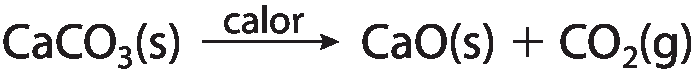
Note que os átomos envolvidos estão na mesma quantidade em ambos os lados da equação (1 átomo de cálcio, 1 átomo de carbono e 3 átomos de oxigênio). Nesse caso, a equação química já está balanceada. Lembre-se de que, quando o coeficiente estequiométrico é igual a 1, é comum não representá-lo.
Cálculo da massa de reagentes e de produtos
A proporção estequiométrica em uma reação química se reflete na proporção da massa de reagentes e produtos. Por exemplo, a reação de 4 gramas de gás hidrogênio (agádois) com 32 gramas de gás oxigênio (óhdois) produz 36 gramas de água (agádoisóh). O uso de 8 gramas de gás hidrogênio consome o dobro de gás oxigênio e leva à formação de uma massa de água duas vezes maior.
|
2 H2(g) |
+ |
O2(g) |
→ |
2 H2O(l) |
|
|---|---|---|---|---|---|
|
Quantidade em massa |
4 g |
reage com |
32 g |
produz |
36 g |
|
(×2) 8 g |
(×2) 64 g |
(×2) 72 g |
Note que a presença do coeficiente estequiométrico indica apenas a proporção em número de moléculas. A proporção em massa, entretanto, não se altera com a presença do coeficiente estequiométrico, mantendo-se sempre a mesma, como previsto pelas leis de lavoziêr e de prust.
Conhecer a proporção entre reagentes e produtos de uma reação é importante em diversas áreas tecnológicas. Na indústria química, por exemplo, para produzir determinada substância, é interessante saber exatamente as quantidades de matérias-primas a serem empregadas para que não haja desperdício e para que se possa programar a compra e o estoque dos reagentes utilizados.
Na prática, no entanto, o contróle das reações químicas é mais complexo. Nem sempre as quantidades previstas pelas proporções estequiométricas correspondem às quantidades obtidas, e fatores como temperatura e pressão podem ter influência no rendimento de uma reação, fazendo com que ele seja menor que 100%.
De ôlho no tema
O principal componente da palha de aço é o ferro. Após queimar uma amostra de palha de aço em um recipiente aberto, um estudante verificou que a massa inicial era menor que a massa final obtida. Considere a equação que representa a reação de combustão da palha de aço:
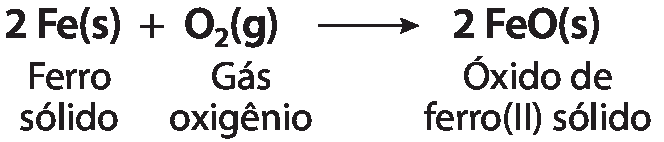
• Explique por que a massa final é maior que a massa inicial da amostra.
Respostas e comentários
Orientações didáticas
• Se julgar conveniente, após a apresentação do conteúdo do Tema 4, solicite aos estudantes que retomem as equações químicas e seus respectivos balanceamentos dispostos no Tema 2 e promova uma discussão para que eles compreendam a necessidade de balancear uma equação química, concluindo que os átomos não são criados nem destruídos em uma transformação química.
• Ao final deste Tema, pode ser desenvolvida a Oficina 2 – Balanceamento automático de equações, em que os estudantes, com base em seu conhecimento construído sôbre balanceamento de equações químicas e no pensamento computacional, devem propor um algoritmo para balancear automaticamente uma equação de uma reação química.
Resposta – De ôlho no tema
Na determinação da massa inicial da amostra, não é considerado o gás oxigênio presente na atmosfera. Na combustão, o ferro da amostra reage com o gás oxigênio presente no ar e fórma o óxido de ferrodois que compõe a amostra final, por isso se observa o ganho de massa.

Atividades
TEMAS 3 E 4
REGISTRE EM SEU CADERNO
ORGANIZAR
- A fotossíntese é um fenômeno natural representado pela reação entre o gás carbônico (cê ódois) e a água (agádoisóh) presentes na atmosfera, produzindo gás oxigênio (óhdois) e glicose (cêagáóh). Esse processo acontece apenas com a absorção de luz solar.
- Escreva a equação química balanceada que representa a reação da fotossíntese.
- Qual é a fonte de energia necessária para que essa reação ocorra?
- O etanol (cêdoisagáóh) é um importante combustível. No interior do motor dos automóveis, ele sofre a seguinte reação de combustão:
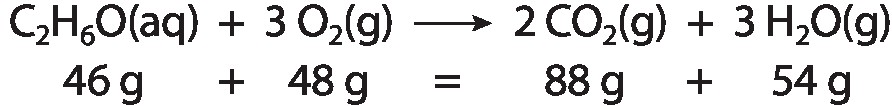
- De acôrdo com a reação química apresentada, a queima de 92 gramas de etanol vai produzir qual massa de gás carbônico (cê ódois)?
- Qual das reações químicas representadas a seguir não está adequadamente balanceada? Reescreva-a balanceando-a corretamente.
- Síntese da amônia:
b. Combustão completa da glicose:
c. Decomposição da sacarose:
ANALISAR
4. A imagem a seguir representa o experimento de Lavoisier em que ele comprovou a conservação das massas em uma reação química entre mercúrio metálico (líquido) e gás oxigênio (óhdois), formando o óxido de mercúriodois (), que é um pó fino de coloração avermelhada.
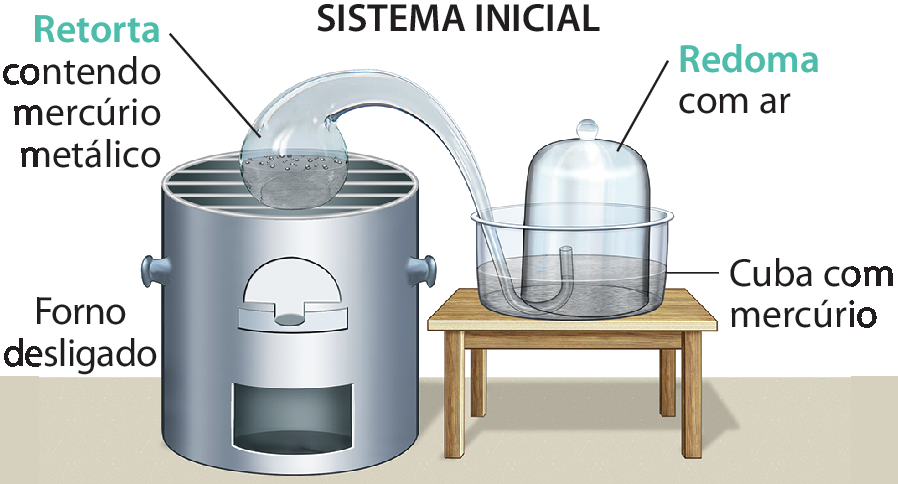
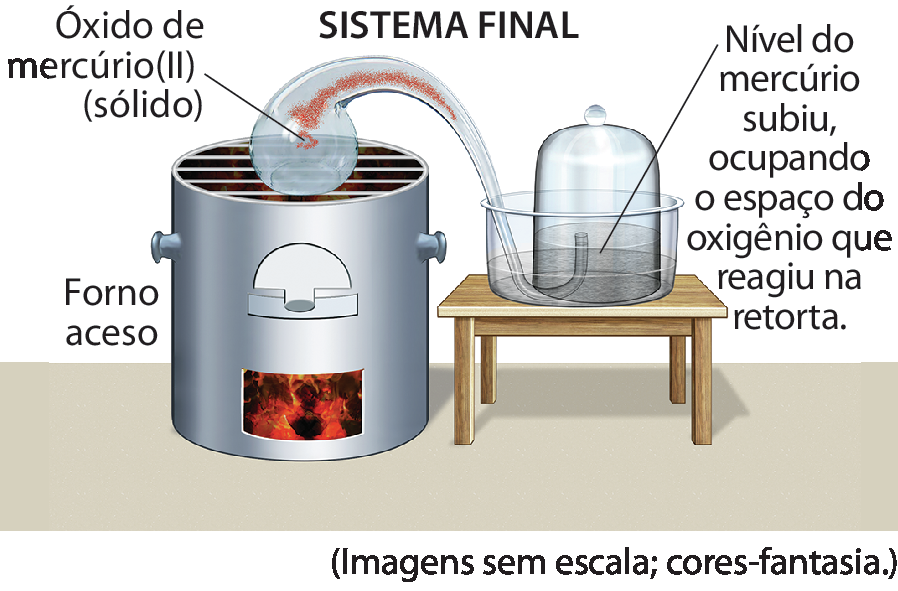
Retortaglossário
Redomaglossário
Fonte: Adaptado de ANNENBERG LEARNERChemistry: challenges and solutions, Unit. 1, Section 6: Modernizing Chemistry. Disponível em: https://oeds.link/rgXx7n. Acesso em: 6 agosto 2022.
- Qual foi a evidência de que a reação do mercúrio metálico acontecia com algum componente do ar? Como isso ia contra a teoria do flogisto?
- Ao fim do experimento, Lavoisier mediu a massa dos sistemas e concluiu que as massas se conservavam em uma reação química dentro de um sistema fechado. Essa conclusão seria a mesma para um sistema aberto? Por quê?
- Escreva a equação química balanceada e indique o estado físico dos reagentes e dos produtos.
COMPARTILHAR
5. É comum encontrarmos em livros e sites as inúmeras contribuições de lavoziêr para a Ciência, em especial para a Química, como a lei da conservação das massas e a formulação de uma nomenclatura química. No entanto, não é dado tanto destaque para sua esposa, que teve grande participação em suas pesquisas. Em grupos, pesquisem em fontes confiáveis sôbre a vida de e suas contribuições para a Ciência. Sob orientação do professor, produzam uma peça teatral para divulgar sua história.
Respostas e comentários
Respostas – Atividades
1. a)
Equação química. 6 CO2 gasoso mais 6 H2O líquido na presença da luz seta para C6H12O6 aquosa mais 6 O2 gasoso.; b) Luz solar.
2. De acôrdo com a lei de conservação das massas (lei de lavoziêr):
|
46 g de etanol |
− |
88 g de gás carbônico |
|
92 g de etanol |
− |
x |
x = 176 gramas de gás carbônico.
3. A alternativa que não está corretamente balanceada é a c. Balanceamento correto:
4. a) No sistema inicial, Lavoisier colocou mercúrio metálico líquido em uma retorta, cuja extremidade estava inserida em uma redoma imersa em uma cuba contendo mercúrio líquido. Assim, a extremidade da retorta estava em contato apenas com o ar contido dentro da redoma. Ao aquecer a retorta, o mercúrio metálico reagiu com o oxigênio presente no sistema, formando o óxido de mercúrio, que se depositou sôbre as paredes da retorta. À medida que o gás oxigênio da redoma era consumido na reação, o nível de mercúrio na redoma subia. Caso a teoria do flogisto estivesse correta, aconteceria o contrário: a queima do mercúrio levaria à formação do flogisto, que preencheria mais a redoma e diminuiria o nível do mercúrio. b) Não. Se o sistema fosse aberto, o mercúrio estaria em contato com o ar atmosférico e não seria possível medir a massa da quantidade de oxigênio consumida. c)
Equação química. 2 Hg líquido mais O2 gasoso seta com indicação de calor para 2 HgO sólido.5. Resposta pessoal. É provável que cada grupo de estudantes apresente curiosidades e novas informações sôbre , destacando determinados aspectos de sua vida. Por exemplo: nasceu em 1758 na França. Sua mãe faleceu aos três anos de idade e seu pai a enviou a um convento, onde teve oportunidade de ter uma excelente educação. Casou-se aos 13 anos com Antoane Lavoazier – um rapaz de 28 anos que se dedicava à ciência utilizando os recursos advindos de seu trabalho como coletor de impostos. se interessou pela Química, estudou e se tornou assistente de seu marido. Ela fazia anotações das observações dos experimentos e pela sua prática em artes fazia gravuras de cobre, além de pinturas e desenhos de instrumentos de laboratório. Ao contrário de seu marido, sabia latim e inglês e, por isso, foi de grande importância para Lavoisier ao traduzir tratados e publicações de Química, divulgando seu trabalho até o final de sua vida. Ao demandar o uso de diferentes linguagens, verbais e não verbais, para partilhar a história dessa personagem histórica, essa atividade favorece o desenvolvimento da competência geral 4 da Educação Básica, prevista pela Bê êne cê cê.

Pensar Ciência
O mau uso da Ciência e da Tecnologia

Adulterar um produto para obter ganhos comerciais não é particularidade da indústria da carne no Brasil, como foi exposto pela operação Carne Fraca [em 2017], da Polícia Federal. Estudos e ações pontuais mostram que o crime é praticado para maquiar outros alimentos que chegam à mesa dos brasileiros.
Quase ao mesmo tempo em que policiais federais levavam mais de 30 pessoas à prisão por receber propinas, comercializar alimentos vencidos ou adicionar substâncias impróprias ou em quantidade acima do permitido à carne, uma ação no Rio Grande do Sul que não teve a mesma repercussão tratava de um caso semelhante.
Conheça esse e outros problemas com produtos básicos do dia a dia.
Laticínios vencidos
reticências uma operação do Ministério Público do Rio Grande do Sul (ême pê-Rio Grande do Sul) com outras entidades cumpriu cinco mandados de prisão e quatro de busca e apreensão contra produtores de laticínios que adulteravam lotes já impróprios para o consumo.
Segundo as investigações, empresas locais vinham adicionando substâncias reticências de laticínios vencidos. E, no creme de leite, acrescentavam água para amolecer o produto envelhecido e ressecado.
reticências “A maioria das adulterações ocorre para aumentar a longevidade dos produtos”, explica Caroline Vaz, coordenadora do Centro de apôio Operacional de Defesa do Consumidor do ême pê-Rio Grande do Sul.
Mesmo após cinco anos de operações, Vaz diz que as denúncias continuam: “Quando descobrimos e coibimos um novo golpe, os grupos inventam uma nova técnica para adulterar os produtos”.
reticências

Respostas e comentários
Orientações didáticas
• A seção Pensar Ciência trata de um tema sério e de relevância para a sociedade: a fraude de produtos, em especial a adulteração de produtos alimentícios. Exponha os riscos à saúde do consumidor que tais práticas podem causar. Se julgar pertinente, leve para a sala de aula matérias de jornais que relatam casos de adulteração de produtos, como alimentos e combustível. Informe que, além da adulteração de alimentos, há outros tipos de fraudes nesse tipo de produto, como a falsificação, o roubo, o desvio e a manipulação. A matéria indicada na Sugestão de recurso complementar traz mais informações sôbre o tema e tabelas contendo casos de adulteração de leite e derivados no Brasil e no mundo.
• Essa seção oportuniza o trabalho do tê cê tê – Saúde – ao promover a leitura e reflexão sôbre a adulteração de produtos alimentícios e os riscos à saúde do consumidor.
Sugestão de recurso complementar
Artigo
DE CASTRO, M. T. Fraudes no leite: riscos para a segurança dos alimentos e para a Saúde Pública. Food Safety Brazil, 1julho 2019.
O texto aborda as principais fraudes no leite e em laticínios no Brasil e no mundo, as fórmas de detecção de fraudes nesse tipo de produto e os impactos na saúde pública.
Disponível em: https://oeds.link/nE3NRd
Acesso em: 24 agosto 2022.
Produtos adulterados
reticências Registros de adulteração da carne começaram em 2015, segundo a organização. E o caso do leite tem sido um problema persistente. Além de ureia e formol, há ainda adição de água oxigenada.
reticências
Um estudo publicado no periódico Food Chemistry revelou que 13% das amostras de mel no Brasil eram acrescidas de xarope de açúcar.
Outra pesquisa publicada no Journal of Heredity identificou fraude na substituição de espécies de peixes em Manaus.
E há ainda relatórios sôbre a adulteração do café com casca da própria planta, além de soja e milho, que são mais baratos. reticências
Fonte: MILHORANCE, F. Não é só com carne: leite com ureia e óleo em vez de azeite estão entre fraudes de alimentos no Brasil. bê bê cê News, 21 março 2017. Disponível em: https://oeds.link/C32lG1. Acesso em: 6 agosto 2022.


ATIVIDADES
REGISTRE EM SEU CADERNO
- Identifique no texto as substâncias utilizadas na adulteração do leite.
- A adição de água em um produto alimentício pode ser considerada uma adulteração do produto? Essa prática lesiona os consumidores? Justifique sua resposta.
- Explique, com suas palavras, a relação entre o título e o texto.
- Que medidas podem ser tomadas para evitar a adulteração e a compra de produtos falsificados?
Respostas e comentários
Respostas – Pensar Ciência
1. Ureia, formol e água oxigenada.
2. Resposta pessoal. Espera-se que os estudantes reflitam sôbre a situação e respondam que a adição de água em um produto altera suas características originais e engana o consumidor.
3. Resposta pessoal. O texto relaciona o mau uso do conhecimento científico para adulterar as características de produtos com objetivo de alcançar ganho financeiro. Essa prática traz prejuízos ao consumidor e pode afetar sua saúde.
4. Resposta pessoal. Os estudantes podem citar medidas mais rígidas de punição, aumento na fiscalização, campanhas de conscientização sôbre os riscos ao se comprar produtos falsificados, entre outras ações.

Atitudes para a vida
REGISTRE EM SEU CADERNO
Novos produtos e pesquisas clínicas
Você certamente se entusiasma com os últimos avanços da Medicina. Mas já parou para pensar como eles ocorreram? Consegue imaginar como foram descobertos os medicamentos para tratar os mais diversos tipos de doença? Faz ideia do esforço empregado por cientistas e pesquisadores até conseguir conter a Aids, o câncer, a diabetes? E o que dizer dos alimentos funcionais que você consome, do shampoo que você usa ou da sofisticada terapia celular?
Todos esses produtos, tratamentos e medicamentos inovadores têm algo em comum: por trás deles existe uma pesquisa clínica.
Mas, afinal, o que é pesquisa clínica? A pesquisa clínica é uma investigação que envolve seres humanos. Segundo definição dada pelo Conselho Nacional de Saúde, as pesquisas envolvendo seres humanos são aquelas pesquisas que, individual ou coletivamente, tenham como participante o ser humano, em sua totalidade ou partes dele, e o envolva de fórma direta ou indireta, incluindo o manejo de seus dados, informações ou materiais biológicos (Resolução 466 de 2012 cê êne ésse). reticências
Dentre os vários tipos de pesquisa clínica existentes, os ensaios clínicos são aqueles estudos conduzidos em seres humanos, com objetivo de comprovar que um medicamento, vacina, produto para saúde, cosmético ou alimento, sujeitos ao contrôle sanitário, é seguro e funciona.
A quantidade de estudos clínicos vem crescendo exponencialmente no Brasil nos últimos anos. Segundo dados obtidos do Clinical Trials, a base de dados internacional que registra os estudos clínicos no mundo, existem atualmente mais de 2 mil estudos clínicos sendo conduzidos no Brasil (2018) e ainda hoje existe um grande preconceito e desinformação envolvendo a pesquisa clínica.
Por definição, ensaio clínico é uma pesquisa conduzida em seres humanos com o objetivo de descobrir ou confirmar os efeitos clínicos e/ou farmacológicos e/ou qualquer outro efeito farmacodinâmico do medicamento experimental e/ou identificar qualquer reação adversa ao medicamento experimental e/ou estudar a absorção, distribuição, metabolismo e excreção do medicamento experimental para verificar sua segurança e/ou eficácia (anvisa érre dê cê 09/2015).
Em outras palavras, um ensaio clínico é uma pesquisa científica que pretende responder a uma pergunta sôbre determinada intervenção, que pode ser com um medicamento, um produto para a saúde, um alimento, um cosmético, uma vacina, enfim, uma intervenção que deve ser controlada a fim de avaliarmos a segurança e a eficácia dessa intervenção. Essas pesquisas são essenciais para a chegada de novas alternativas terapêuticas ao mercado. reticências
Fonte: SOCIEDADE BRASILEIRA DE PROFISSIONAIS EM PESQUISA CLÍNICA. Portal para os participantes de pesquisa. Disponível em: https://oeds.link/oMMA6F. Acesso em: 6 agosto 2022.

Respostas e comentários
Orientações didáticas
• A seção Atitudes para a vida traz como tema as pesquisas clínicas, possibilitando a discussão sôbre a relação entre ética e Ciência ao abordar o uso de seres humanos para fins científicos, e a relação entre Ciência e sociedade à luz do atendimento das demandas da sociedade por novos produtos, como medicamentos. Ao fomentar a interação entre os estudantes, indicando que a participação individual em um tema coletivo é possível, debatendo com base em argumentos científicos e com visão crítica assuntos que afetam a sociedade e comunicando-se de fórma clara, são fornecidos subsídios para que eles desenvolvam as competências gerais 1, 4, 7, 9 e 10 da Educação Básica e as competências específicas 1, 2, 3 e 8 de Ciências da Natureza para o Ensino Fundamental, previstas pela Bê êne cê cê.
• Sugere-se como abordagem a execução de um debate para que cada grupo de estudantes represente um setor da sociedade e defenda seus interesses no contexto das pesquisas clínicas de um medicamento, por exemplo. Divida os estudantes em três grupos. Cada um deles deve representar a indústria farmacêutica, a mídia e o consumidor final. É possível ter mais grupos representando outros setores sociais, como comunidade científica, políticos e acionistas das empresas. Para que a atividade seja produtiva e proveitosa, verifique se o número de estudantes na sala é compatível com a atividade. Se a turma for dividida em apenas três grupos, atente para o número de estudantes por grupo – mais do que seis atrapalha a participação de todos.
• Oriente os grupos a pesquisar sôbre o grupo social que representarão. O conhecimento sôbre pesquisas clínicas e os interesses de cada setor da sociedade provavelmente não são uma realidade conhecida pela maioria dos estudantes. O acesso a informações prévias permite mais segurança aos estudantes que queiram se posicionar no coletivo. É fundamental que eles percebam que cada grupo social defende interesses distintos e, por vezes, divergentes. O setor farmacêutico, por exemplo, pode ter interêsse em convencer os demais de que sua pesquisa teve um resultado promissor, mesmo quando não há evidências suficientes, tendo em vista o interêsse financeiro envolvido. A mídia, por sua vez, pode ter interêsse em compartilhar aquilo que dá mais audiência, às vezes de fórma sensacionalista e com pouca responsabilidade sôbre o que se reproduz. O consumidor final muitas vezes tem interêsse na cura de uma doença, e, portanto, representa a população vulnerável que pode se deixar influenciar por expectativas infundadas.
• A leitura e as atividades dessa seção possibilitam o desenvolvimento do tê cê tê – Saúde – ao incentivar os estudantes a conhecer pesquisas clínicas e a importância dos ensaios clínicos para o desenvolvimento de novos produtos.
TROCAR IDEIAS sôbre O TEMA
- Qual é a importância dos ensaios clínicos para a população?
- A criação de um novo produto (um medicamento, por exemplo) envolve diversos setores da sociedade. Considerem os seguintes setores:
A – A indústria farmacêutica, que financia as pesquisas e os ensaios clínicos.
B – A mídia, que divulga as notícias sôbre as pesquisas.
C – As pessoas doentes, que necessitam do medicamento em questão.
- Compreender a necessidade dos ensaios clínicos é importante para os três setores. Por quê? Considerem em suas explicações as particularidades de cada um deles.
- Em grupos, pesquisem reportagens ou notícias sobre novos medicamentos ou tratamentos médicos. É possível identificar os diferentes setores da sociedade envolvidos no material que vocês coletaram? O enfoque da notícia é diferente em fontes diversas (por exemplo, um jornal, um site e um noticiário da tê vê)? Façam colagens com as reportagens encontradas (ou uma montagem virtual) apontando as divergências de posicionamento. Exponham o resultado na sala de aula para discutir as conclusões alcançadas.
- Qual é a relação que se pode estabelecer entre o tema desta seção e a tirinha a seguir?

Fonte: RUAS, C. ainstain 8. Disponível em: https://oeds.link/4SArqV. Acesso em: 18 agosto 2022.
COMPARTILHAR
5. Para se submeter a um ensaio clínico como voluntária, uma pessoa deve compreender o processo e receber informações que lhe possibilitem tomar sua decisão. Em grupos, pesquisem quais são essas informações e façam um vídeo ou texto explicativo com o resultado da pesquisa.

COMO EU ME SAÍ?
- Fui capaz de perceber a importância da pesquisa cuidadosa no desenvolvimento de novos produtos?
- Contribuí para a discussão sobre a importância da clareza na comunicação científica?
- Reconheci a importância de checar as informações que chegam até mim?
Respostas e comentários
Orientações didáticas
• Explique aos estudantes que eles devem se colocar no lugar do grupo que representam. dêsse modo, a opinião que eles devem defender não necessariamente corresponde às suas posições individuais. Além disso, saliente a importância de haver respeito ao longo da atividade; ninguém deve ser constrangido. O espaço de argumentação coletiva pode ser muito produtivo caso haja respeito mútuo e trocas de opiniões. Se você identificar qualquer fórma de desrespeito entre eles, não hesite em parar a atividade e oriente-os no sentido contrário. A atividade tem o propósito de ensiná-los a ouvir e a se colocar no lugar do outro; não há vencedores no debate.
• Ao término do debate, disponha de tempo para a realização das atividades e das questões do Como eu me saí?, a fim de gerar reflexão e autocrítica.
Respostas – Atitudes para a vida
1. Espera-se que os estudantes reconheçam que os órgãos regulatórios têm procedimentos desenvolvidos pela comunidade científica para avaliar e garantir a segurança e a eficácia de medicamentos, sem isso não é possível assegurar a saúde dos pacientes. Em contrapartida, os pacientes podem reivindicar o comércio, desde que assumam os riscos de consumir um medicamento cuja eficácia não foi comprovada. As opiniões podem ser divergentes, mas espera-se que eles reconheçam serem essenciais a comprovação científica de eficácia e a segurança em questões como essa.
2. Resposta variável. Analise se os estudantes interpretaram o posicionamento do grupo que representavam de maneira coerente.
3. Resposta pessoal que depende do material coletado pelos estudantes.
4. Resposta pessoal. Espera-se que os estudantes percebam que a tirinha e o texto inicial promovem o questionamento acima da aceitação de afirmativas, mesmo quando estas vêm da comunidade científica. Toda observação e comunicação está sujeita ao viés de quem observa e comunica. Portanto, devem ser questionadas sob diferentes pontos de vista antes de tomarmos um posicionamento.
5. No site do qual foi retirado o texto, é possível encontrar as informações para a participação em um ensaio clínico. Caso os estudantes apresentem dificuldade em encontrar essas informações, forneça o enderêço eletrônico. É importante que produzam um material de divulgação, adequando a linguagem e o conteúdo de acôrdo com o público-alvo.

Compreender um texto
A arte da fabricação de vidros
Os materiais vítreos têm uma característica extremamente interessante: seja qual for a nossa necessidade, quase sempre temos a possibilidade de vir a utilizá-los nos mais diferentes contextos. Basta, para isto, olharmos ao nosso redor para verificarmos quão grande é a sua onipresença.
Plínio, o grande naturalista romano, reticências em sua enciclopédia Istória atribui aos fenícios a obtenção dos vidros. Segundo o relato, ao desembarcarem na costa da Síria reticências cêrca de 7000 anos antes de Cristo, os fenícios improvisaram fogões usando blocos de salitre sôbre a areia. Observaram que, passado algum tempo de fogo vivo, escorria uma substância líquida e brilhante que se solidificava rapidamente. Admite-se que os fenícios dedicaram muito tempo à reprodução daquele fenômeno, chegando à obtenção de materiais utilizáveis. O casamento entre cerâmica e vidro data já do Egito antigo, dado que, quando as cerâmicas eram queimadas, a presença acidental de areias ricas em cálcio e ferro, combinadas com carbonato de sódio, poderia ter sido o resultado das coberturas vitrificadas, observadas nas peças daquela época. São também do Egito antigo a arte de fazer vidros (isentos de cerâmica) e a adição de compostos de cobre e cobalto para originar as tonalidades azuladas.
Um desenvolvimento fundamental na arte de fazer objetos de vidro deu-se por volta do ano 200 antes de Cristo, quando artesãos sírios da região da Babilônia e Sidon desenvolveram a técnica de sopragem. reticências Os primeiros vidros incolores, entretanto, só foram obtidos por volta de 100 Depois de Cristo, em Alexandria, graças à introdução de óxido de manganês nas composições e de melhoramentos importantes nos fornos

Respostas e comentários
Orientações didáticas
• O texto apresentado busca estabelecer uma relação entre o desenvolvimento tecnológico e científico relacionado à fabricação do vidro e seu contexto histórico. Sugere-se trabalhar de maneira interdisciplinar com o professor de História, que pode, conforme a conveniência, propor aos estudantes que complementem as lacunas temporais verificadas. A fonte citada ao final do texto traz outras informações importantes e pode ser utilizada como ponto de partida para o planejamento da atividade interdisciplinar.
• Comente com os estudantes que, como o vidro, a descoberta de muitos materiais foi feita por meio de observações de fenômenos naturais ou experimentações, e que só depois de obter aquele material o ser humano percebeu quais poderiam ser suas aplicações e, a partir daí, começou a investigar e desenvolver mudanças para aperfeiçoar as suas propriedades de modo que atendesse a outras necessidades.
• A extração de matéria-prima de fórma sustentável e a reciclagem do vidro possibilitam a execução de um trabalho interdisciplinar com Geografia, promovendo a conscientização socioambiental e, portanto, favorecendo o desenvolvimento da competência específica 5 de Ciências da Natureza para o Ensino Fundamental, prevista pela Bê êne cê cê.
• Para responder às questões propostas, oriente os estudantes a retomar conhecimentos prévios sôbre equilíbrio ecológico, recursos naturais e reciclagem de materiais.
Sugestões de recursos complementares
Site
COMO é feita a bolinha de gude. 2017. (4 minutos). Publicado pelo canal Manual do mundo.
O vídeo mostra o processo de fabricação de bolinhas de gude, que recicla cacos de vidro na sua produção. Disponível em: https://oeds.link/O85Zc3. Acesso em: 9 agosto 2022.
Artigo
ALVES O. L.; GIMENEZ, I. F.; MAZALI, I. O. Vidros. Cadernos temáticos de Química Nova na Escola, São Paulo, página 13-24, maio 2001.
O artigo aborda os aspectos históricos da produção do vidro, a fabricação de vidros coloridos e questões ligadas à reciclagem.
Disponível em: https://oeds.link/DELcwp. Acesso em: 9 agosto 2022.
Ao nos confrontarmos com a história dos vidros, fica clara a importância dos povos que habitavam o Mediterrâneo e o Adriático. Neste particular, Veneza teve papel fundamental, sobretudo na Idade Média, por contar com um grande número de vidreiros, fortemente influenciados pela arte islâmica. Na Renascença, mais especificamente no século dezessete, houve um declínio da arte de fazer vidros Desenvolvimentos da química eram necessários para permitir a análise tanto dos vidros quanto das matérias-primas, e ainda o entendimento das diferenças entre os elementos, tais como o sódio e potássio ou cálcio e magnésio. Desenvolvimentos da física, por outro lado, eram necessários para o entendimento do que era o calor, por alguns intuído como uma fórma de elemento químico. A esta altura, tanto o fundido resultante como a solidificação e a formação dos vidros não eram entendidos.

reticências os primeiros estudos sôbre vidros foram realizados por Maicou Faraday, em 1830, o qual definiu vidros como sendo materiais “mais aparentados a uma solução de diferentes substâncias do que um composto em si”. reticências
Embora os vidros possam ser produzidos por uma grande variedade de métodos, a maioria continua sendo obtida pela fusão dos seus componentes, em elevadas temperaturas. Este procedimento sempre envolve a seleção de matérias-primas, cálculo das proporções relativas de cada componente, pesagem e mistura dos componentes para obtenção de um material de partida homogêneo. reticências
Fonte: ALVES, O. L.; GIMENEZ, I. F.; MAZALI, I. O. Vidros. Cadernos temáticos de Química Nova na Escola, maio 2001. Disponível em: https://oeds.link/DELcwp. Acesso em: 6 agosto 2022.

ATIVIDADES
REGISTRE EM SEU CADERNO
OBTER INFORMAÇÕES
- Copie os termos desconhecidos do texto. Pesquise seus significados e escreva um glossário.
- Quais desenvolvimentos da Física e quais desenvolvimentos da Química citados no texto foram necessários para compreender a fabricação do vidro?
INTERPRETAR
- Quais são as mudanças do estado físico da matéria envolvidas na produção do vidro?
- O processo de fusão das substâncias parece ser o único possível para obter vidro?
- O vidro é um material homogêneo ou heterogêneo? Explique sua resposta com base nas informações do texto e em seus conhecimentos prévios.
REFLETIR
- O vidro é um material que requer o uso de areia (que contém dióxido de silício) para sua fabricação. A extração da areia pode trazer prejuízos ao ambiente? Por quê?
- O vidro é um material 100% reciclável que pode ser usado para diversas finalidades. Qual é o destino dos vidros utilizados em sua residência? Quais são os cuidados tomados no descarte dele?
Respostas e comentários
Respostas – Compreender um texto
1. Resposta pessoal.
2. Química: análise dos vidros e das matérias-primas; entendimento das diferenças entre os elementos químicos. Física: entendimento do que é calor.
3. A produção do vidro envolve a fusão e a solidificação.
4. De acôrdo com o texto, embora a maioria dos vidros produzidos continue sendo obtida pelo processo de fusão das substâncias, existe também uma grande variedade de métodos para fabricá-los.
5. O texto indica que, de acôrdo com os vidros são “mais aparentados a uma solução de diferentes substâncias”. Soluções são misturas homogêneas. Além disso, há a informação de que, na fabricação do vidro, os componentes devem ser selecionados e misturados “para obtenção de um material de partida homogêneo”.
6. Espera-se que os estudantes considerem que a areia é um recurso natural e que a sua extração não controlada pode causar impactos ambientais irreversíveis, como o assoreamento de terrenos, a alteração das paisagens e o desequilíbrio ambiental.
7. Resposta pessoal. Ressalte a importância da reciclagem do vidro para evitar a extração dos recursos naturais e o gasto energético envolvido em sua produção. Auxilie-os na reflexão sôbre os acidentes que podem ocorrer com o descarte inadequado do vidro. Um vidro quebrado é material cortante e não deve ser descartado diretamente no lixo, por oferecer risco à pessoa que for manuseá-lo. Uma maneira de diminuir os riscos de acidente é embrulhar os resíduos do vidro quebrado e identificá-los, antes de descartá-los.
Glossário
- Liga metálica
- : mistura em que um ou mais componentes são metais.
- Voltar para o texto
- Calcinação
- : termo genérico que abrange diversos tipos de reação química em que um material sólido é submetido ao calor para a obtenção de um novo material.
- Voltar para o texto
- Retorta
- : recipiente de gargalo fino e curvo.
- Voltar para o texto
- Redoma
- : recipiente de vidro em formato de sino.
- Voltar para o texto