
CAPÍTULO 8 Substâncias químicas

Motivação
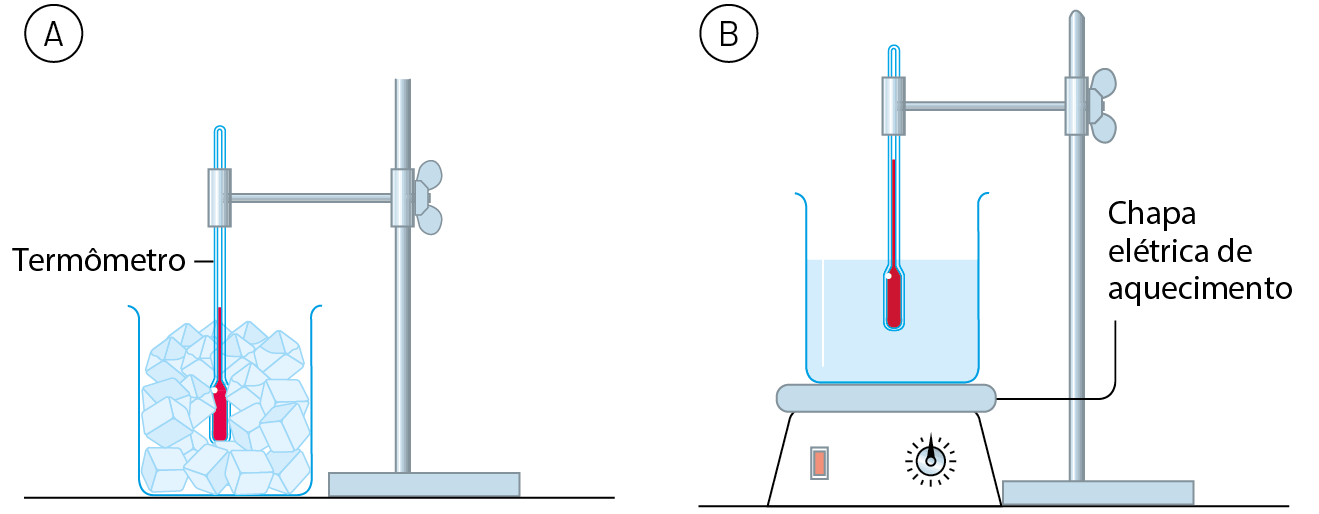
Observe a figura A. Os cubos de gelo acabaram de ser retirados do freezer e estão a ‒18 graus Célsius (isto é, 18 graus Celsius abaixo de zero). A sala está localizada ao nível do mar e sua temperatura é de 25 graus Célsius.
Acompanhando a temperatura do conteúdo do frasco, com o passar do tempo verifica-se que ela sobe gradualmente até chegar a 0 grau Célsius. Nessa temperatura, o gelo começa a derreter e, enquanto não derrete completamente, a temperatura não se altera, permanecendo no valor constante de 0 grau Célsius.
Assim que todo o gelo derrete, a temperatura volta a subir gradualmente até chegar a 25 graus Célsius, a mesma da sala. A partir daí, ela se mantém constante.
Em seguida, essa água líquida a 25 graus Célsius é aquecida com o auxílio da aparelhagem mostrada na figura B. Notamos que a temperatura sobe gradualmente até 100 graus Célsius, quando a água entra em ebulição. Enquanto a água permanece em ebulição, a temperatura mantém-se em 100 graus Célsius.
ATENÇÃO!
Por razão de segurança, para realizar qualquer experimento de Química você deve ter a AUTORIZAÇÃO e a SUPERVISÃO de seu professor.
Desenvolvimento do tema
1. Mudanças de fase
Inicialmente, a água estava no estado de agregação sólido, ou na fase sólida. Posteriormente, passou para o estado de agregação líquido, ou fase líquida, e, finalmente, para o estado de agregação gasoso, ou fase gasosa. As mudanças de estado de agregação, ou mudanças de fase, recebem nomes conforme mostra o esquema:
Esquema de mudanças de fase da água
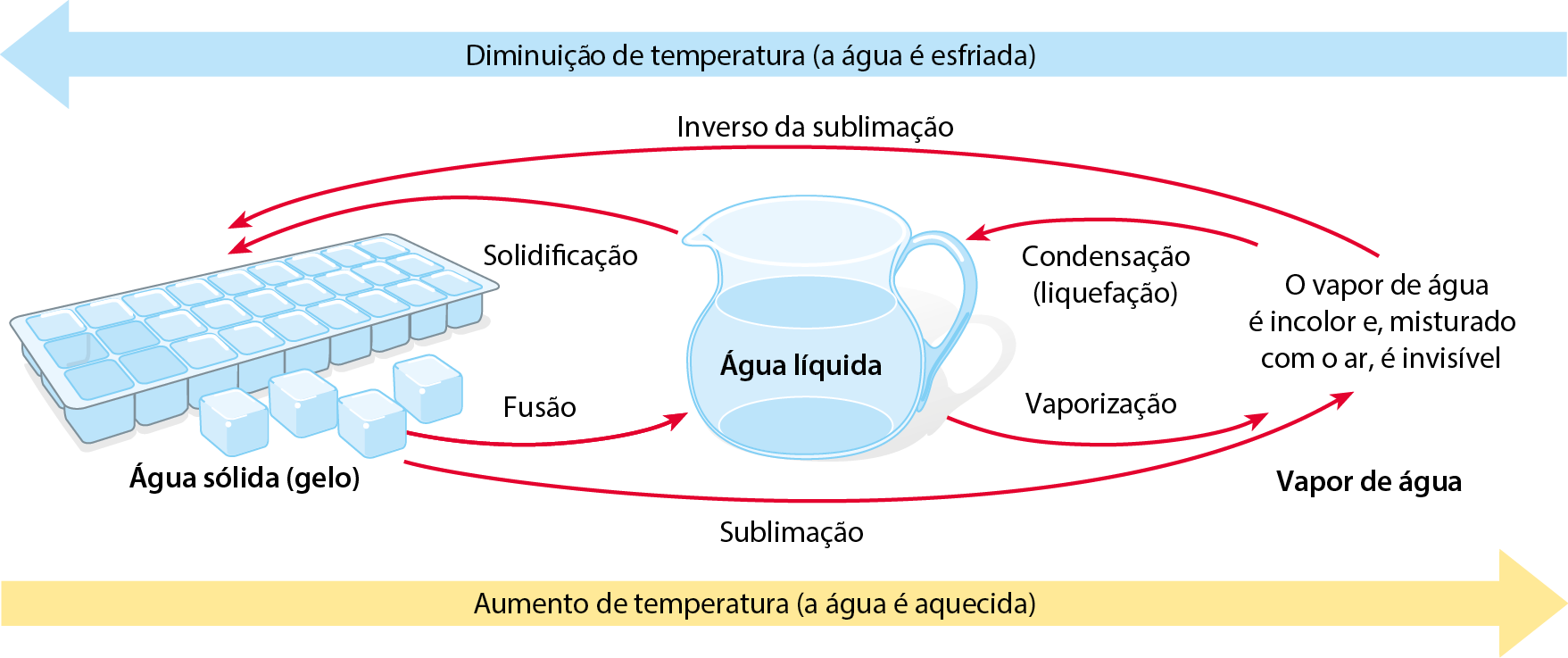
A vaporização, passagem da fase líquida para a fase gasosa, pode ocorrer de fórma lenta, na temperatura ambiente e sem a formação de bolhas, como no caso de uma roupa secando no varal. Nesse caso, a vaporização é denominada evaporação.
A vaporização também pode acontecer com a formação de bolhas durante o aquecimento do líquido. Nesse caso, é chamada ebulição (popularmente, fervura). A água, ao nível do mar, sofre ebulição na temperatura de 100 graus Célsius.
2. Temperatura de fusão (tê éfe) e temperatura de ebulição (tê e)
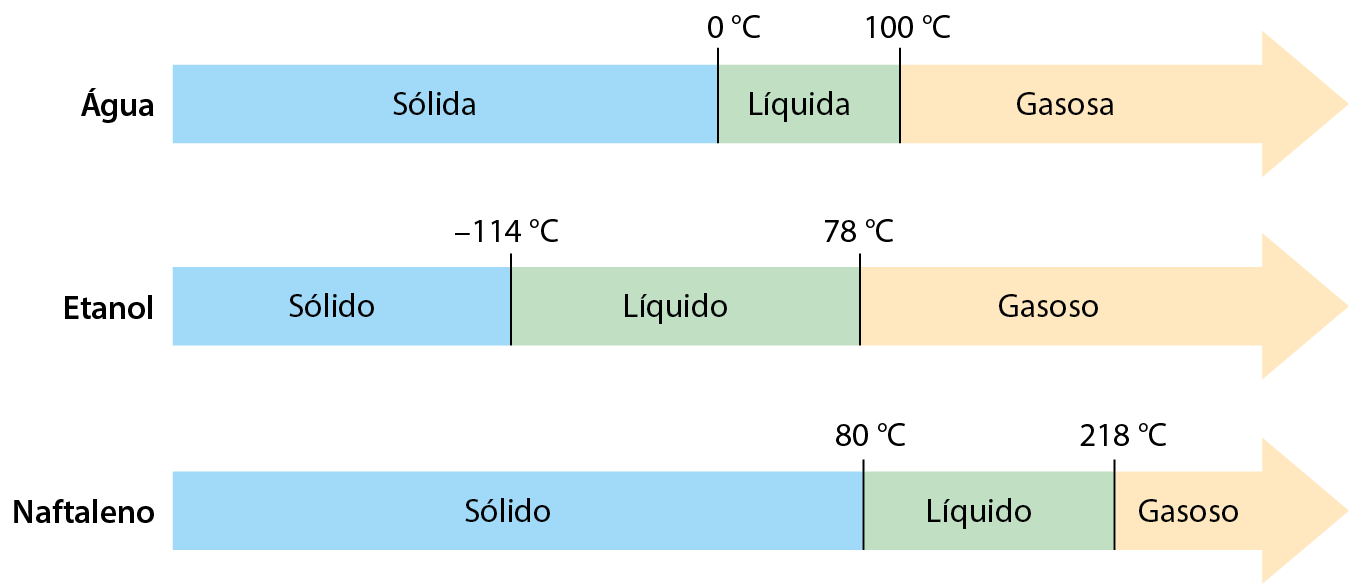
Como evidenciam os fatos mostrados anteriormente, ao nível do mar, a fusão da água sólida ocorre à temperatura fixa de 0 grau Célsius. Essa temperatura é a temperatura de fusão da água. A ebulição da água também ocorre a uma temperatura constante, que é de 100 graus Célsius ao nível do mar. Essa temperatura é a temperatura de ebulição da água.
A temperatura de fusão (tê éfe) é uma temperatura característica na qual determinada substância sofre fusão (durante o aquecimento) ou solidificação (durante o resfriamento).
A temperatura de ebulição (tê e) é uma temperatura característica na qual determinada substância sofre ebulição (durante o aquecimento) ou liquefação (durante o resfriamento).
No aquecimento ou no resfriamento de determinada substância, a temperatura permanece constante (na temperatura de fusão ou de ebulição) enquanto a mudança de fase estiver se processando.
A temperatura de ebulição das substâncias pode variar bastante, dependendo da pressão atmosférica do local em que o experimento é feito (já a temperatura de fusão varia menos intensamente). A pressão atmosférica, por sua vez, varia sensivelmente com a altitude do local. Vamos considerar subentendido, de agora em diante, que todos os dados relativos à ebulição e à fusão referem-se ao nível do mar (veja exemplos na tabela).
Aplicação dos conceitos de tê éfe e tê e
Uma utilidade de saber a temperatura de fusão e a de ebulição de determinada substância é poder prever as faixas de temperatura em que a substância é sólida, líquida ou gasosa. Exemplifiquemos no esquema a seguir com a água, o etanol e o naftaleno (consulte tê éfe e tê e dessas substâncias na tabela).
|
Substância |
TF |
TE |
|---|---|---|
|
Tungstênio |
3 414 |
5 555 |
|
Platina |
1 768 |
3 825 |
|
Ferro |
1 538 |
2 861 |
|
Cobre |
1 085 |
2 560 |
|
Ouro |
1 064 |
2 836 |
|
Prata |
962 |
2 162 |
|
Cloreto de sódio |
801 |
1 465 |
|
Alumínio |
660 |
2 519 |
|
Chumbo |
327 |
1 749 |
|
Iodo |
114 |
184 |
|
Enxofre |
95 |
445 |
|
Naftaleno |
80 |
218 |
|
Benzeno |
6 |
80 |
|
Água |
0 |
100 |
|
Bromo |
‒ 7 |
59 |
|
Mercúrio |
‒ 39 |
357 |
|
Amônia |
‒ 78 |
‒ 33 |
|
Metanol |
‒ 98 |
65 |
|
Cloro |
‒ 102 |
‒ 34 |
|
Etanol |
‒ 114 |
78 |
|
Metano |
‒ 182 |
‒ 162 |
|
Flúor |
‒ 220 |
‒ 188 |
|
Nitrogênio |
‒ 210 |
‒ 196 |
|
Oxigênio |
‒ 219 |
‒ 183 |
|
Hidrogênio |
‒ 259 |
‒ 253 |
Fonte: Reines, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 3-4ésse ésse e 4-44ésse ésse.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• temperatura de fusão • temperatura de ebulição
3. Matéria
A mesa, a cadeira, as nossas roupas e o nosso organismo são exemplos de matéria. Todas as “coisas” que fazem parte do nosso mundo são feitas de matéria. Do ponto de vista científico, matéria é tudo o que tem massa e ocupa lugar no espaço.

Massa
A unidade padrão para expressar massa é o quilograma (cá gê) e um importante submúltiplo dessa unidade é o grama (gê). Um quilograma equivale a mil gramas (1 cá gê = .1000 gê).
Volume
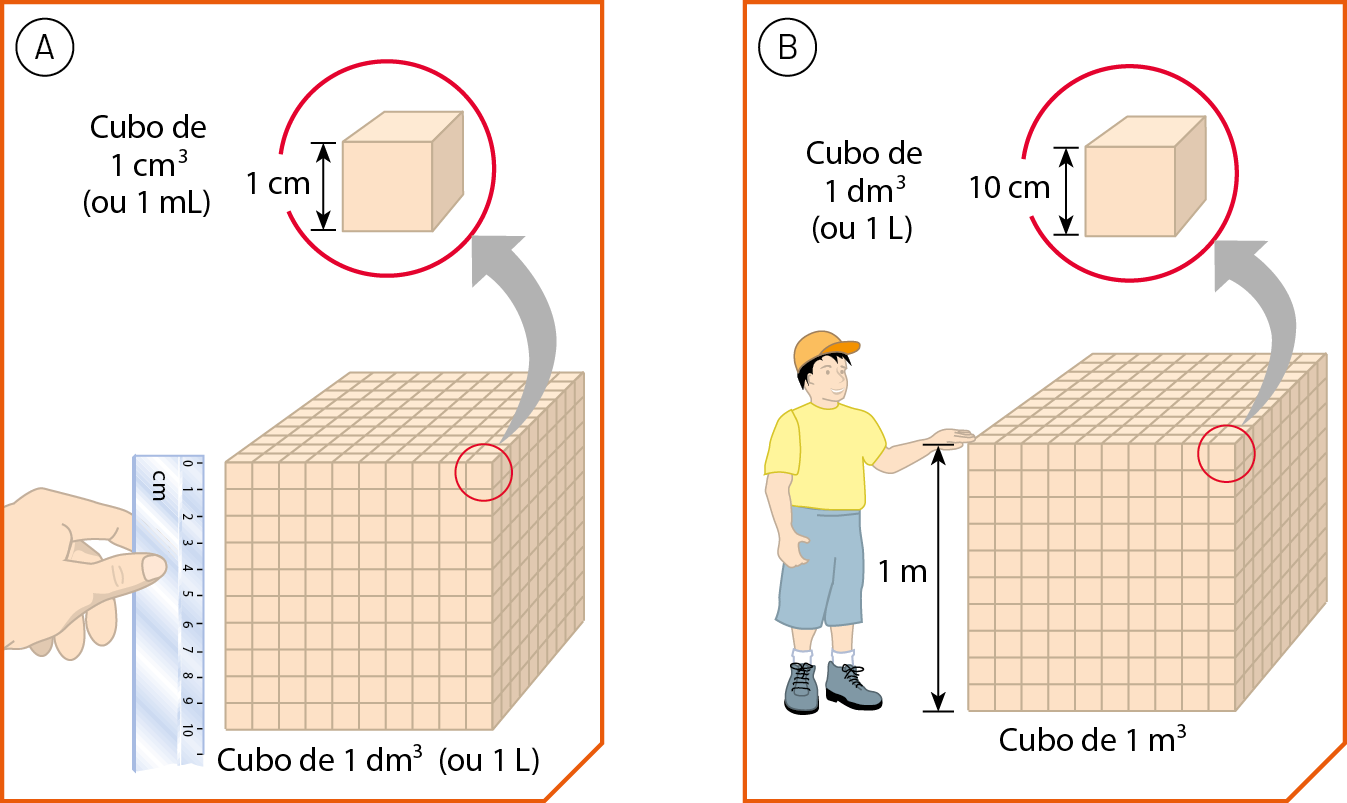
Ocupar lugar no espaço é uma característica associada à grandeza denominada volume. Em outras palavras, o volume de uma porção de matéria expressa quanto espaço é ocupado por ela. Exemplos de unidades de volume são o decímetro cúbico (dê ême), o litro (éle), o centímetro cúbico (cê ême), o mililitro (ême éle) e o metro cúbico (ême).
O decímetro cúbico e o litro
O decímetro cúbico (dê ême) é o volume de um cubo cuja aresta mede 1 dê ême (um decímetro), ou seja, 10 centímetros. É equivalente ao litro (éle).
O centímetro cúbico e o mililitro
O centímetro cúbico (cê ême) é o volume de um cubo cuja aresta mede 1 centímetro. A figura A ilustra que um decímetro cúbico corresponde a mil centímetros cúbicos (1 dê ême = .1000 cê ême).
O mililitro (ême éle) é a milésima parte do litro, assim, um litro corresponde a mil mililitros (1 éle = .1000 ême éle). Como um decímetro cúbico equivale a um litro, então:
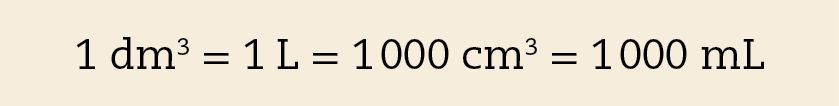
Assim, decorre que:
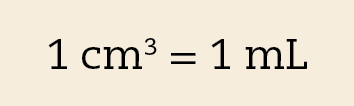
O metro cúbico
O metro cúbico (ême) é o volume de um cubo de aresta igual a 1 métro. Trata-se, portanto, de uma unidade de volume que expressa uma grandeza maior que as unidades anteriores. A figura B ilustra que um metro cúbico corresponde a mil decímetros cúbicos.
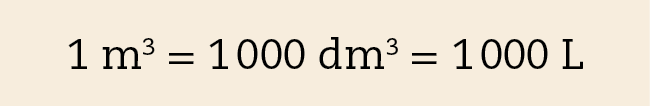
4. Densidade
Relação entre massa e volume
Para certo tipo de cortiça, verifica-se que:

Para o chumbo, verifica-se que:

Percebeu alguma regularidade?
O conceito de densidade
A razão entre massa e volume para a cortiça é:
O resultado obtido (0,32 grama por mililitro) é a densidade da cortiça, grandeza que informa quanto de massa existe em certo volume.
Para o chumbo, temos:
A densidade do chumbo (11,3 gramas por mililitro) é, portanto, diferente da densidade da cortiça. Um mililitro de chumbo tem maior massa que um mililitro de cortiça.

A unidade da densidade é composta de uma unidade de massa dividida por uma unidade de volume, por exemplo, em grama por mililitro, grama por litro, quilograma por litro etcétera
Comparando densidades
Para a água líquida, verifica-se que:

Com esses dados, calculamos a densidade da água líquida:
Assim, comparando os valores de densidades, concluímos que:
densidadecortiça menor que densidadeágua menor que densidadechumbo

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• matéria • volume • densidade
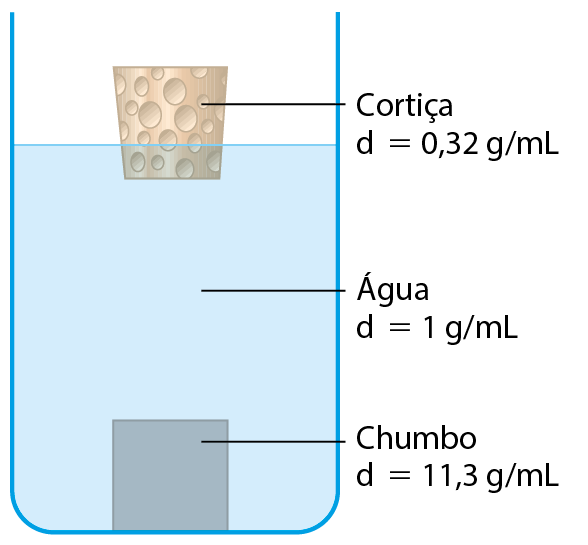
Densidade e flutuação
Quando jogamos pedaços de cortiça em um recipiente com água, verificamos que eles flutuam. Já ao jogarmos pedaços de chumbo, eles afundam. Algumas pessoas tentam explicar isso dizendo que o chumbo é mais “pesado” que a cortiça. Porém, um pedaço de cortiça de massa 10 quilogramas flutua, enquanto um pedaço de chumbo de 1 quilograma afunda. Não importa a massa: pedaços de cortiça flutuam na água e pedaços de chumbo afundam.
O resultado a que chegamos (dcortiça < dágua < dchumbo) sugere que a cortiça flutua na água porque é menos densa que ela e que o chumbo afunda porque é mais denso que esse líquido (veja a figura da cortiça e do chumbo na água). De fato, muitas evidências experimentais permitiram aos cientistas concluir que essa afirmação é verdadeira.
A comparação entre as densidades permite prever se um corpo vai afundar ou flutuar em certo líquido. Imagine, por exemplo, que uma bolinha de gude (d = 2,7 gramas por mililitro) e um pedaço de poliestireno expandido (d = 0,03 grama por mililitro) sejam colocados num frasco com azeite de oliva (d = 0,92 grama por mililitro). O que se pode prever?
Alguns fatores que afetam a densidade
A densidade depende, em primeiro lugar, da substância ou do material considerado. Alguns valores de densidade são apresentados na tabela a seguir.
Em segundo lugar, a densidade de um mesmo material depende da temperatura. Uma mudança de temperatura provoca a dilatação (aumento de volume) ou a contração (diminuição de volume) do material, e isso interfere no valor da densidade.
As mudanças de fase provocam mudanças na densidade de uma substância. A água líquida, por exemplo, tem densidade 1 grama por mililitro, e a água sólida (gelo) tem densidade 0,92 grama por mililitro. Isso permite entender por que o gelo flutua na água!
|
Substância |
Densidade (g/mL) a 25 °C |
Material |
Densidade |
|
|---|---|---|---|---|
|
Ósmio |
22,6 |
Madeira balsa |
0,11 a 0,14 |
|
|
Platina |
21,5 |
Bambu |
0,31 a 0,40 |
|
|
Ouro |
19,3 |
Couro seco |
0,86 |
|
|
Mercúrio |
13,5 |
Manteiga |
0,86 a 0,87 |
|
|
Chumbo |
11,3 |
Borracha |
0,91 a 1,25 |
|
|
Prata |
10,5 |
Ébano |
1,11 a 1,33 |
|
|
Cobre |
8,96 |
Gelatina |
1,27 |
|
|
Ferro |
7,87 |
Osso |
1,7 a 2,0 |
|
|
Iodo |
4,93 |
Giz |
1,9 a 2,8 |
|
|
Alumínio |
2,70 |
Areia |
2,14 a 2,36 |
|
|
Cloreto de sódio |
2,17 |
Porcelana |
2,3 a 2,5 |
|
|
Enxofre |
2,07 |
Bola de gude |
2,6 a 2,84 |
|
|
Água |
1,00 |
Quartzo |
2,65 |
|
|
Sódio |
0,97 |
Granito |
2,64 a 2,76 |
|
|
Lítio |
0,53 |
Diamante |
3,51 |
Fonte: Reines, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 4-44ésse ésse e 15-39ésse ésse.

Use a internet
A simulação da página da internet sugerida a seguir permite compreender a densidade através de simulações e experimentos. Você pode, por exemplo, modificar a massa ou o volume de um objeto e ver o que isso faz com a densidade.
O endereço é:
https://oeds.link/xgHIht. Acesso em: 16 abril 2022.
EM DESTAQUE
Por que os navios de ferro não afundam?

É fácil entender por que as embarcações feitas de madeira menos densa que a água não afundam. Mas, quando pensamos nos grandes navios, feitos de ferro, surge a dúvida: por que eles flutuam, se o ferro (d = 7,87 gramas por mililitro) é mais denso que a água?
Para responder a essa pergunta, vamos inicialmente considerar um pedaço de ferro maciço. Se ele for jogado na água, afundará.
Com a mesma quantidade de ferro, vamos produzir uma esfera oca, totalmente fechada, em cujo interior exista apenas ar. Uma vez colocada na água, verifica-se que essa esfera flutua. Apesar da alta densidade do ferro, o ar interno é tão pouco denso que isso faz com que a densidade total do corpo seja pequena, menor que a da água.
Em seguida, essa esfera é cortada ao meio, o que produz dois hemisférios. Um deles é colocado delicadamente na água, com a abertura para cima, e verifica-se que flutua. A explicação é a mesma usada no caso da esfera oca. Quando consideramos o hemisfério como um todo, incluindo o ar, a sua densidade é mais baixa que a da água e, consequentemente, ele não afunda.
Se o outro hemisfério for preenchido com água e colocado na água, ele afundará. Isso significa que sua densidade, incluindo a água interna, é maior que a da água.
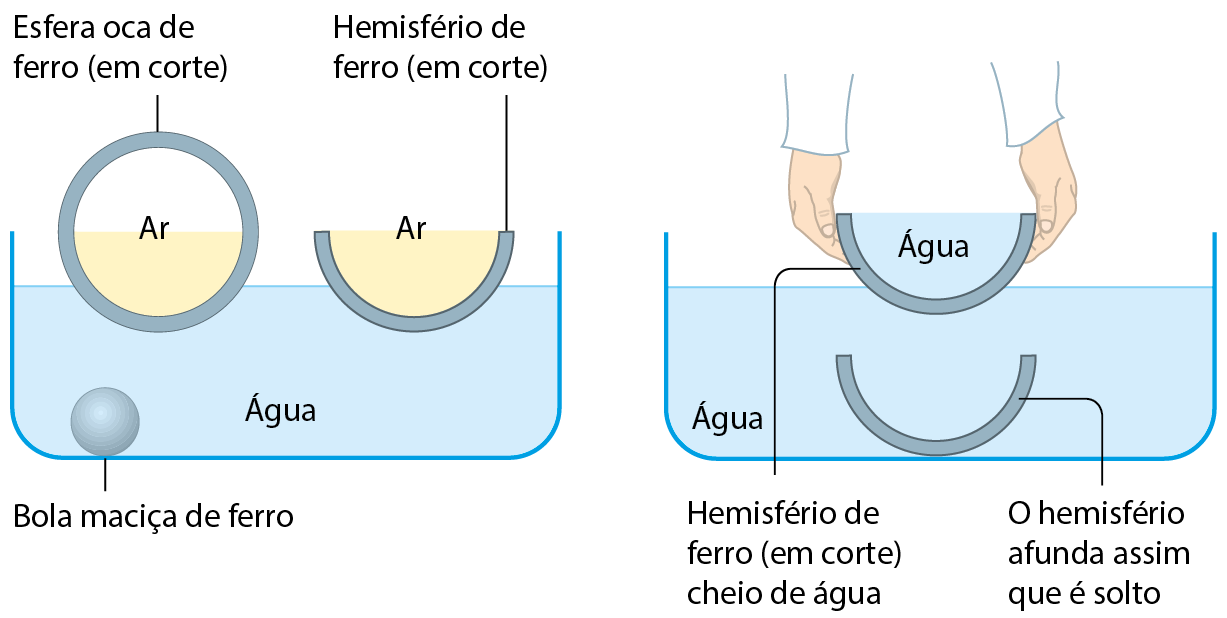
E agora, você consegue explicar por que um navio de ferro flutua na água? E por que um furo no casco pode ser fatal?
Você pode comprovar o que acabamos de dizer, repetindo em casa a demonstração que aparece nas fotos a seguir. Você necessitará de uma vasilha com água e de massa de modelar.


Elaborado com dados obtidos de: LIU, C. The handy physics answer book. terceira edição Detroit: Visible Ink Press, 2021.
EM DESTAQUE
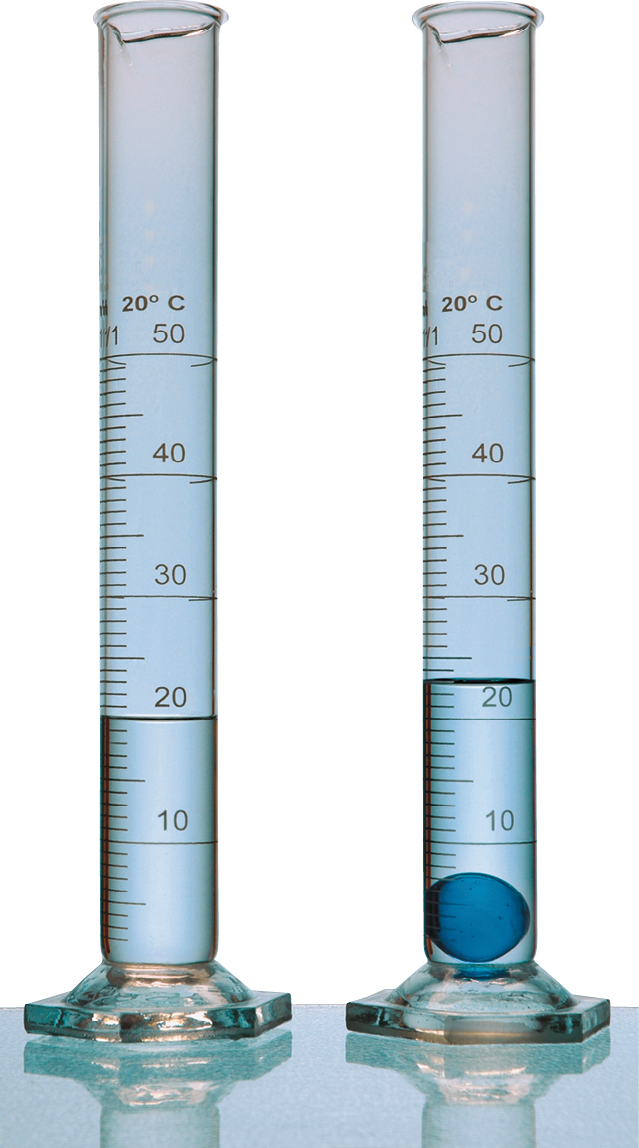
Um experimento e três conclusões
Ambas as provetas (cilindros com graduação de volume) da foto continham água até a marca de 20 mililitros. Uma bolinha de gude foi colocada em uma delas. Esse simples experimento revela fatos importantes.
- A bolinha de gude é mais densa que a água.
- A subida do nível da água mostra que duas porções de matéria não podem ocupar o mesmo lugar no espaço, num mesmo instante. Essa é uma propriedade da matéria denominada impenetrabilidade.
- É possível determinar o volume da bola. Você consegue dizer como?
Elaborado com dados obtidos de: , J. Chemistry. quinta edição Nova York: McGraw-Hill, 2020.
5. Substâncias químicas
Este capítulo e o seguinte têm por objetivo fornecer a você uma visão introdutória da Química, ciência que se ocupa fundamentalmente de estudar:
- a composição das substâncias químicas;
- as propriedades das substâncias químicas;
- as transformações que as substâncias químicas podem sofrer para formar outras substâncias químicas e as condições necessárias para favorecer ou impedir tais transformações.
O conceito de substância química — ou simplesmente substância, como vamos chamar de agora em diante — está intimamente relacionado ao estudo da Química.
Os químicos consideram que uma substância é uma porção de matéria que tem propriedades bem definidas e que lhe são características. Entre essas propriedades estão a temperatura de fusão (tê éfe), a temperatura de ebulição (tê e), a densidade (d), o fato de ser inflamável ou não, a cor etcétera
Duas substâncias diferentes podem, eventualmente, possuir algumas propriedades iguais, mas nunca todas elas.




6. Misturas
Substâncias puras vérçus misturas
A água possui densidade 1,0 grama por mililitro, e o cloreto de sódio, 2,17 gramas por mililitro. Ao acrescentar cloreto de sódio à água e mexer, obtém-se uma mistura cuja densidade é diferente da dos dois componentes isolados. Analise a tabela a seguir, que ajuda a esclarecer esse ponto.
|
Porcentagem de sal na massa total da mistura (%) |
Densidade |
|---|---|
|
1 |
1,005 |
|
2 |
1,013 |
|
4 |
1,027 |
|
6 |
1,041 |
|
8 |
1,056 |
|
10 |
1,071 |
|
12 |
1,086 |
|
14 |
1,101 |
|
16 |
1,116 |
|
18 |
1,132 |
|
20 |
1,148 |
|
22 |
1,164 |
|
24 |
1,184 |
|
26 |
1,197 |
Fonte: , B. S. êti áli. Vogel's textbook of practical Organic Chemistry. quarta edição Londres: Longman, 1987. página .1312.
Como se pode perceber, a densidade de uma mistura de água e cloreto de sódio varia de acôrdo com a porcentagem de sal.
Verifica-se experimentalmente que uma mistura de água e cloreto de sódio, colocada num congelador, não congela a 0 grau Célsius. Essa mistura inicia seu congelamento abaixo de 0 grau Célsius (o valor exato depende do teor de sal), e a temperatura não permanece constante durante o congelamento, mas diminui gradualmente.
Quando aquecida, verifica-se que essa mistura não entra em ebulição a 100 graus Célsius. Ela começa a ferver acima de 100 graus Célsius (o valor exato depende do teor de sal), e a temperatura não permanece constante durante a ebulição, mas aumenta progressivamente.
Perceba, portanto, que uma mistura de água e cloreto de sódio possui propriedades que não são características da água nem do sal.
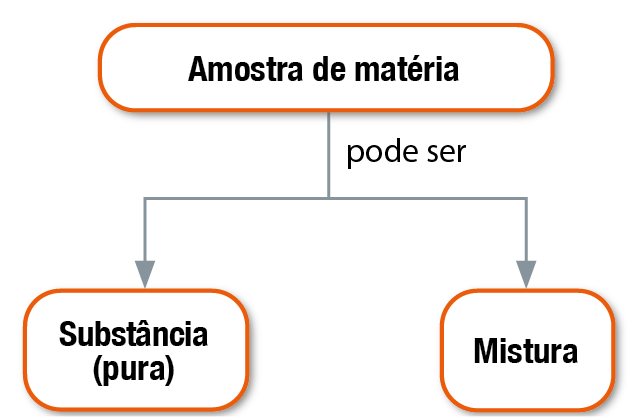
Agora podemos estabelecer uma importante diferença entre substância pura e mistura.
Uma substância pura, como o próprio nome diz, está pura, ou seja, não está misturada com outra substância ou com outras substâncias. Em geral, quando um químico se refere à substância água, por exemplo, ele está deixando subentendido que se refere à substância pura água.
Já uma mistura é a reunião de duas ou mais substâncias puras. A partir do momento em que elas são reunidas, deixam obviamente de ser consideradas substâncias puras. Elas passam a ser as substâncias componentes da mistura.

ATIVIDADE
Tema para pesquisa
O que é um densímetro e para que é usado nos postos de combustível?
Misturas heterogêneas e misturas homogêneas
Ao adicionar um pouco de ferro em pó a um pouco de enxofre em pó, obtém-se uma mistura que não possui propriedades iguais em todos os seus pontos. Os pequenos fragmentos de ferro possuem as propriedades da substância ferro (cor cinza-metálica tê éfe = .1538 graus Célsius etcétera) e os pequenos fragmentos de enxofre possuem as propriedades da substância enxofre (cor amarela, tê éfe = 95 graus Célsius etcétera).
Trata-se de uma mistura heterogênea, um tipo de mistura que não possui as mesmas propriedades em toda a sua extensão.
Por outro lado, se colocarmos uma pitada de açúcar numa porção de água pura e mexermos com uma colhér por alguns minutos, obteremos uma mistura que possui as mesmas propriedades em toda a sua extensão. Assim, por exemplo, quaisquer porções dessa solução são incolores e têm a mesma densidade; enfim, compartilham as mesmas propriedades.
Esse é um exemplo de mistura homogênea, mistura que tem as mesmas propriedades em todos os seus pontos.


Número de fases
Quando estudamos uma amostra qualquer de matéria — seja ela substância pura ou mistura —, é bastante útil o conceito de fase.
Podemos definir fase como uma porção de uma amostra de matéria que apresenta as mesmas propriedades. Uma fase pode apresentar-se contínua ou fragmentada em várias partes.
Para deixar isso mais claro, considere a mistura de óleo e água mostrada na foto. Trata-se de uma mistura heterogênea, na qual uma fase é óleo e a outra fase é água. Nesse exemplo, ambas as fases são contínuas.
Voltemos ao exemplo da mistura de ferro e enxofre. Nela, os grãozinhos de ferro constituem uma fase, e os grãozinhos de enxofre constituem outra fase. Diferentemente da mistura de água e óleo, nesse caso cada fase apresenta-se fragmentada em muitas partes.
Numa mistura de água e açúcar, que é homogênea, existe uma só fase. Isso pode ser generalizado para todas as misturas homogêneas. Já que apresentam as mesmas propriedades em todos os seus pontos, são constituídas necessariamente por uma única fase.
Assim, concluímos que uma mistura homogênea apresenta uma só fase e uma mistura heterogênea apresenta duas ou mais fases.


ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• substância química • mistura • mistura homogênea • mistura heterogênea • fase
EM DESTAQUE
As soluções e o cotidiano
Solução é o nome dado pelos químicos para qualquer mistura homogênea.
Quando você coloca um pouco de açúcar na água e mexe até obter uma só fase, está fazendo uma solução. O mesmo acontece se você adicionar um pouquinho de sal de cozinha à água e misturar bem.
Em Química, o verbo dissolver pode ser empregado de duas maneiras. Podemos usá-lo para nos referir ao ato praticado por uma pessoa ao fazer uma solução. Uma frase como “eu dissolvi o açúcar em água” exemplifica esse uso. Outro modo de usar o verbo dissolver é aplicá-lo a uma substância a fim de expressar a propriedade que a substância tem de misturar-se a outra, originando uma solução. Numa frase como “a água dissolve o açúcar”, temos um exemplo dêsse tipo de uso.
Quando uma substância é capaz de dissolver outra, costumamos chamá-la solvente. Assim, a água é um solvente para o açúcar, para o sal de cozinha, para o etanol (álcool comum) e para várias outras substâncias.
A substância que é dissolvida num solvente, a fim de fazer uma solução, é denominada soluto.
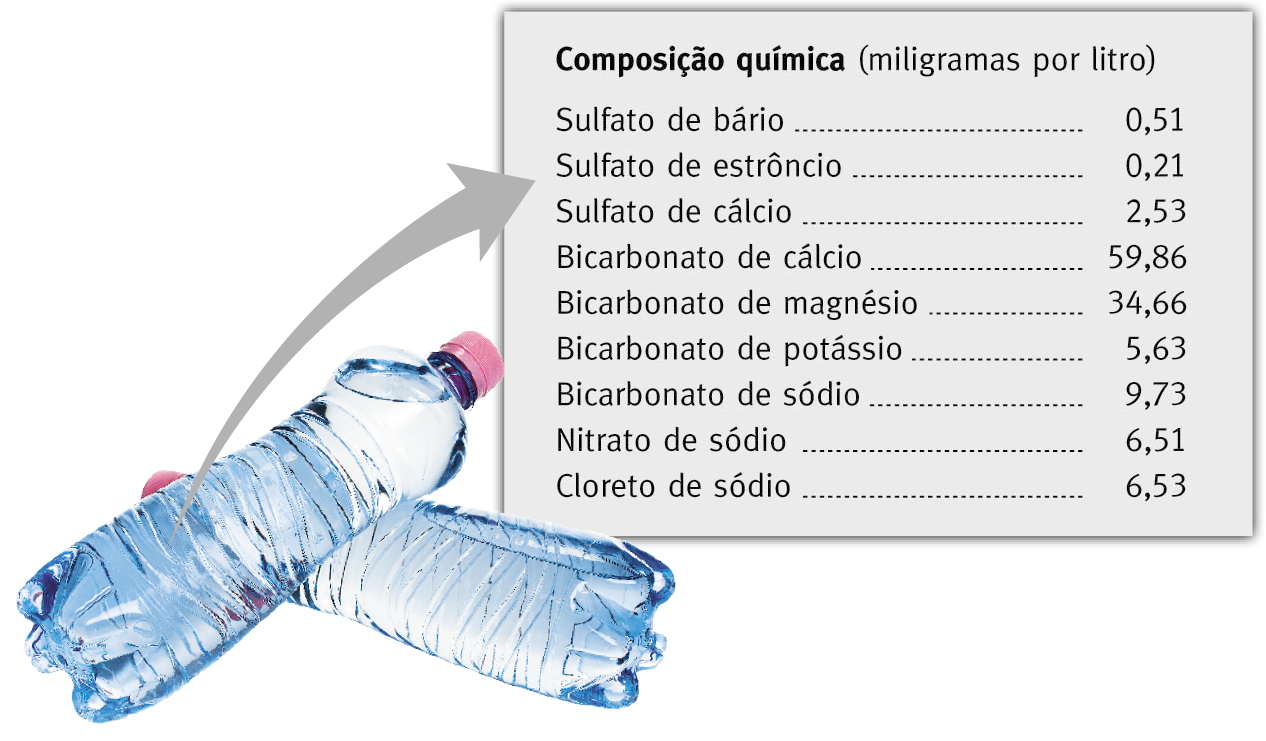
Se uma solução é preparada com o solvente água, dizemos que é uma solução aquosa. Ao dissolver açúcar em água, por exemplo, obtemos uma solução aquosa de açúcar, na qual a água é o solvente e o açúcar é o soluto.
São inúmeras as soluções presentes em nosso cotidiano, principalmente as soluções aquosas. Entre os exemplos destas últimas, temos os sucos de frutas, os refrigerantes (desconsiderando as bolhas de gás eventualmente presentes), a saliva, o plasma sanguíneo, a urina, a água da chuva e até mesmo a água potável.
Embora grande parte das soluções esteja no estado líquido, existem também soluções gasosas e soluções sólidas.
O ar atmosférico, convenientemente filtrado para eliminar partículas nele dispersas, é um exemplo de solução gasosa, na qual predominam o gás nitrogênio (cêrca de 78%) e o gás oxigênio (cêrca de 21%).
Entre as soluções sólidas, podemos destacar o ouro usado pelos joalheiros (mistura de ouro e cobre em proporção adequada) e o latão (mistura de cobre e zinco em proporção adequada).
Elaborado com dados obtidos de: Zoomdal, S. S.; Zoomdal, S. A.; DECOSTE, D. J. Chemistry. décima edição bóston: Cengage, 2018.


ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• solução • solvente • soluto
7. Separação de misturas
Os materiais naturais são, em sua maioria, misturas de substâncias. Para que os químicos consigam estudar a composição, as propriedades e as transformações das substâncias, é essencial que consigam purificar as misturas.
Assim, em muitos laboratórios de pesquisa, o uso de técnicas de separação de misturas faz parte do dia a dia dos químicos. Tal assunto — separação de misturas — é muito vasto. Vamos aqui mostrar exemplos de métodos químicos que permitem separar algumas misturas presentes no cotidiano, por exemplo, areia e água, óleo e água, água e sal.
Separação de mistura de areia e água
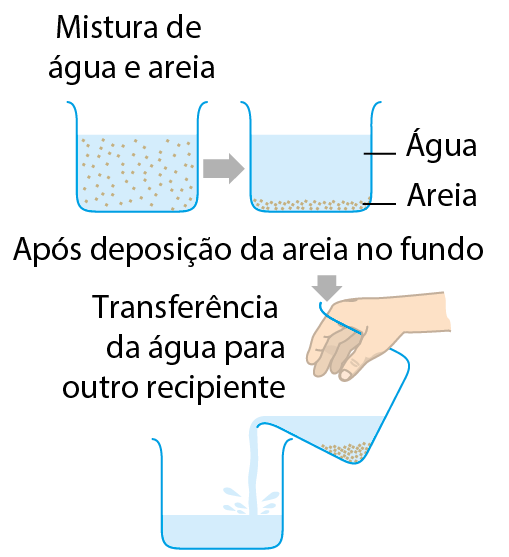
A mistura de areia e água é heterogênea e formada por duas fases. Uma delas é a água, e a outra é a areia.
Uma maneira de separar essa mistura é esperar que a areia se deposite no fundo do recipiente. (Essa deposição de sólido no fundo do frasco é chamada sedimentação.) Após a deposição da areia, pode-se cuidadosamente transferir a água para outro recipiente. Restarão, no fundo do frasco original, a areia e um pouco de água (esse resíduo de água pode ser eliminado, por exemplo, esperando que evapore). Essa técnica de separação, esquematizada a seguir, é chamada decantação.
Para separar misturas heterogêneas sólido/líquido existe outro processo, um pouco mais trabalhoso, porém de maior eficiência que a decantação. É a filtração (veja a figura a seguir), técnica que consiste em despejar a mistura sôbre uma superfície porosa, o filtro.
O filtro permite que a fase líquida o atravesse, mas retém a fase sólida, propiciando a separação de ambas. O princípio de funcionamento do filtro pode ser comparado, simplificadamente, ao das peneiras. O papel-filtro, bastante empregado em laboratórios, é elaborado com fibras de papel entrelaçadas de modo que os orifícios entre elas (invisíveis a ôlho nu) atuem como os orifícios de uma peneira. As partículas formadoras da água são tão pequenas que passam por esses orifícios. Já as partículas de areia, maiores que eles, são retidas pelo papel.
Esquema de decantação
Fonte: , J. (edição). Oxford dictionary of Chemistry. quinta edição Oxford: Oxford University Press, 2004. página 173.
a
Esquema de filtração

Fonte: réris, D. C. Quantitative Chemical analysis. nona edição Nova York: Freeman, 2016. página 36.
ATENÇÃO!
Por razão de segurança, para realizar qualquer experimento de Química você deve ter a AUTORIZAÇÃO e a SUPERVISÃO de seu professor, mesmo que pareça ser algo inofensivo.
Separação da mistura de óleo e água
Ao misturar óleo de cozinha e água, obtemos uma mistura heterogênea na qual a fase superior é o óleo, menos denso, e a inferior é a água, mais densa.
Para separar misturas heterogêneas líquido/líquido como essa, os químicos utilizam um aparelho de vidro, o funil de separação, que aparece ilustrado no esquema. A mistura é colocada dentro dele. A torneira é ligeiramente aberta, permitindo o escoamento gradual da fase inferior, que é recolhida em outro frasco. Fechando a torneira no exato momento em que a fase inferior acabou de escoar, consegue-se a separação das duas fases: a inferior é recolhida no frasco, e a superior permanece no funil de separação.
Esquema do funil de separação

Fonte: Bettelrim, F. A. êti áli. Introduction to General, Organic, and Biochemistry. décima segunda edição bóston: Cengage. 2020. página 171.
Separação da mistura de água e sal
Para separar uma mistura homogênea de sal e água (uma solução aquosa de sal), podemos simplesmente esperar pela evaporação completa da água, por exemplo, sob ação do calor solar. Assim que a evaporação acabar, restará o sal.
Esse processo tem larga utilização nas salinas, instalações nas quais a água do mar é colocada em tanques largos e rasos para que vá evaporando gradualmente.
Com a evaporação da água, obtém-se uma mistura de substâncias sólidas. Esta, a seguir, passa por outro processo de purificação, também denominado refino, durante o qual são eliminadas impurezas, principalmente duas delas (o cloreto de magnésio e o sulfato de magnésio), que, se não fossem eliminadas, dariam sabor amargo ao produto final, o sal de cozinha.
A evaporação é uma técnica barata, usada para se obter o componente sólido que está dissolvido no líquido. O componente líquido (a água, no caso) é perdido no processo.
Mas qual seria o procedimento para obter água pura a partir da água do mar?

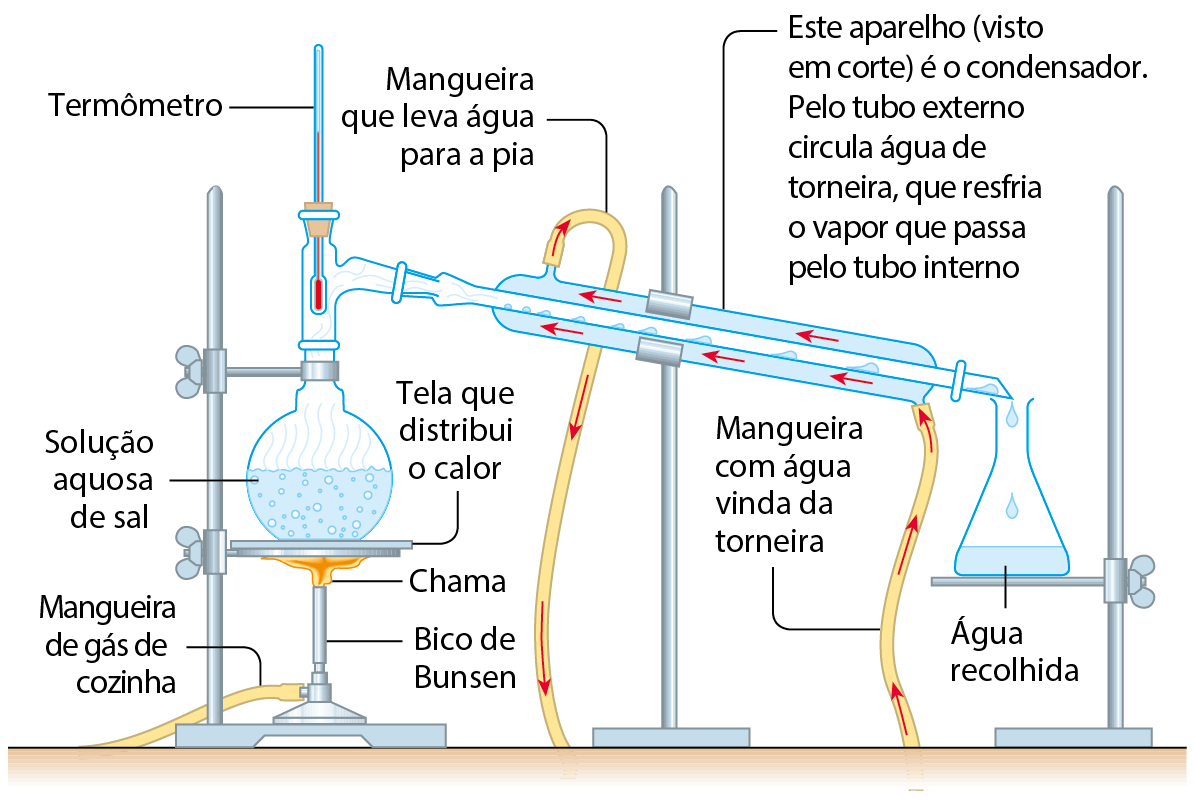
Para separar a mistura de água e sal e recuperar também a água, emprega-se a destilação, ilustrada a seguir. A mistura é aquecida e a água entra em ebulição, mas o sal não. O vapor de água é resfriado quando passa pelo interior do condensador e, com isso, condensa-se. A água líquida, isenta de sal, é recolhida no recipiente da direita e, ao final, restará sal sólido no frasco da esquerda.
Esquema da destilação
Fonte: bróun, T. êti áli. Chemistry: the central science. décima quinta edição Nova York: Pearson, 2022. página 58.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• decantação • filtração • funil de separação • destilação
Organização de ideias
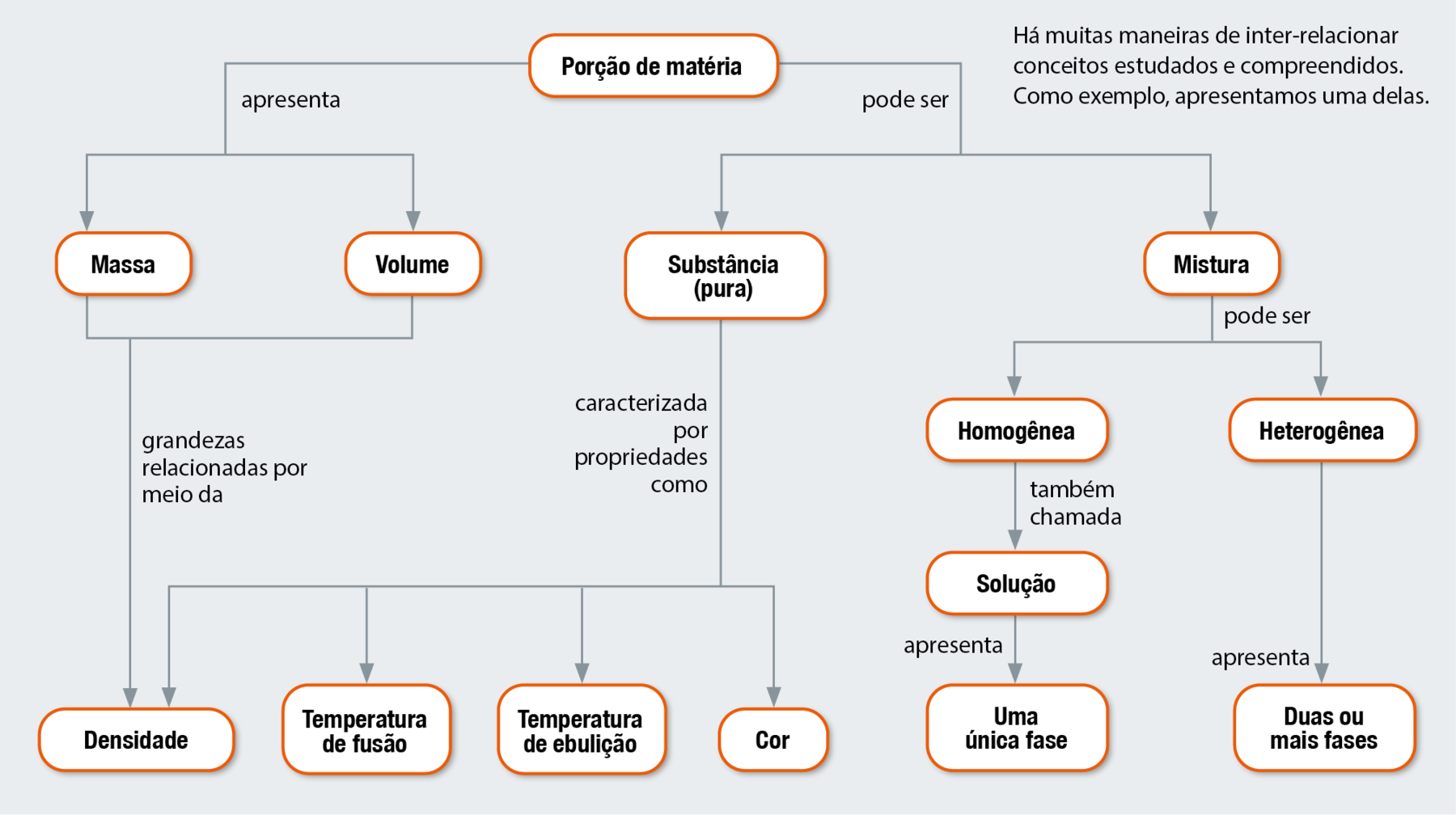
MAPA CONCEITUAL

Atividades
Use o que aprendeu
- Quando você sai de uma piscina e se expõe ao sol, sua pele fica seca depois de algum tempo. É correto dizer que a água:
- vaporizou?
- evaporou?
- entrou em ebulição?
- ferveu?
Justifique suas respostas.
- Às vezes, nos dias frios ou chuvosos, os vidros dos carros em que há alguém ficam embaçados do lado interno. Por que isso acontece?
- Em alguns automóveis há, no vidro traseiro, filamentos que servem de desembaçadores. Existe um botão no painel que, ao ser apertado, faz esses filamentos se aquecerem e, por causa disso, o vidro é desembaçado.
Proponha uma explicação para o fato de os filamentos aquecidos desembaçarem o vidro.
- Uma churrasqueira é feita de ferro. Sabendo que a temperatura de fusão do ferro é 1.538 graus Célsius, o que você pode afirmar sôbre a temperatura do carvão em brasa que está na churrasqueira durante o preparo do churrasco? Explique.
- A temperatura de fusão do ouro é 1.064 graus Célsius e a do rubi é 2.053 graus Célsius. Após um incêndio, foram encontrados os restos de um anel feito de ouro e rubi. O ouro estava todo deformado, pois derreteu durante o incêndio, mas o rubi mantinha seu formato original. O que se pode afirmar sôbre a temperatura das chamas durante o incêndio? Justifique sua resposta.
- Em uma lata de refrigerante temos a indicação “Contém 350 mililitros”. Esse volume equivale a quantos:
a) centímetro cúbico?
b) litros?
c) decímetro cúbico?
- Uma garrafa de água mineral traz a inscrição “Contém 1,5 litro”.
- Quantos centímetros cúbicos (cê ême3) de água há na garrafa?
- Quantos mililitros (ême éle) de água há na garrafa?
- Quantos decímetros cúbicos (dê ême3) de água há na garrafa?
- Quantos copos de capacidade 250 mililitros podem ser enchidos com 1,5 litro de água?
- Em três frascos iguais, que chamaremos A, B e C, foram colocadas massas iguais dos líquidos incolores benzeno (d = 0,88 grama por mililitro), água (d = 1,0 grama por mililitro) e clorofórmio (d = 1,49 grama por mililitro), um em cada frasco. Observe o desenho que mostra os três frascos, e conclua qual o líquido colocado em cada um. Justifique sua resposta.
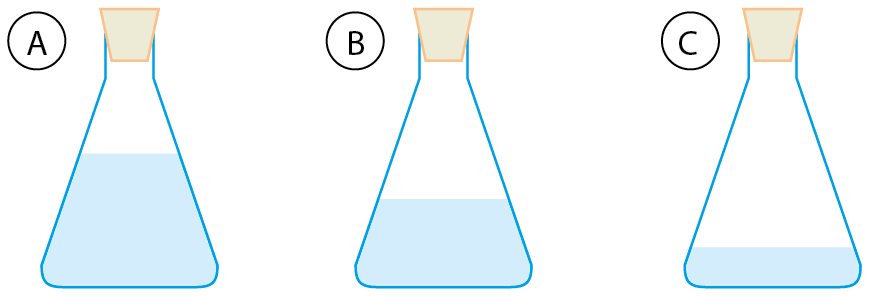
ATENÇÃO!
Benzeno e clorofórmio NÃO DEVEM SER MANIPULADOS pelos estudantes, pois são líquidos voláteis altamente tóxicos.
- Um ovo de galinha, inteiro e cru, foi colocado num recipiente com água e afundou. Após dissolver algumas colheradas de sal de cozinha na água, o ovo passou a flutuar no líquido.
- Por que o ovo inicialmente afunda?
- A densidade do ovo se altera durante o experimento?
- Explique por que o ovo passa a flutuar após algum tempo.
- Quando você coloca um pouco de groselha (a bebida, não a fruta) na água e mexe bem, obtém uma mistura homogênea ou uma mistura heterogênea? Justifique.
- Considere uma solução aquosa de açúcar.
- O que é uma solução?
- Nessa solução, qual é o solvente? E o soluto?
- O que significa dizer que uma solução é aquosa?
- O que significa dizer que a água tem a propriedade de dissolver o sal de cozinha?
- Vários pequenos pedaços de dois materiais sólidos estão misturados. Um dêsses materiais tem densidade 1,2 grama por mililitro e o outro, 2,7 gramas por mililitro. Explique como um líquido de densidade 1,6 grama por mililitro, que não dissolve nem danifica esses sólidos, pode ser útil para separá-los.
- Uma pessoa tem um copo com uma mistura de água e óleo de cozinha. Tem também uma lata vazia, um prego, um martelo e dois copos limpos. Como ela pode separar a mistura de água e óleo usando esses materiais?
- Como você faria para separar uma mistura de serragem e areia?
- Explique como você faria para separar uma mistura de sal de cozinha e areia.

Atividades
Explore diferentes linguagens
A critério do professor, estas atividades poderão ser feitas em grupos.
ESQUEMA
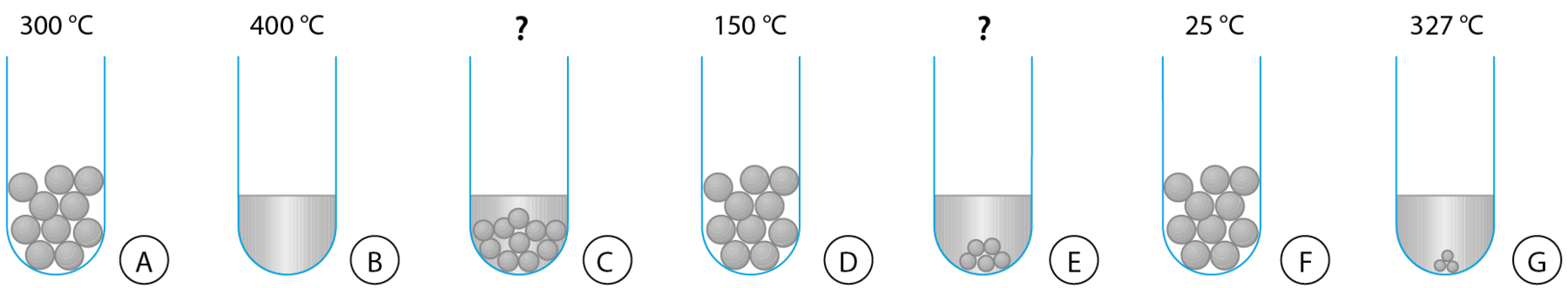
1. Num laboratório, pedacinhos do metal chumbo foram aquecidos até derreter completamente. Os desenhos mostram, de modo esquemático, o que há dentro do frasco em diferentes momentos do aquecimento.
Os desenhos não foram colocados na ordem correta e, em dois deles, falta a indicação da temperatura.
- Qual é a ordem correta dos desenhos?
- Qual é a temperatura em C? E em E? Justifique.
ANÚNCIO
2. Lojas de materiais para piscinas vendem um produto chamado “cloro líquido” e outro chamado “cloro sólido”.Consulte a tabela de temperaturas de fusão e de ebulição, fornecida neste capítulo, e comente se esses produtos podem ser a substância pura cloro. Justifique.

GRÁFICO
O gráfico mostra como varia, com o passar do tempo, a temperatura de uma amostra de água que recebe calor de uma chama de modo contínuo e regular. (O experimento é feito ao nível do mar.) Esse gráfico é denominado curva de aquecimento da água. O ponto A corresponde à situação inicial e o ponto F, à situação final. As atividades 3 a 12 se referem à interpretação do gráfico.
Curva de aquecimento da substância água em pressão atmosférica ao nível do mar
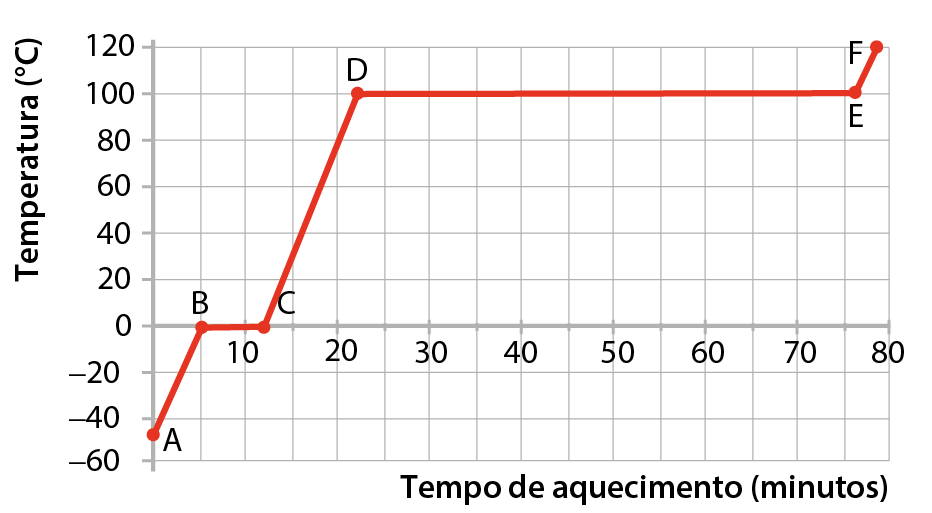
Fonte: Elaborado a partir de bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova York: Pearson, 2022. página 536.
- Qual é a temperatura da água em cada um dos pontos de A a F?
- Em que trechos (A-B, B-C etcétera) a água sofre aumento de temperatura?
- Em que trechos a temperatura da água permanece constante?
- Qual é o estado de agregação da água no trecho A-B e no trecho C-D?
- Que fenômeno ocorre no trecho B-C?
- Que fenômeno ocorre no trecho D-E?
- Qual é o estado de agregação da água no trecho E-F?
- Como se denomina a temperatura da água no trecho B-C?
- Como se denomina a temperatura da água no trecho D-E?
- Uma amostra de água absorve mais calor para sofrer fusão ou para sofrer ebulição? Explique como concluiu.
CHARGE

13. a) Procure no capítulo dados que lhe permitam responder à pergunta:
. . Em que faixa de temperatura existe nitrogênio líquido (na pressão correspondente à do nível do mar)?
- Com base na resposta anterior, decida se é possível que a mão de uma pessoa viva esteja na temperatura de nitrogênio líquido.
- Pesquise sôbre aplicações do nitrogênio líquido em diferentes setores da sociedade. Cite as propriedades do nitrogênio líquido que são aproveitadas nessas aplicações.

INTERPRETAÇÃO DE RESULTADOS
- Um estudante desejava medir o volume de um parafuso grande. Para isso, colocou água numa proveta e leu o volume. Em seguida, jogou o parafuso dentro da proveta e leu novamente o volume. Os desenhos ilustram o que ele observou.
- Qual é o volume do parafuso?
- Sabendo que a massa do parafuso é 157,4 gramas, determine a densidade do material de que ele é feito, em grama por mililitro.

FOTOGRAFIA
15. A mesma massa de um mesmo líquido (de cor alaranjada), numa mesma temperatura, foi colocada em cada um dos quatro frascos mostrados na foto.
Em qual dos frascos o volume de líquido é maior? Explique.

CHARGE
- A charge mostra um navio petroleiro afundando, com vazamento de petróleo no mar.
- Use o conceito de densidade para explicar por que o navio flutua se o seu casco estiver intacto, mas afunda caso ele sofra rompimento.
- A densidade do petróleo é menor que a da água do mar. Dessa informação, pode-se deduzir que existe um ERRO CIENTÍFICO na ilustração. Explique que erro é esse.

CENA DE FILME
- Uma cena de filme mostra um ladrão colocar dez barras de ouro, de volume 1 litro cada (equiparável ao de uma embalagem de leite longa vida), dentro de um saco de pano e, a seguir, sair correndo do local do crime. Considerando que a densidade do ouro é 19,3 gramas por mililitro e que 1 litro = 1.000 mililitros, responda:
- Qual é a massa do ouro roubado?
- Admitindo que o saco de pano aguente, seria possível o ladrão correr com o que roubou?

TIRINHA

- O humorista explora o duplo sentido da palavra solução. Explique os significados dessa palavra no linguajar diário e na terminologia química.
- Que característica a mistura líquida mencionada deve ter para que ela possa ser considerada uma solução no sentido químico do termo?
Seu aprendizado não termina aqui
Peça a pessoas que estejam habituadas com trabalhos na cozinha que mostrem a você os métodos que utilizam para separar “coisas que estejam misturadas”. A seguir, compare esses métodos com as técnicas de separação de misturas estudadas neste capítulo.