
CAPÍTULO 9 Transformações químicas

Motivação
A critério do professor, esta atividade poderá ser realizada em grupos.

Objetivo

Provocar uma reação química e observar alguma evidência de que ela ocorreu.
Você vai precisar de:
- dois copos grandes
- colhér de sopa
- vinagre
- bicarbonato de sódio
Procedimento
- Faça o experimento sôbre um local que possa ser limpo facilmente. Coloque uma colherada de bicarbonato de sódio em um dos copos. No outro, coloque vinagre até cêrca de 2 centímetros de altura.
- Observe atentamente cada um dêsses materiais e descreva no seu caderno o aspecto deles.
- Despeje o vinagre no copo que contém o bicarbonato de sódio. Observe o que acontece e anote.
- Volte a observar o copo após 15 minutos e verifique o aspecto do que se vê dentro do copo.
- Proponha uma explicação para aquilo que você observou.

Desenvolvimento do tema
1. Reação química
Combustão, um exemplo de reação química
O experimento descrito anteriormente permitiu a você realizar e observar um dos muitos exemplos de reação química. A combustão (queima) é um outro exemplo. Depois que o ser humano pré-histórico aprendeu a dominar o fogo, puderam-se descobrir outros fatos. Foi possível, por exemplo, separar os materiais em duas categorias: os que queimam e os que não queimam.
O fogo possibilitou perceber que alguns materiais se alteram quando aquecidos. Descobriu-se que certos alimentos, se assados, adquiriam gôsto mais agradável.
Objetos de argila molhada, quando secavam ao fogo, tornavam-se rígidos e impermeáveis, ao contrário do que ocorria quando secavam simplesmente ao sol; portanto, eram mais úteis. Estava descoberta a técnica para produzir objetos cerâmicos, ainda hoje empregada na produção de tijolos, telhas, vasos, potes, moringas, azulejos, louças sanitárias e objetos de porcelana.
Ao aquecer determinados minerais, povos antigos descobriram que era possível obter o metal cobre a partir do minério de cobre e, séculos depois, ferro a partir do minério de ferro.

Use a internet
Embora muitas pessoas achem que Química é sinônimo de “veneno” ou de “substância que faz mal à saúde”, é importante saber que ela é uma ciência relevante para a sociedade.
Muitas substâncias de importância para a humanidade são produzidas por reações químicas, nas chamadas indústrias químicas. Conheça atividade dêsse ramo da atuação dos químicos na página Química Viva, do Conselho Regional de Química da 4ª região, no enderêço:
https://oeds.link/18kTsJ. Acesso em: 12 abril 2022.
Caso esse enderêço tenha mudado, busque-o por Química Viva cê érre quê.
Sistema
Sistema é uma porção de matéria que foi escolhida para ser estudada, observada. Um sistema pode ser constituído por uma substância pura ou por uma mistura de substâncias.
O conceito de reação (transformação) química
Se uma ou mais substâncias presentes no estado inicial de um sistema transformam-se em uma ou mais substâncias diferentes, que estarão presentes no estado final, a transformação é uma reação química, ou transformação química.
Em outras palavras, reação química é um processo em que novas substâncias são formadas a partir de outras. Para saber se houve uma reação química, precisamos comparar as propriedades das substâncias presentes no sistema nos estados inicial e final.
Imagine que o sistema escolhido para estudo seja um pedaço de ferro e que ele seja observado antes e depois de ser serrado ao meio. A substância inicialmente presente, o ferro, possui exatamente as mesmas propriedades da substância presente no final, que também é o ferro. Serrar um pedaço de ferro não é, portanto, uma transformação química, já que nenhuma nova substância foi formada.
Quando um objeto cai, uma folha de papel é rasgada, uma porção de areia é misturada à água, um giz é esmagado até virar pó e um prego é fincado na madeira, estamos diante de exemplos de transformações que não são reações químicas.

Exemplo de reação química: combustão do etanol
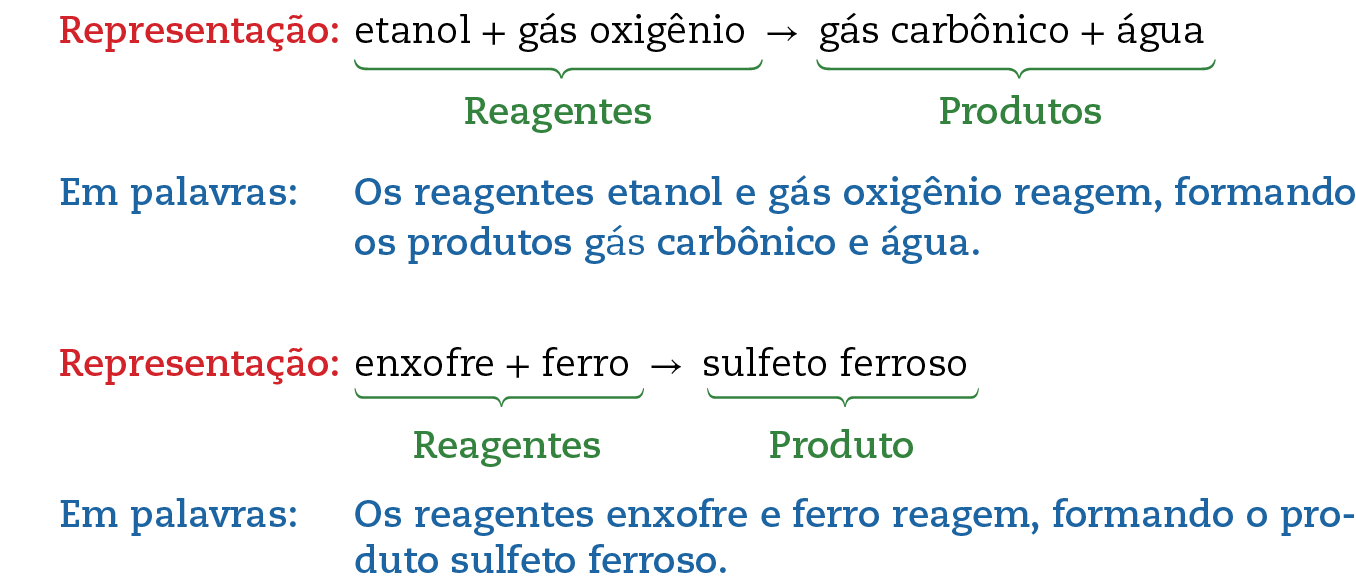
Para haver a combustão (queima) do etanol (álcool comum), é necessária a presença de gás oxigênio (por exemplo, do ar). Ambas as substâncias transformam-se, durante a combustão, em duas novas substâncias: água e gás carbônico (também chamado dióxido de carbono; é o gás que fórma as bolhas nos refrigerantes). É um exemplo de reação química.
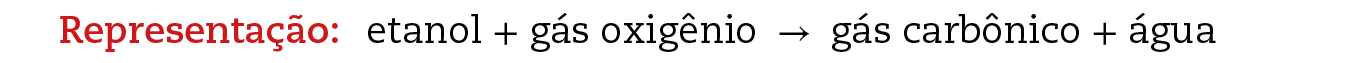
Nessa representação da combustão do etanol, os sinais de mais (+) podem ser lidos como “e”. A seta (→) pode ser lida como “reagem, formando”.

Os químicos identificam essas substâncias por meio de suas propriedades. Veja algumas dessas propriedades:
|
etanol |
+ |
gás oxigênio |
→ |
gás carbônico |
+ |
água |
|
|---|---|---|---|---|---|---|---|
|
Temperatura de ebulição |
78 °C |
‒ 183 °C |
‒ 78 °C* |
100 °C |
|||
|
Fase a 20 °C |
líquida |
gasosa |
gasosa |
líquida |
|||
|
Densidade a 20 °C |
0,79 g/mL |
0,0013 g/mL |
0,0018 g/mL |
1,0 g/mL |
|||
|
Cor |
incolor |
incolor |
incolor |
incolor |
* Na verdade, essa é a temperatura em que essa substância sublima, isto é, passa da fase sólida diretamente para a fase gasosa.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• sistema • reação química

ATIVIDADE
Reflita sôbre suas atitudes
O etanol pode se inflamar facilmente na presença de calor, chama ou faíscas. Na sua casa, as pessoas têm cuidado ao manusear e guardar etanol e outros produtos inflamáveis?
Exemplo de reação química: reação entre ferro e enxofre
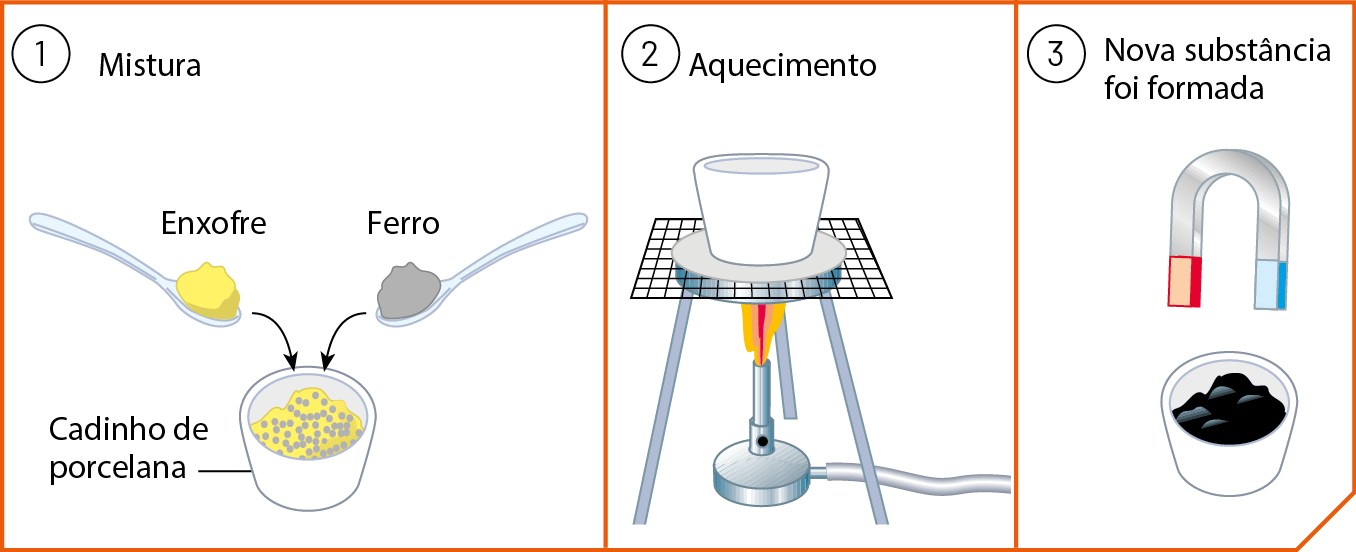
Enxofre e ferro (veja as fotografias no item 5 do capítulo 8), como qualquer substância pura, são caracterizados por suas propriedades. Cada qual tem sua temperatura de fusão, densidade, cor etcétera Uma propriedade interessante do ferro é que ele é atraído por um ímã. Já o enxofre não é.
Se pó de enxofre for adicionado a pó de ferro, obteremos uma mistura heterogênea, na qual cada um dos componentes mantém suas propriedades. Isso torna possível usar um ímã para separar o pó de ferro do pó de enxofre, como ilustra o desenho a seguir.

Mas, se essa mistura for aquecida num recipiente apropriado durante alguns minutos, ocorrerá uma reação química na qual enxofre e ferro se transformarão num sólido preto.
Determinando as propriedades do sólido preto formado, é possível identificá-lo como uma substância diferente das inicialmente presentes, o sulfeto ferroso. Ocorreu, portanto, uma reação química.
|
enxofre |
+ |
ferro |
→ |
sulfeto ferroso |
|
|---|---|---|---|---|---|
|
Temperatura de fusão |
95 °C |
1 538 °C |
1 188 °C |
||
|
Fase a 20 °C |
sólida |
sólida |
sólida |
||
|
Densidade a 20 °C |
2,07 g/mL |
7,87 g/mL |
4,74 g/mL |
||
|
Cor |
amarela |
cinza-metálica |
preta |
||
|
Atraído pelo ímã? |
não |
sim |
não |
ATENÇÃO!
Por razões de segurança, NÃO se sugere a realização dêsse experimento. O enxofre pode causar conjuntivite, dermatite e irritação do sistema respiratório.
Alguns exemplos cotidianos de reação química
Existem muitos exemplos de reações químicas no cotidiano. Entre eles estão: a formação da ferrugem num pedaço de palha de aço, o apodrecimento dos alimentos, a produção de húmus no solo, a queima de gás num fogão e de gasolina, etanol, gás natural ou óleo diesel no motor de um veículo.
A ocorrência de uma reação química nem sempre é fácil de perceber. Algumas só podem ser percebidas em laboratórios equipados para separar componentes das misturas obtidas e determinar suas propriedades. Há, contudo, algumas evidências que estão, de modo geral, associadas à ocorrência de reações químicas e que são, portanto, pistas que podem indicar sua ocorrência. Entre elas estão:
- liberação de calor — por exemplo, nas combustões;
- mudança de cor — por exemplo, quando um alvejante é derrubado, por descuido, numa roupa colorida;
- mudança de odor — por exemplo, quando frutas, carnes e outros alimentos apodrecem;
- liberação de gás — por exemplo, ao jogar um comprimido efervescente em água ou no caso do experimento descrito na abertura deste capítulo.





Reagentes e produtos
As substâncias inicialmente presentes num sistema e que se transformam em outras em consequência da ocorrência de uma reação química são denominadas reagentes. E as novas substâncias produzidas são chamadas produtos. Assim, por exemplo:

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• reagente
• produto
Motivação
A critério do professor, esta atividade poderá ser realizada em grupos.

Objetivo

Realizar uma reação química de decomposição.
Você vai precisar de:
- batata crua
- faca de ponta arredondada
- copo limpo
- pires
- água oxigenada a 10 volumes (pode ser adquirida em farmácia)
Procedimento
- Coloque água oxigenada no copo até 1 centímetro de altura. Observe o aspecto dela e descreva-o em seu caderno.
- córte duas ou três rodelas da batata crua (elas devem ser cortadas apenas no instante de fazer o experimento) e coloque-as sôbre o pires.
- Despeje um pouco da água oxigenada sôbre as rodelas e observe. Relate em seu caderno o que ocorreu e tente explicar por quê.
Desenvolvimento do tema
2. Substâncias: simples e compostas
Reações de decomposição
Existe uma grande variedade de reações químicas. Um tipo bastante importante são as reações de decomposição, nas quais uma única substância reagente origina como produtos duas ou mais substâncias.
A decomposição do peróxido de hidrogênio
A água oxigenada contém a substância incolor peróxido de hidrogênio. Sabe-se que, sob determinadas condições, esta última sofre a seguinte reação de decomposição:
peróxido de hidrogênio séta água + gás oxigênio
A decomposição do peróxido de hidrogênio é acelerada por uma substância presente nas células vivas. Por isso, ao colocar água oxigenada nas rodelas de batata, você deve ter observado a formação de bolhas: é o gás oxigênio.
A luz também acelera a decomposição do peróxido de hidrogênio. Por isso, a água oxigenada é comercializada geralmente em frascos escuros e recomenda-se guardá-los onde não recebam luz. Quando uma substância decompõe-se sob ação da luz, diz-se que ela sofre fotólise, palavra que vem do grego , luz, e , quebra, decomposição.


A decomposição do carbonato de cálcio
O calcário é uma rocha constituída principalmente pela substância carbonato de cálcio. Quando essa substância é aquecida a cêrca de 800 graus Célsius, transforma-se em óxido de cálcio e gás carbônico.
Essa reação é um exemplo de pirólise, ou seja, decomposição pelo calor (do grego piro, fogo).

A decomposição da água
A aparelhagem da figura a seguir é empregada para fazer passar corrente elétrica através da água. Algumas gotas de solução aquosa de sulfato de sódio são adicionadas à água. Sabe-se que essa substância não será consumida na reação química que vai acontecer, mas é necessária para fazer com que a solução se torne boa condutora de eletricidade.
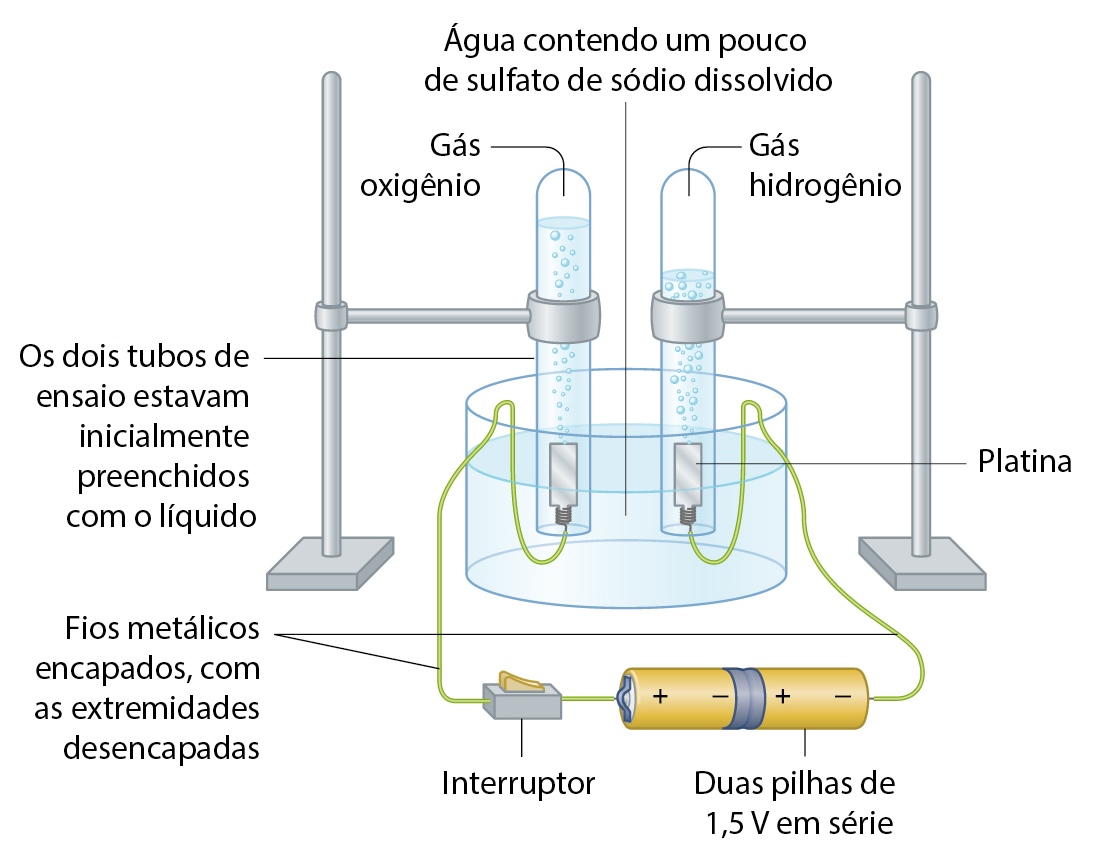
Fonte: bróun, T. êti áli. Chemistry: the central science. décima quinta edição Nova York: Pearson, 2022. página 53.
Assim que o interruptor é ligado, observa-se o desprendimento de bolhas gasosas incolores de ambos os pedacinhos de platina. Os gases produzidos acumulam-se dentro dos tubos de ensaio, que, inicialmente, estavam totalmente preenchidos com o líquido. Após algum tempo, o sistema está como mostrado na figura. A passagem de corrente elétrica através da água provoca sua decomposição em gás hidrogênio e gás oxigênio.
A decomposição provocada pela corrente elétrica é chamada eletrólise. Assim, temos:

Substâncias simples e substâncias compostas
O estudo das reações de decomposição foi relevante na história da Química. Esse estudo possibilitou a classificação das substâncias (puras) em dois grupos.
- Substâncias que não podem ser decompostas, ou seja, que não sofrem reação de decomposição. São denominadas substâncias simples e são exemplos o hidrogênio, o oxigênio e o nitrogênio.
- Substâncias que podem ser decompostas (por fotólise, pirólise, eletrólise etcétera), fornecendo assim novas substâncias de composição menos complexa. São as substâncias compostas, entre as quais estão a água, o carbonato de cálcio e o peróxido de hidrogênio.
ATENÇÃO!
A eventual realização do experimento só deve ocorrer com AUTORIZAÇÃO e SUPERVISÃO do professor.
Óculos de segurança, luvas e aventais protetores são obrigatórios.
O gás hidrogênio produzido no experimento é altamente explosivo. Por isso, não deve haver nenhuma chama ou dispositivo que produza faíscas elétricas nas proximidades.
3. Processos exotérmicos e processos endotérmicos
Quando água líquida é colocada em um congelador, ela perde calor para esse ambiente e, em decorrência disso, ocorre congelamento. Assim, quando a água líquida passa para a fase sólida ocorre um processo que libera calor.
Existem reações químicas que liberam calor. Considere um sistema contendo etanol (álcool comum) e oxigênio. Se, em um laboratório e seguindo rigorosamente as normas de segurança, a combustão do etanol for provocada — mediante uma chama ou faísca elétrica, por exemplo —, uma determinada quantidade de energia será liberada nessa reação, e essa energia será transferida dêsse sistema para as vizinhanças (arredores, ambiente).
Os processos (mudanças de fase e reações químicas) que liberam calor são denominados processos exotérmicos.


Há também fenômenos que absorvem calor. Se um pedaço de gelo for deixado sôbre a mesa à temperatura ambiente, receberá calor do ambiente e isso provocará a fusão do gelo.
Quando uma amostra de carbonato de cálcio se decompõe, a pressão constante, formando óxido de cálcio e gás carbônico, há absorção de energia (absorção de calor).
Os processos (mudanças de fase e reações químicas) que absorvem calor são denominados processos endotérmicos.


4. O petróleo
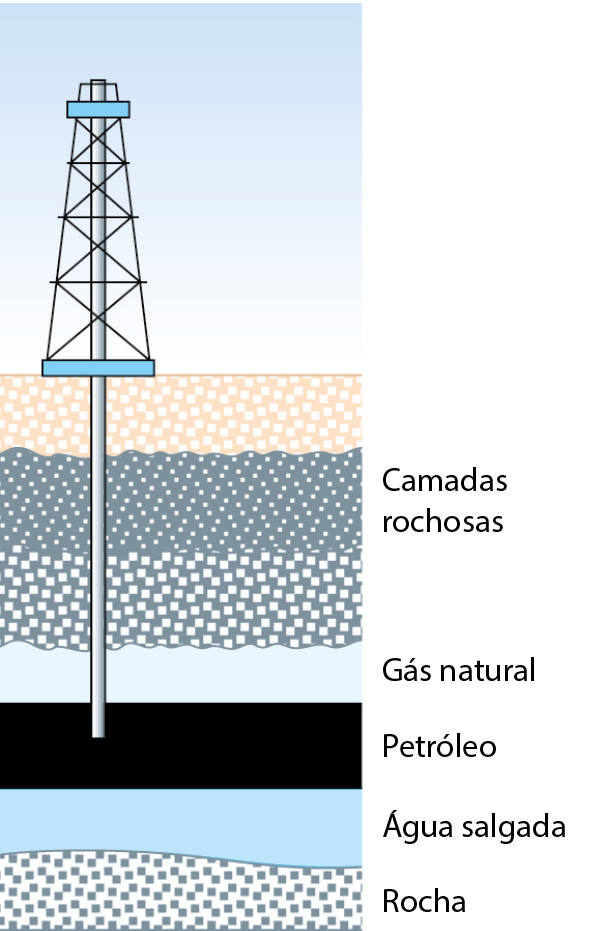
Segundo uma das teorias mais aceitas, a formação do petróleo começou há milhões de anos, quando restos de pequenos organismos se depositaram no fundo de mares, nas vizinhanças de terra firme. Esses restos foram sendo lentamente cobertos por sedimentos, como, por exemplo, pó de calcário e areia.
Ao longo dos milhões de anos que se seguiram, os restos dos organismos — submetidos a alta pressão, alta temperatura e ausência de oxigênio — sofreram complexas reações químicas. Estas reações formaram o petróleo, um líquido viscoso e geralmente de coloração escura que é uma mistura de várias substâncias.
Devido às circunstâncias em que foi formado, o petróleo é encontrado em camadas do subsolo, quer em terra firme, quer sob o mar. Geralmente vem acompanhado de água salgada (do antigo mar aí existente) e de uma mistura de gases altamente combustível, o gás natural.
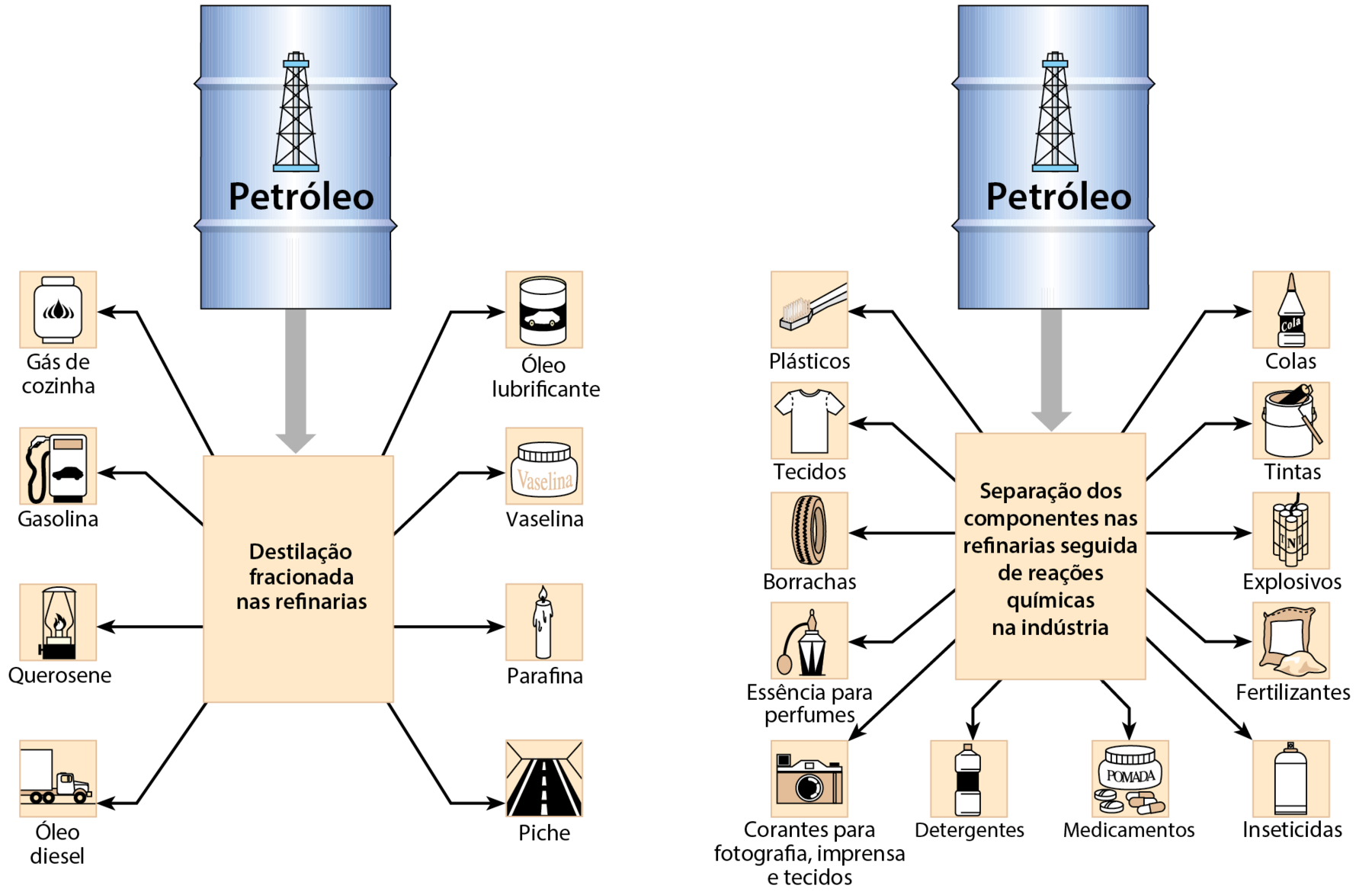
O petróleo é empregado na elaboração de produtos que podem ser divididos em dois grupos:
- derivados obtidos nas refinarias e
- derivados obtidos nas indústrias químicas.
Fonte: , C. S.; róbinsson, P. R. Petroleum science and technology. Cham: Springer, 2019. página 85.
Derivados obtidos nas refinarias
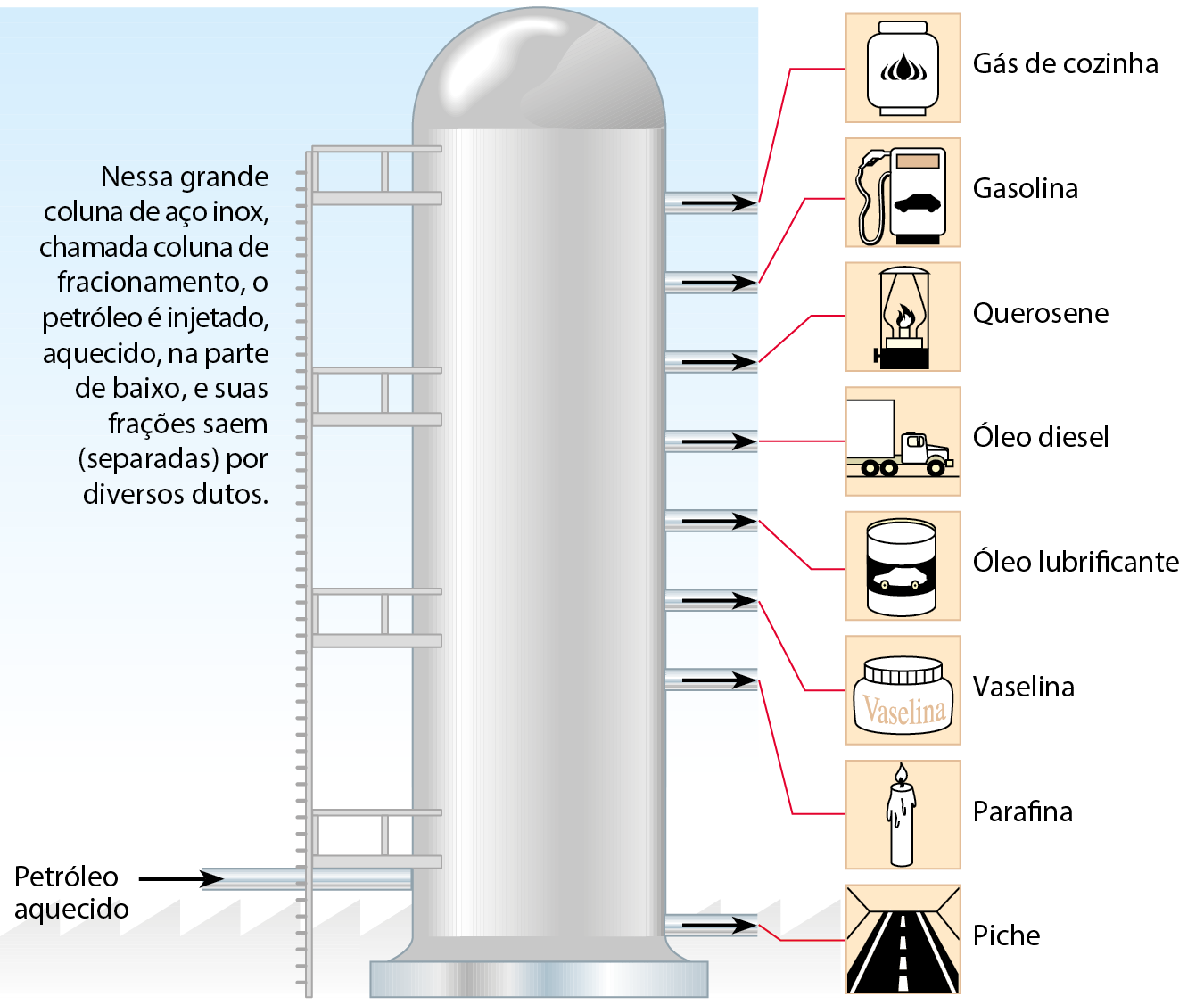
Não é possível distinguir visualmente os muitos componentes do petróleo. Em instalações industriais apropriadas, as refinarias de petróleo, é possível separar esses vários componentes em grupos, denominados frações do petróleo.
A separação — chamada refinação, refino ou fracionamento do petróleo — é feita em uma grande coluna de aço, a coluna de fracionamento ou de (destilação fracionada). O petróleo aquecido é injetado na parte inferior dessa coluna e os vapores dos componentes sobem por dentro dela, sendo gradualmente esfriados até se condensarem e saírem por dutos laterais, como mostra o esquema a seguir.
Fonte: Elaborado a partir de Bettelrim, F. A. êti áli. Introduction to General, Organic, and Biochemistry. décima segunda edição Boston: Cengage. 2020. página 325.
Algumas das importantes frações do petróleo são:
- gás – usado como combustível em fogões e aquecedores, vendido como gê éle pê, gás liquefeito de petróleo;
- gasolina – empregada como combustível em veículos;
- querosene – útil como combustível em lampiões;
- óleo diesel – combustível para caminhões, ônibus e tratores;
- óleo lubrificante – empregado, por exemplo, em motores;
- vaselina – material pastoso usado em cremes e pomadas;
- parafina – cera branca que pode ser usada para fazer velas;
- piche – material escuro e pegajoso usado, em mistura com pedra, para fazer o asfalto para pavimentação.


ATIVIDADE
Trabalho em equipe
Havendo possibilidade, e a critério do professor, pode-se fazer uma visita guiada a uma refinaria de petróleo.
O professor orientará previamente as equipes sôbre como proceder (antes, durante e depois). Para uma atividade segura e proveitosa, siga as recomendações!

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• petróleo
• fracionamento do petróleo
Derivados obtidos nas indústrias químicas
Nas indústrias químicas, os componentes do petróleo, que foram previamente separados nas refinarias, passam por reações químicas que produzem substâncias com aspecto e propriedades bem diferentes dos reagentes empregados.
É possível transformar os componentes do petróleo em plásticos, tintas, perfumes, colas, tecidos, medicamentos, borrachas, imitações de couro, espumas, explosivos, inseticidas, corantes, adoçantes artificiais, e uma infinidade de produtos comercializados.
EM DESTAQUE
O petróleo é um recurso natural não renovável
Quanto tempo os depósitos naturais de petróleo vão durar?
A resposta é incerta. Não se sabe quantos novos depósitos podem ser descobertos nos próximos anos ou até que ponto a tecnologia pode evoluir para permitir extrair mais petróleo de um poço. Outra dúvida é se a quantidade de petróleo gasta pela humanidade irá crescer, diminuir ou se manter nos próximos anos.
Uma coisa, porém, é certa: o petróleo é um recurso natural não renovável, ou seja, depois de gasto não pode ser automática e naturalmente reposto. Gastou, está gasto!
Por isso é cada vez maior a procura por outros combustíveis e por outras fontes de matérias-primas para a indústria que sejam capazes de substituir o petróleo.
Elaborado com dados obtidos de: MILLER JUNIOR, G. T.; Ispúlmãn, S. E. Living in the environment. décima nona edição Boston: Cengage, 2018.


EM DESTAQUE
O impacto ambiental causado pelos plásticos
Restos de comida, com o passar dos dias, mudam de aspecto e passam a exalar mau cheiro. Os responsáveis por isso são microrganismos que provocam sua decomposição. Os alimentos são biodegradáveis, ou seja, podem ser decompostos por microrganismos.
Os plásticos, ao contrário, em geral não são biodegradáveis.
Será preciso tanta durabilidade? Pense em um copinho descartável de café. Seu uso dura cêrca de um minuto. Depois disso ele é jogado fóra e vai permanecer muito tempo assim, ocupando espaço no lixo.
Uma grande crítica que se faz aos plásticos é que eles não são biodegradáveis. Por isso, há anos existe a preocupação de pesquisar plásticos biodegradáveis, e resultados promissores têm sido obtidos.
Se um anel de plástico jogado ao mar enroscar em um leão-marinho, uma foca, um peixe ou uma ave, eles terão dificuldade para retirá-los. Uma foca cujo focinho esteja preso por um rótulo plástico de refrigerante pode, por exemplo, morrer por falta de ar. Uma ave com o bico preso não pode comer e também morrerá. Tartarugas ingerem sacos plásticos jogados ao mar, pois os confundem com águas-vivas das quais se alimentam. Essa ingestão pode causar obstrução do intestino e morte.
Esses são alguns dos problemas relacionados aos plásticos e ao fato de as pessoas jogarem lixo em praias e outros ambientes.
Elaborado com dados obtidos de: , W. P.; , M. A. Principles of environmental science: inquiry and applications. nona edição Nova York: McGraw-Hill, 2020.

Saiba de onde vêm as palavras
A palavra “plástico” vem do grego , que significa “referente às dobras do barro”. Em latim essa palavra se tornou , significando “que pode ser moldado”. Assim, os materiais plásticos têm esse nome porque podem ser facilmente modeláveis no formato desejado, produzindo-se com eles os mais variados objetos.

EM DESTAQUE
Os principais plásticos
(Entre parênteses estão outras designações pelas quais esses plásticos são conhecidos na indústria.)








Elaborado com dados obtidos de: B. D. êti áli. Chemistry in context: applying Chemistry to society. nona edição Nova York: McGraw-Hill/American Chemical Society, 2018.

5. Carvão mineral
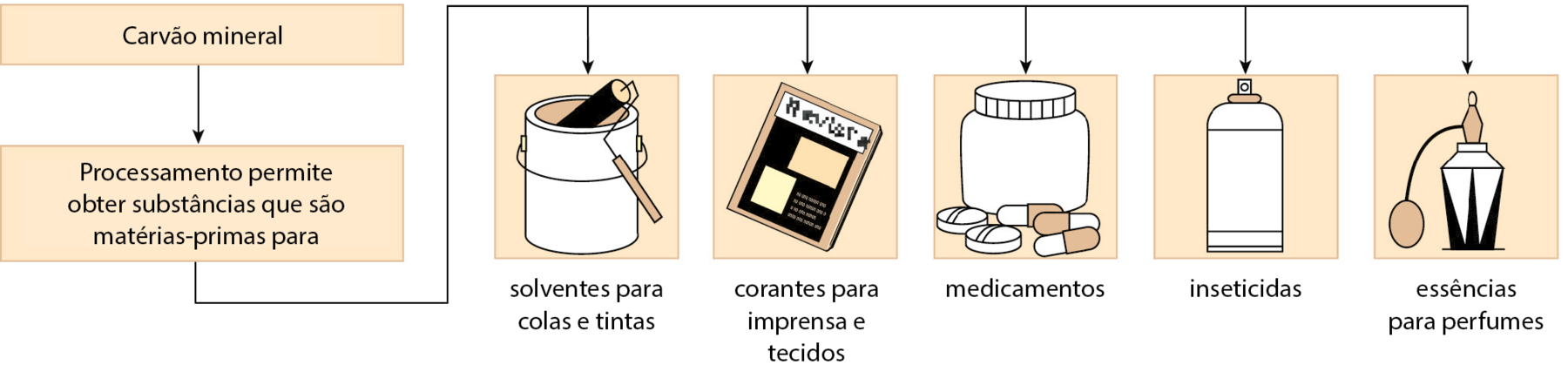
O carvão mineral ou carvão de pedra é um sólido escuro, encontrado em várias regiões do mundo, que se formou como resultado de complexas transformações químicas sofridas por organismos vegetais “soterrados” há milhões de anos.
O carvão mineral é um material que possui alto teor de uma substância combustível chamada carbono.

Assim como no caso do petróleo, o carvão mineral não é importante apenas como combustível. Ele representa também uma importante fonte de matérias-primas para as indústrias químicas. Alguns exemplos de produtos obtidos a partir das matérias-primas do carvão mineral aparecem no esquema a seguir.

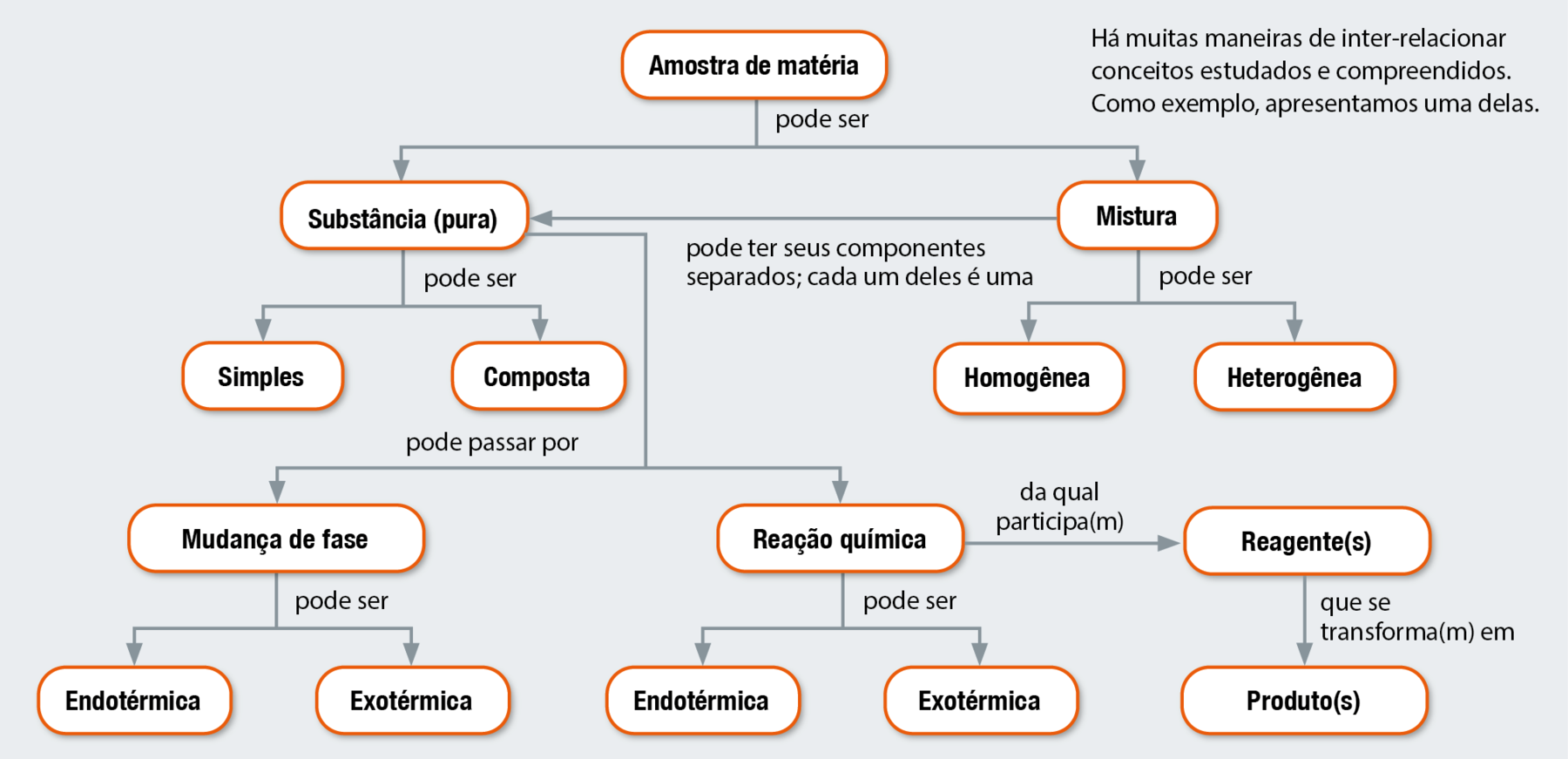
Organização de ideias
MAPA CONCEITUAL

Atividades
Use o que aprendeu
- Ao sair de uma piscina em um dia de vento, sentimos frio. Proponha uma explicação para isso, com base nos conceitos de mudança de fase e de absorção ou liberação de calor.
- Se cinco gotas de água forem esfregadas nas costas da mão e, a seguir, o local for assoprado, isso produzirá sensação de resfriamento. Como esse acontecimento se relaciona ao mencionado na questão anterior?
- As talhas e moringas de argila contendo água estão sempre a uma temperatura um pouco inferior à do ambiente. Sabendo que a água é capaz de impregnar esse material e chegar (em pequena quantidade) até o lado externo, proponha uma explicação para elas se manterem abaixo da temperatura do ambiente.

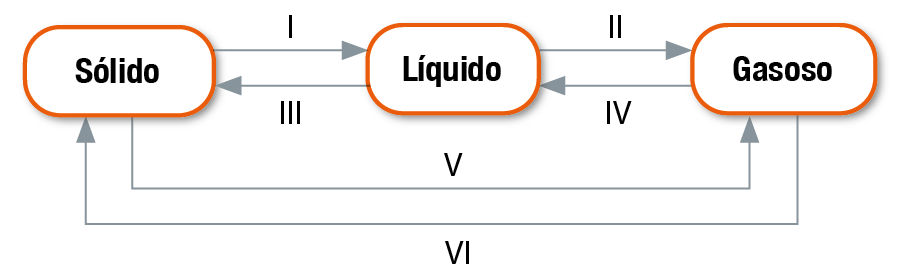
4. Das mudanças de fase um a seis esquematizadas a seguir, todas à pressão constante, quais são endotérmicas? E quais são exotérmicas?
- Explique a diferença entre extração do petróleo do poço e fracionamento do petróleo.
- O petróleo é uma substância pura ou uma mistura? Explique.
- Utilizando a informação um, explique o que você entende da afirmação dois.
- As jazidas mais novas de petróleo apresentam 10 milhões de anos e as mais antigas, 400 milhões.
- O petróleo é uma fonte não renovável de energia (recurso energético não renovável).
- As refinarias de petróleo separam-no em diversas frações. Qual é o processo usado com essa finalidade? Em que se fundamenta?
- As frações do petróleo têm aplicações de interêsse da sociedade. Relacione exemplos dessas frações e indique suas utilidades práticas.
- O enxofre é uma impureza do petróleo responsável por um problema ambiental chamado chuva ácida. Nas refinarias, durante a destilação fracionada, esse elemento tende a se acumular nas frações cujos componentes têm maiores temperaturas de ebulição. Deduza em qual fração haverá mais enxofre:
- no querosene ou na gasolina.
- no óleo diesel ou no gás de cozinha.
- Quando trocam o botijão de gás, algumas pessoas colocam espuma de sabão na “boca” do botijão, como mostra a ilustração. Esse recurso é utilizado para verificar se há vazamento.
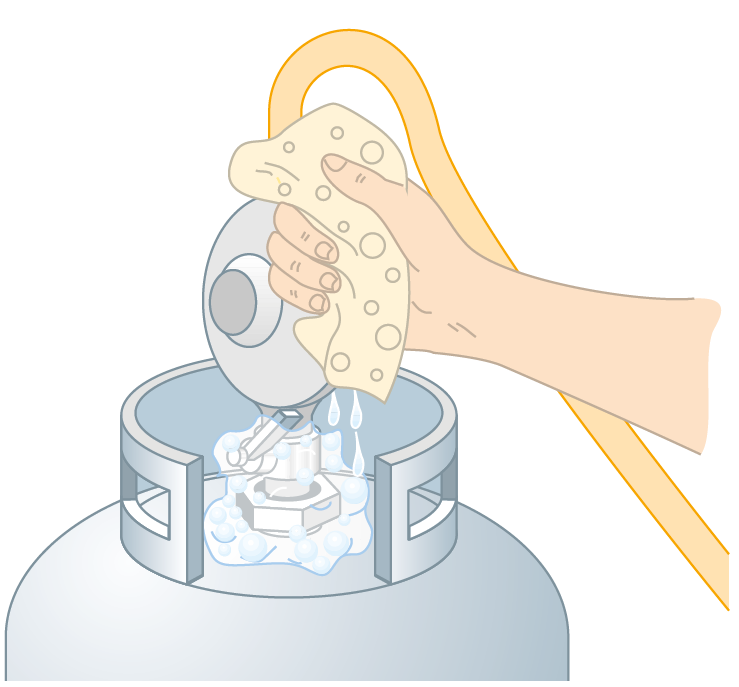
- Como a espuma vai indicar se existe vazamento de gás?
- Que riscos oferece um vazamento de gás?

Atividades
Explore diferentes linguagens
A critério do professor, estas atividades poderão ser feitas em grupos.
TRECHO DE DOCUMENTÁRIO
1. Trecho de um documentário: “Quando uma folha de papel queima, diz-se que está havendo uma reação química. Já quando uma folha de papel é rasgada, não está havendo reação química”.
Explique a razão para a diferente classificação de ambos os processos.
TIRINHA

2. A ferrugem surge em decorrência de um processo chamado de oxidação do metal ferro (daí a situação de humor na tirinha), que ocorre por meio de uma reação química assim representada:
ferro + gás oxigênio + água líquida séta ferrugem
- Como são genericamente chamadas as substâncias representadas à esquerda da seta?
- Como é genericamente denominada a substância representada à direita da seta?
- A palha de aço, usada na lavagem de louças e panelas, é constituída essencialmente de ferro. Por que a palha de aço não enferruja dentro da embalagem fechada?
- Por que a palha de aço enferruja se for molhada e deixada sôbre a pia, de um dia para o outro?
INFORMAÇÕES TÉCNICAS
- A substância cloreto de amônio é empregada desde a Antiguidade como adubo para vegetais. Os egípcios, por exemplo, obtinham-na a partir do esterco de camelo. Muitos dos fertilizantes atualmente produzidos em indústrias químicas contêm essa substância em sua composição. Um químico informou que:
- O cloreto de amônio sofre decomposição produzindo os gases amônia e cloreto de hidrogênio.
- Por decomposição, a amônia origina os gases nitrogênio e hidrogênio, e o cloreto de hidrogênio origina os gases cloro e hidrogênio.
- Os gases nitrogênio, hidrogênio e cloro não sofrem decomposição.
- Quantas substâncias químicas diferentes são mencionadas nas três afirmações anteriores?
- Quais delas são substâncias simples e quais são compostas? Explique o critério que você usou para responder.
CHARGE
As atividades 6 a 8 se referem à charge:

6. Pesquise na internet ou em outra fonte de informação:
Em um posto de combustível, como é denominado o tipo de gasolina que não é “comum”?
- A charge explora o humor na oposição entre as palavras “comum” e “incomum”. Que característica do automóvel teria levado o frentista do posto a abastecer com gasolina “incomum”?
- Diferentes estudantes (a, b, c e d) disseram que a gasolina é obtida industrialmente a partir:
- do álcool da cana-de-açúcar.
- da água do mar.
- do carvão mineral.
- do fracionamento do petróleo.
Qual dos estudantes mencionou corretamente de onde vem o combustível? Explique.
TEXTO DA INTERNET
As atividades 9 a 11 se referem ao texto:
“
Neste cenário o Brasil tem posição privilegiada como produtor de polímeros naturais ou biodegradáveis. Os fabricantes destes materiais atestam que, uma vez em contato com a terra, os biopolímeros servem de alimento para bactérias e fungos, degradando-se em 180 dias. Isso representa um valor significativamente menor quando comparado a degradação de 200 anos do plástico petroquímico.
”
Fonte: INSTITUTO INOVAÇÃO. Da pedra lascada aos nanomateriais. [: 2007]. Disponível em: https://oeds.link/ZZfLnT. Acesso em: 12 abril 2022.
9. Um dicionário contém as definições:
Petroquímica. Ciência, técnica ou indústria dos produtos químicos derivados do petróleo.
Petroquímico. Referente à petroquímica.
Com base nessas informações, explique o que é um “plástico petroquímico”.
- Diz-se que os restos de comida são biodegradáveis e que os plásticos petroquímicos não são biodegradáveis. Explique a razão dessa classificação.
- Por que o petróleo é considerado um recurso natural não renovável?
Seu aprendizado não termina aqui
Muitos avanços têm sido conquistados pelo Brasil na área da prospecção e da exploração de petróleo. Com frequência são anunciados a descoberta de reservas e também o aumento da produção conquistado com as tecnologias desenvolvidas ou adaptadas por engenheiros e outros profissionais brasileiros. Esteja atento às notícias relacionadas a esse assunto.

Fechamento da unidade
Isso vai para o nosso blog!


A importância da Química para a sociedade
A critério do professor, a classe será dividida em grupos e cada um deles criará e manterá um blog na internet sôbre a importância do que se aprende em Ciências da Natureza. Nesta atividade, a meta é selecionar informações (acessar, reunir, ler, analisar, debater e escolher as mais relevantes e confiáveis) relacionadas aos tópicos a seguir para incluir no blog.
