
CAPÍTULO 8 Substâncias químicas

Respostas e comentários
De ôlho na Bê êne cê cê!
Os temas tratados neste capítulo, de modo geral, favorecem o desenvolvimento: da competência geral 1, porque permitem valorizar e utilizar os conhecimentos historicamente construídos sôbre o mundo físico para entender e explicar a realidade; da competência geral 2, por exercitarem a curiosidade intelectual e incentivarem a utilização da abordagem própria das ciências; da competência específica 1, na medida em que favorecem compreender as Ciências da Natureza como empreendimento humano, e o conhecimento científico como parte integrante de nossa cultura; e da competência específica 2, posto que estimulam compreender conceitos fundamentais e estruturas explicativas das Ciências da Natureza, bem como dominar processos, práticas e procedimentos da investigação científica, de modo a sentir segurança no debate de questões científicas, tecnológicas, socioambientais e do mundo do trabalho.
Este capítulo e seus conteúdos conceituais
- Temperatura de fusão e temperatura de ebulição
- Densidade
- Relação entre densidade e flutuação
- Misturas homogêneas e misturas heterogêneas
- Conceito de solução
- Separação de misturas
Este capítulo aborda algumas propriedades macroscópicas das substâncias: temperatura de fusão, temperatura de ebulição e densidade.
A incursão pelo mundo submicroscópico (átomos e moléculas) é deixada para outro volume.
O capítulo seguinte aproveitará essas propriedades macroscópicas para o estudo das reações químicas, também conceituadas macroscopicamente.
Em capítulos como este, não é producente trabalhar todos os conceitos sem que os estudantes tenham a chance de realizar atividades. O ideal é trabalhar o capítulo em pequenas partes, ao final das quais se realizam atividades, conforme sugerido nos comentários que aparecem neste Manual do professor.
Antes de começar o capítulo, estimule os estudantes a responder à pergunta feita na legenda da foto de abertura. Aproveite as respostas para sondar conceitos prévios e aproveite-os no desenvolvimento do capítulo, evocando-os quando necessário.
Os saberes pregressos, sejam cientificamente corretos ou não, servem como âncoras para o desenvolvimento de novos conhecimentos. Estes, à medida que são construídos, podem provocar a reelaboração dos próprios saberes que lhes serviram de âncora, modificando-os. Assim, é possível que os estudantes incorporem um modo de pensar científico sôbre coisas que, anteriormente, eram pensadas dentro do senso comum.
Motivação
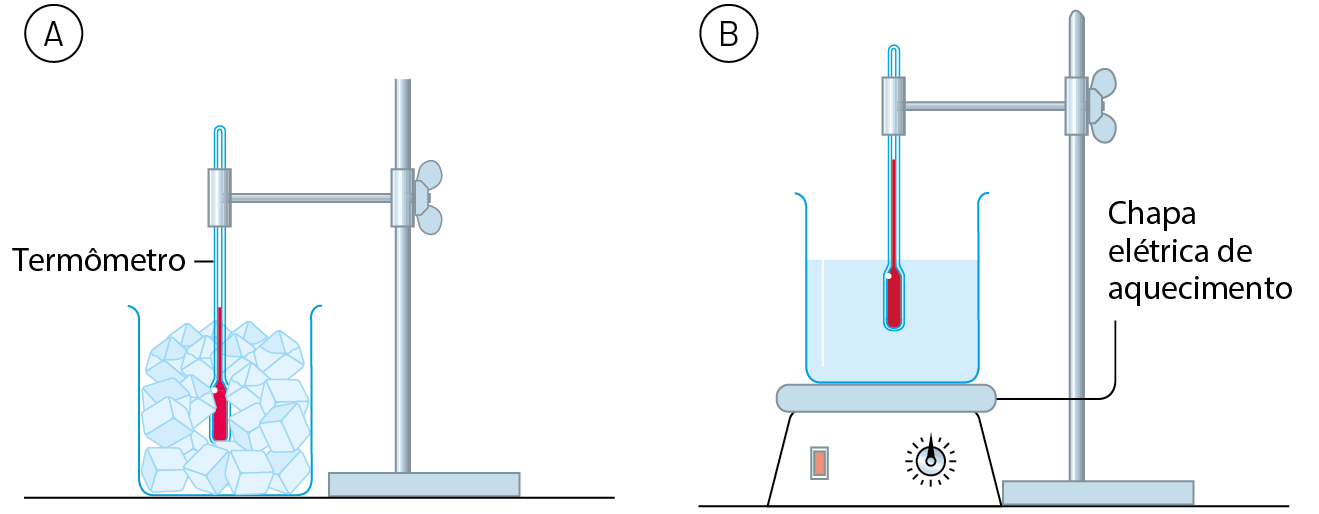
Observe a figura A. Os cubos de gelo acabaram de ser retirados do freezer e estão a ‒18 graus Célsius (isto é, 18 graus Celsius abaixo de zero). A sala está localizada ao nível do mar e sua temperatura é de 25 graus Célsius.
Acompanhando a temperatura do conteúdo do frasco, com o passar do tempo verifica-se que ela sobe gradualmente até chegar a 0 grau Célsius. Nessa temperatura, o gelo começa a derreter e, enquanto não derrete completamente, a temperatura não se altera, permanecendo no valor constante de 0 grau Célsius.
Assim que todo o gelo derrete, a temperatura volta a subir gradualmente até chegar a 25 graus Célsius, a mesma da sala. A partir daí, ela se mantém constante.
Em seguida, essa água líquida a 25 graus Célsius é aquecida com o auxílio da aparelhagem mostrada na figura B. Notamos que a temperatura sobe gradualmente até 100 graus Célsius, quando a água entra em ebulição. Enquanto a água permanece em ebulição, a temperatura mantém-se em 100 graus Célsius.
ATENÇÃO!
Por razão de segurança, para realizar qualquer experimento de Química você deve ter a AUTORIZAÇÃO e a SUPERVISÃO de seu professor.
Desenvolvimento do tema
1. Mudanças de fase
Inicialmente, a água estava no estado de agregação sólido, ou na fase sólida. Posteriormente, passou para o estado de agregação líquido, ou fase líquida, e, finalmente, para o estado de agregação gasoso, ou fase gasosa. As mudanças de estado de agregação, ou mudanças de fase, recebem nomes conforme mostra o esquema:
Esquema de mudanças de fase da água
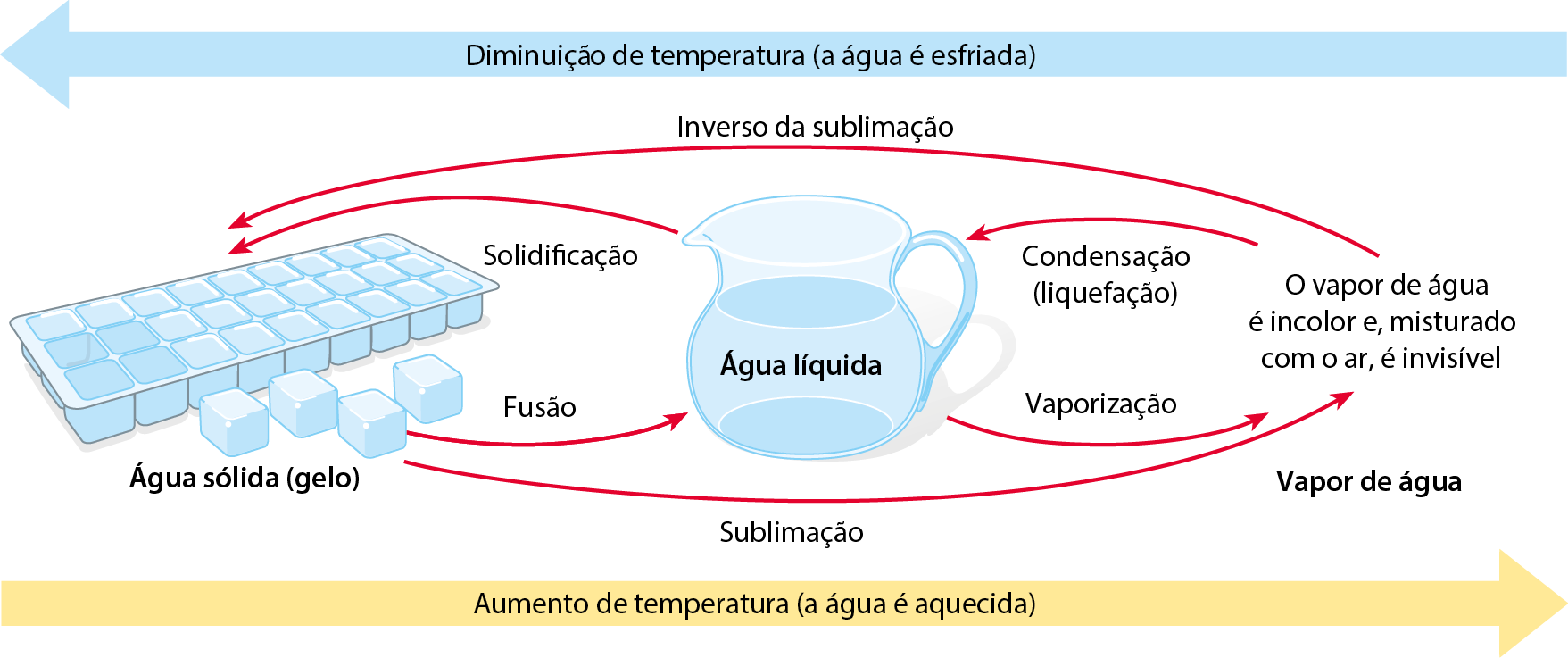
A vaporização, passagem da fase líquida para a fase gasosa, pode ocorrer de fórma lenta, na temperatura ambiente e sem a formação de bolhas, como no caso de uma roupa secando no varal. Nesse caso, a vaporização é denominada evaporação.
Respostas e comentários
Conteúdo procedimental sugerido
• Experimentar técnicas de separação de misturas homogêneas e de misturas heterogêneas.
Trabalhar esse conteúdo é o que se pretende com os Projetos 4 e 5, indicados mais à frente, neste capítulo do Manual do professor.
Esses projetos são comentados neste Manual do professor, junto das respectivas ocorrências no final do livro do estudante.
Item 1
Ao trabalhar esse item, que é uma retomada de temas já estudados nos anos iniciais do Ensino Fundamental, atente a um problema de compreensão referente ao vapor de água. É frequente ouvirmos pessoas (até alguns professores!) dizerem que a névoa esbranquiçada que sai do bico de uma chaleira é vapor de água.
Isso cria uma situação problemática quando o estudante encontra no capítulo a informação de que o vapor de água é incolor e, misturado com o ar, não é visível.
Saliente que o que acontece, no caso da água fervendo numa chaleira, é que o vapor de água, tão logo sai pelo bico, encontra a atmosfera e se resfria.
Ao se resfriar, o vapor (ao menos uma parte dele) sofre condensação, formando muitas gotículas de água líquida, que compõem a névoa observada.
Assim, a névoa que sai do bico da chaleira tem essencialmente a mesma composição da neblina: gotículas de água em fase líquida em meio a vapor de água.
Atividades
Ao final do item 1, são recomendados os exercícios 1 a 3 do Use o que aprendeu.
A vaporização também pode acontecer com a formação de bolhas durante o aquecimento do líquido. Nesse caso, é chamada ebulição (popularmente, fervura). A água, ao nível do mar, sofre ebulição na temperatura de 100 graus Célsius.
2. Temperatura de fusão (tê éfe) e temperatura de ebulição (tê e)
Como evidenciam os fatos mostrados anteriormente, ao nível do mar, a fusão da água sólida ocorre à temperatura fixa de 0 grau Célsius. Essa temperatura é a temperatura de fusão da água. A ebulição da água também ocorre a uma temperatura constante, que é de 100 graus Célsius ao nível do mar. Essa temperatura é a temperatura de ebulição da água.
A temperatura de fusão (tê éfe) é uma temperatura característica na qual determinada substância sofre fusão (durante o aquecimento) ou solidificação (durante o resfriamento).
A temperatura de ebulição (tê e) é uma temperatura característica na qual determinada substância sofre ebulição (durante o aquecimento) ou liquefação (durante o resfriamento).
No aquecimento ou no resfriamento de determinada substância, a temperatura permanece constante (na temperatura de fusão ou de ebulição) enquanto a mudança de fase estiver se processando.
A temperatura de ebulição das substâncias pode variar bastante, dependendo da pressão atmosférica do local em que o experimento é feito (já a temperatura de fusão varia menos intensamente). A pressão atmosférica, por sua vez, varia sensivelmente com a altitude do local. Vamos considerar subentendido, de agora em diante, que todos os dados relativos à ebulição e à fusão referem-se ao nível do mar (veja exemplos na tabela).
Aplicação dos conceitos de tê éfe e tê e
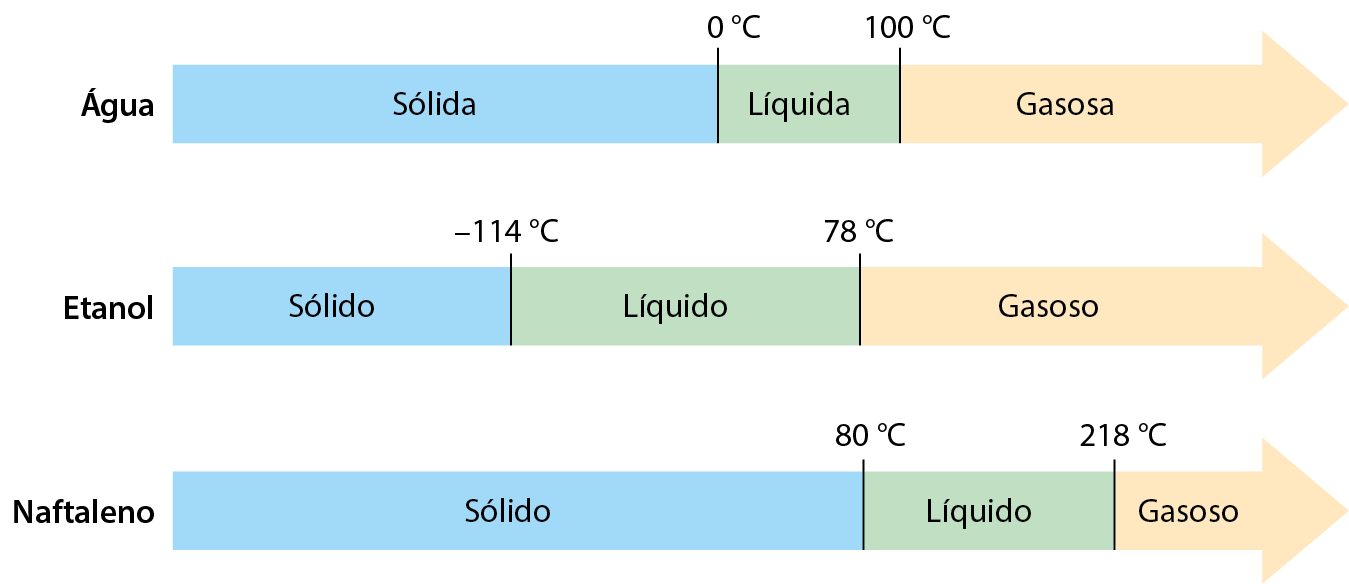
Uma utilidade de saber a temperatura de fusão e a de ebulição de determinada substância é poder prever as faixas de temperatura em que a substância é sólida, líquida ou gasosa. Exemplifiquemos no esquema a seguir com a água, o etanol e o naftaleno (consulte tê éfe e tê e dessas substâncias na tabela).
|
Substância |
TF |
TE |
|---|---|---|
|
Tungstênio |
3 414 |
5 555 |
|
Platina |
1 768 |
3 825 |
|
Ferro |
1 538 |
2 861 |
|
Cobre |
1 085 |
2 560 |
|
Ouro |
1 064 |
2 836 |
|
Prata |
962 |
2 162 |
|
Cloreto de sódio |
801 |
1 465 |
|
Alumínio |
660 |
2 519 |
|
Chumbo |
327 |
1 749 |
|
Iodo |
114 |
184 |
|
Enxofre |
95 |
445 |
|
Naftaleno |
80 |
218 |
|
Benzeno |
6 |
80 |
|
Água |
0 |
100 |
|
Bromo |
‒ 7 |
59 |
|
Mercúrio |
‒ 39 |
357 |
|
Amônia |
‒ 78 |
‒ 33 |
|
Metanol |
‒ 98 |
65 |
|
Cloro |
‒ 102 |
‒ 34 |
|
Etanol |
‒ 114 |
78 |
|
Metano |
‒ 182 |
‒ 162 |
|
Flúor |
‒ 220 |
‒ 188 |
|
Nitrogênio |
‒ 210 |
‒ 196 |
|
Oxigênio |
‒ 219 |
‒ 183 |
|
Hidrogênio |
‒ 259 |
‒ 253 |
Fonte: Reines, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 3-4ésse ésse e 4-44ésse ésse.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• temperatura de fusão • temperatura de ebulição
Respostas e comentários
Aprofundamento ao professor
Veja, na parte inicial deste Manual do professor, na seção Aprofundamento ao professor, os textos “Diagrama de fases da água” e “Curva de orvalho e curva de geada”.
Noções de pensamento computacional
Ao trabalhar o item 2, você tem uma oportunidade para instigar os estudantes a realizar uma identificação de padrão. Para isso, realize, inicialmente, previsões similares às que são feitas no subitem Aplicação dos conceitos de tê éfe e tê e, utilizando outras substâncias da tabela. Incentive a participação dos estudantes na elaboração dessas previsões, por meio da consulta de valores de tê éfe e de tê e na tabela e da elaboração de esquematizações (setas ou retas ordenadas) como as exemplificadas para água, etanol e naftaleno.
Usando essas representações, mostre que é possível, para qualquer temperatura escolhida, saber em que fase (sólida, líquida, gasosa) se encontra a substância. Exemplifique com a temperatura ambiente da sala, com a temperatura interna de uma geladeira (5 graus Célsius) e a temperatura de um dia no deserto do Saara (que pode chegar a 50 graus Célsius).
Pergunte, então, aos estudantes: se conhecermos os valores de tê éfe e tê e para uma substância e a temperatura T na qual ela se encontra, qual é a condição para a substância estar em: (1) fase sólida? (2) fase líquida? (3) fase vapor?
Deixe-os pensar e opinar e, a partir das contribuições dos estudantes, ajude-os a identificar o padrão:
- a substância estará sólida se o valor de T for inferior a TF (tê < tê éfe);
- a substância estará líquida se o valor de T estiver entre tê éfe e tê e (tê éfe < tê < tê e); e
- a substância estará em fase gasosa se T for superior a tê e (tê e < tê).
Atividades
Julgando conveniente, os exercícios 4 e 5 do Use o que aprendeu podem ser trabalhados ao final do item 2, assim como as atividades 1 a 13 do Explore diferentes linguagens.
3. Matéria
A mesa, a cadeira, as nossas roupas e o nosso organismo são exemplos de matéria. Todas as “coisas” que fazem parte do nosso mundo são feitas de matéria. Do ponto de vista científico, matéria é tudo o que tem massa e ocupa lugar no espaço.

Massa
A unidade padrão para expressar massa é o quilograma (cá gê) e um importante submúltiplo dessa unidade é o grama (gê). Um quilograma equivale a mil gramas (1 cá gê = .1000 gê).
Volume
Ocupar lugar no espaço é uma característica associada à grandeza denominada volume. Em outras palavras, o volume de uma porção de matéria expressa quanto espaço é ocupado por ela. Exemplos de unidades de volume são o decímetro cúbico (dê ême), o litro (éle), o centímetro cúbico (cê ême), o mililitro (ême éle) e o metro cúbico (ême).
O decímetro cúbico e o litro
O decímetro cúbico (dê ême) é o volume de um cubo cuja aresta mede 1 dê ême (um decímetro), ou seja, 10 centímetros. É equivalente ao litro (éle).
O centímetro cúbico e o mililitro
O centímetro cúbico (cê ême) é o volume de um cubo cuja aresta mede 1 centímetro. A figura A ilustra que um decímetro cúbico corresponde a mil centímetros cúbicos (1 dê ême = .1000 cê ême).
O mililitro (ême éle) é a milésima parte do litro, assim, um litro corresponde a mil mililitros (1 éle = .1000 ême éle). Como um decímetro cúbico equivale a um litro, então:
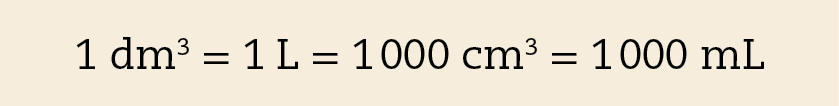
Assim, decorre que:
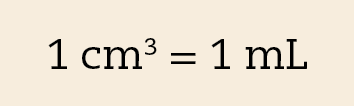
O metro cúbico
O metro cúbico (ême) é o volume de um cubo de aresta igual a 1 métro. Trata-se, portanto, de uma unidade de volume que expressa uma grandeza maior que as unidades anteriores. A figura B ilustra que um metro cúbico corresponde a mil decímetros cúbicos.
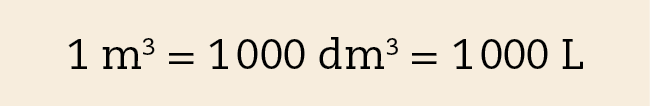

Respostas e comentários
Item 3
O significado físico da massa de um corpo como uma grandeza que expressa a inércia dêsse corpo é deixado para o volume do 9º ano. De acôrdo com essa conceituação, massa é a grandeza que expressa a inércia de um corpo. Inércia, por sua vez, é a tendência que a matéria tem de permanecer em repouso ou em movimento retilíneo uniforme.
No 6º ano, é conveniente que o conceito de massa seja encarado como o resultado de uma medida feita com uma balança de dois pratos, sendo expressa em grama, ou seus múltiplos e submúltiplos.
O conceito de volume também está relacionado a uma propriedade da matéria – a extensão. Extensão é a propriedade que a matéria tem de ocupar um lugar no espaço; e volume é a grandeza que mede a extensão de um corpo.
Impenetrabilidade, divisibilidade, compressibilidade e elasticidade são outras propriedades da matéria. Como essas propriedades são de fácil entendimento, se achar adequado, comente com os estudantes a respeito delas.
Interdisciplinaridade
Troque ideias com o colega de Matemática, porque algumas unidades de volume podem, eventualmente, já ter sido trabalhadas naquele componente.
Aproveite, se possível com a participação dele, os saberes prévios dos estudantes ao trabalhar o presente tema.
Atividades
Ao final do item 3, são recomendados os exercícios 6 a 8 do Use o que aprendeu.
4. Densidade
Relação entre massa e volume
Para certo tipo de cortiça, verifica-se que:

Para o chumbo, verifica-se que:

Percebeu alguma regularidade?
O conceito de densidade
A razão entre massa e volume para a cortiça é:
O resultado obtido (0,32 grama por mililitro) é a densidade da cortiça, grandeza que informa quanto de massa existe em certo volume.
Para o chumbo, temos:
A densidade do chumbo (11,3 gramas por mililitro) é, portanto, diferente da densidade da cortiça. Um mililitro de chumbo tem maior massa que um mililitro de cortiça.

A unidade da densidade é composta de uma unidade de massa dividida por uma unidade de volume, por exemplo, em grama por mililitro, grama por litro, quilograma por litro etcétera
Comparando densidades
Para a água líquida, verifica-se que:

Com esses dados, calculamos a densidade da água líquida:
Assim, comparando os valores de densidades, concluímos que:
densidadecortiça menor que densidadeágua menor que densidadechumbo

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• matéria • volume • densidade
Respostas e comentários
Item 4
Para fazer a explanação do conceito densidade, reproduza na lousa a relação entre a massa e o volume para a cortiça, o chumbo e a água, conforme está no livro do estudante.
Em seguida, passe à explicação do cálculo da densidade dêsses materiais, concluindo que:
dágua = 1 grama por mililitro
dcortiça = 0,32 grama por mililitro
dchumbo = 11,3 grama por mililitro
A seguir, pergunte: se colocarmos em um copo com água, 10 gramas de cortiça e 10 gramas de chumbo, como esses dois materiais irão se comportar?
No 5º ano, os estudantes já estudaram a propriedade densidade, associada à habilidade ê éfe zero cinco cê ih zero um (“Explorar fenômenos da vida cotidiana que evidenciem propriedades físicas dos materiais – como densidade, condutibilidade térmica e elétrica, respostas a fôrças magnéticas, solubilidade, respostas a fôrças mecânicas (dureza, elasticidade etcétera), entre outras.”). Em função disso e da abordagem anterior, os estudantes poderão concluir que o chumbo afundará, pois é mais denso que a água, e a cortiça boiará, já que é menos densa que esse líquido.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- matéria Tudo aquilo que possui massa e ocupa lugar no espaço.
- volume Porção do espaço que é ocupada por uma amostra de matéria.
- densidade Relação (divisão) entre a massa e o volume de uma substância, um material ou um objeto.
Densidade e flutuação
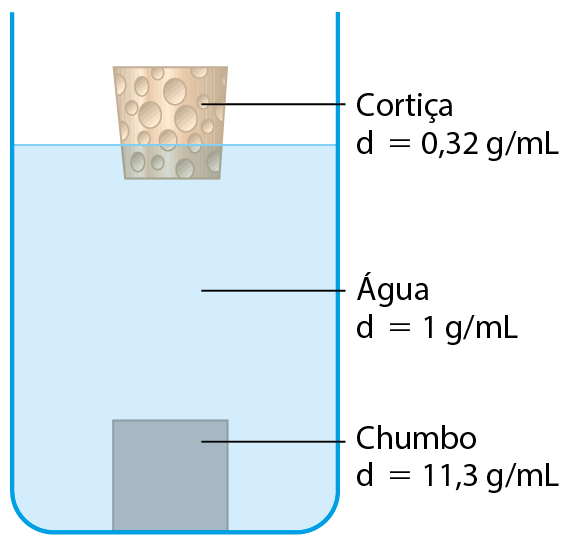
Quando jogamos pedaços de cortiça em um recipiente com água, verificamos que eles flutuam. Já ao jogarmos pedaços de chumbo, eles afundam. Algumas pessoas tentam explicar isso dizendo que o chumbo é mais “pesado” que a cortiça. Porém, um pedaço de cortiça de massa 10 quilogramas flutua, enquanto um pedaço de chumbo de 1 quilograma afunda. Não importa a massa: pedaços de cortiça flutuam na água e pedaços de chumbo afundam.
O resultado a que chegamos (dcortiça < dágua < dchumbo) sugere que a cortiça flutua na água porque é menos densa que ela e que o chumbo afunda porque é mais denso que esse líquido (veja a figura da cortiça e do chumbo na água). De fato, muitas evidências experimentais permitiram aos cientistas concluir que essa afirmação é verdadeira.
A comparação entre as densidades permite prever se um corpo vai afundar ou flutuar em certo líquido. Imagine, por exemplo, que uma bolinha de gude (d = 2,7 gramas por mililitro) e um pedaço de poliestireno expandido (d = 0,03 grama por mililitro) sejam colocados num frasco com azeite de oliva (d = 0,92 grama por mililitro). O que se pode prever?
Alguns fatores que afetam a densidade
A densidade depende, em primeiro lugar, da substância ou do material considerado. Alguns valores de densidade são apresentados na tabela a seguir.
Em segundo lugar, a densidade de um mesmo material depende da temperatura. Uma mudança de temperatura provoca a dilatação (aumento de volume) ou a contração (diminuição de volume) do material, e isso interfere no valor da densidade.
As mudanças de fase provocam mudanças na densidade de uma substância. A água líquida, por exemplo, tem densidade 1 grama por mililitro, e a água sólida (gelo) tem densidade 0,92 grama por mililitro. Isso permite entender por que o gelo flutua na água!
|
Substância |
Densidade (g/mL) a 25 °C |
Material |
Densidade |
|
|---|---|---|---|---|
|
Ósmio |
22,6 |
Madeira balsa |
0,11 a 0,14 |
|
|
Platina |
21,5 |
Bambu |
0,31 a 0,40 |
|
|
Ouro |
19,3 |
Couro seco |
0,86 |
|
|
Mercúrio |
13,5 |
Manteiga |
0,86 a 0,87 |
|
|
Chumbo |
11,3 |
Borracha |
0,91 a 1,25 |
|
|
Prata |
10,5 |
Ébano |
1,11 a 1,33 |
|
|
Cobre |
8,96 |
Gelatina |
1,27 |
|
|
Ferro |
7,87 |
Osso |
1,7 a 2,0 |
|
|
Iodo |
4,93 |
Giz |
1,9 a 2,8 |
|
|
Alumínio |
2,70 |
Areia |
2,14 a 2,36 |
|
|
Cloreto de sódio |
2,17 |
Porcelana |
2,3 a 2,5 |
|
|
Enxofre |
2,07 |
Bola de gude |
2,6 a 2,84 |
|
|
Água |
1,00 |
Quartzo |
2,65 |
|
|
Sódio |
0,97 |
Granito |
2,64 a 2,76 |
|
|
Lítio |
0,53 |
Diamante |
3,51 |
Fonte: Reines, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 4-44ésse ésse e 15-39ésse ésse.

Use a internet
A simulação da página da internet sugerida a seguir permite compreender a densidade através de simulações e experimentos. Você pode, por exemplo, modificar a massa ou o volume de um objeto e ver o que isso faz com a densidade.
O endereço é:
https://oeds.link/xgHIht. Acesso em: 16 abril 2022.
Respostas e comentários
Atente!
No final do terceiro parágrafo do subitem Densidade e flutuação é feita uma pergunta aos estudantes.
A expectativa é a de que respondam que o pedaço de poliestireno expandido, menos denso que o azeite, flutuará. E a bolinha de gude, mais densa que ele, afundará.
Sugestão
Após o terceiro parágrafo do subitem Alguns fatores que afetam a densidade, retorne à foto de abertura deste capítulo e analise a flutuação do na água do mar usando o conceito de densidade.
Convide os estudantes a reavaliar, se necessário, a resposta dada naquela ocasião. O flutua na água do mar porque é menos denso que ela.
Use a internet
Solicite aos estudantes que realizem o que está na área introdução do simulador, testando todos os materiais e diferentes massas, de fórma a compreender que a densidade se mantém constante no mesmo material mesmo ao alterar a massa (porque o volume se altera junto).
Na seção comparação do simulador, peça aos estudantes que comparem materiais de mesma massa e depois de mesmo volume, comparando a densidade entre eles. Solicite então que calculem o volume dos materiais de densidades iguais.
Na seção desafio, solicite aos estudantes que tentem descobrir os materiais da seção mistério analisando a tabela de densidade, o volume (calculado ao afundar o material na água) e a massa de cada material.
EM DESTAQUE
Por que os navios de ferro não afundam?

É fácil entender por que as embarcações feitas de madeira menos densa que a água não afundam. Mas, quando pensamos nos grandes navios, feitos de ferro, surge a dúvida: por que eles flutuam, se o ferro (d = 7,87 gramas por mililitro) é mais denso que a água?
Para responder a essa pergunta, vamos inicialmente considerar um pedaço de ferro maciço. Se ele for jogado na água, afundará.
Com a mesma quantidade de ferro, vamos produzir uma esfera oca, totalmente fechada, em cujo interior exista apenas ar. Uma vez colocada na água, verifica-se que essa esfera flutua. Apesar da alta densidade do ferro, o ar interno é tão pouco denso que isso faz com que a densidade total do corpo seja pequena, menor que a da água.
Em seguida, essa esfera é cortada ao meio, o que produz dois hemisférios. Um deles é colocado delicadamente na água, com a abertura para cima, e verifica-se que flutua. A explicação é a mesma usada no caso da esfera oca. Quando consideramos o hemisfério como um todo, incluindo o ar, a sua densidade é mais baixa que a da água e, consequentemente, ele não afunda.
Se o outro hemisfério for preenchido com água e colocado na água, ele afundará. Isso significa que sua densidade, incluindo a água interna, é maior que a da água.

E agora, você consegue explicar por que um navio de ferro flutua na água? E por que um furo no casco pode ser fatal?
Você pode comprovar o que acabamos de dizer, repetindo em casa a demonstração que aparece nas fotos a seguir. Você necessitará de uma vasilha com água e de massa de modelar.


Elaborado com dados obtidos de: LIU, C. The handy physics answer book. terceira edição Detroit: Visible Ink Press, 2021.
Respostas e comentários
Em destaque
Para abordar o tema dessa seção, se julgar conveniente, comece por reproduzir em sala, com os estudantes, a demonstração que está nas fotos do final do boxe. A partir disso, leia o texto em sala, interpretando-o detalhadamente e esclarecendo as dúvidas eventualmente levantadas pelos estudantes.
Conteúdo atitudinal sugerido
• Interessar-se pelas ideias científicas e pela Ciência como maneira de entender melhor o mundo que nos cérca.
Desenvolver nos estudantes o interêsse pelos conceitos científicos e pela Ciência como um modo de compreender melhor o mundo em que vivemos é uma atitude que se pretende desenvolver ao longo de todo o curso de Ciências da Natureza.
Este capítulo ilustra a importância prática das ideias científicas e possibilita que, durante seu desenvolvimento, o professor possa explicitar a importância dêsse conteúdo atitudinal aos estudantes.
Projeto
O Projeto 3 (do final do livro) pode ser realizado assim que o conteúdo do Em destaque for trabalhado.
Por meio do procedimento nele descrito, observa-se uma interessante situação envolvendo densidade e flutuação em que uvas-passas estão submersas em um refrigerante gaseificado.
Esse projeto é comentado neste Manual do professor, junto da respectiva ocorrência no final do livro do estudante.
EM DESTAQUE
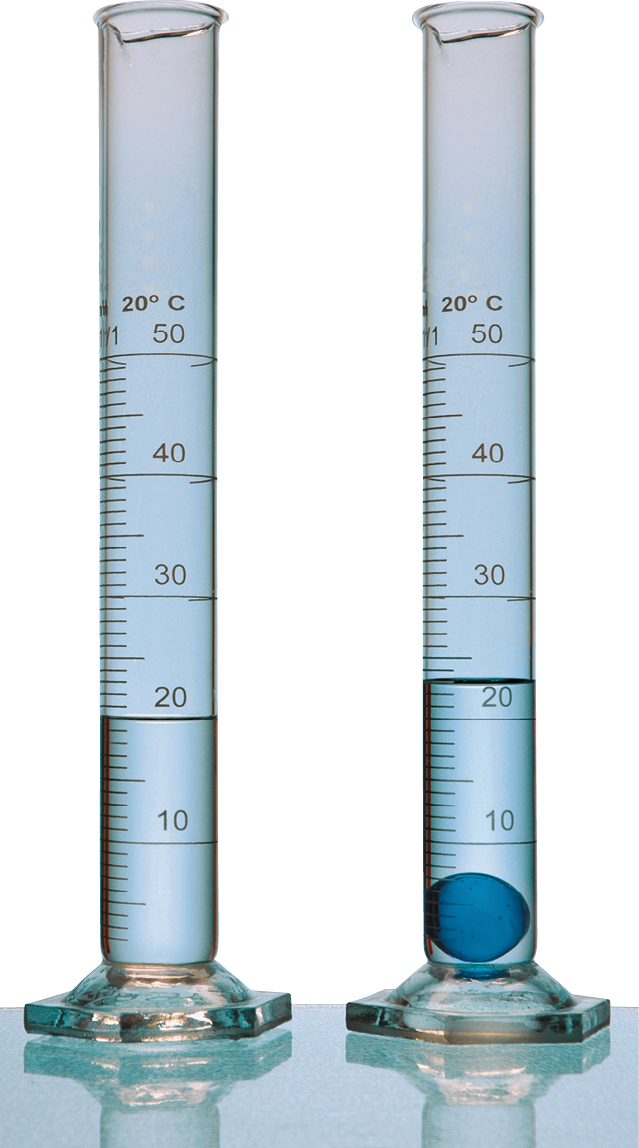
Um experimento e três conclusões
Ambas as provetas (cilindros com graduação de volume) da foto continham água até a marca de 20 mililitros. Uma bolinha de gude foi colocada em uma delas. Esse simples experimento revela fatos importantes.
- A bolinha de gude é mais densa que a água.
- A subida do nível da água mostra que duas porções de matéria não podem ocupar o mesmo lugar no espaço, num mesmo instante. Essa é uma propriedade da matéria denominada impenetrabilidade.
- É possível determinar o volume da bola. Você consegue dizer como?
Elaborado com dados obtidos de: , J. Chemistry. quinta edição Nova York: McGraw-Hill, 2020.
5. Substâncias químicas
Este capítulo e o seguinte têm por objetivo fornecer a você uma visão introdutória da Química, ciência que se ocupa fundamentalmente de estudar:
- a composição das substâncias químicas;
- as propriedades das substâncias químicas;
- as transformações que as substâncias químicas podem sofrer para formar outras substâncias químicas e as condições necessárias para favorecer ou impedir tais transformações.
O conceito de substância química — ou simplesmente substância, como vamos chamar de agora em diante — está intimamente relacionado ao estudo da Química.
Os químicos consideram que uma substância é uma porção de matéria que tem propriedades bem definidas e que lhe são características. Entre essas propriedades estão a temperatura de fusão (tê éfe), a temperatura de ebulição (tê e), a densidade (d), o fato de ser inflamável ou não, a cor etcétera
Duas substâncias diferentes podem, eventualmente, possuir algumas propriedades iguais, mas nunca todas elas.




Respostas e comentários
Atividades
Ao final do texto Em destaque, proponha o exercício 9 do Use o que aprendeu e as atividades 14 a 17 do Explore diferentes linguagens.
Item 5
Note que, neste momento, substância é caracterizada macroscopicamente, isto é, por suas propriedades macroscópicas (e não por meio da constituição em nível atômico-molecular).
A sugestão é que você se atenha a essa fórma de apresentação, deixando o nível submicroscópico para outro volume.
6. Misturas
Substâncias puras vérçus misturas
A água possui densidade 1,0 grama por mililitro, e o cloreto de sódio, 2,17 gramas por mililitro. Ao acrescentar cloreto de sódio à água e mexer, obtém-se uma mistura cuja densidade é diferente da dos dois componentes isolados. Analise a tabela a seguir, que ajuda a esclarecer esse ponto.
|
Porcentagem de sal na massa total da mistura (%) |
Densidade |
|---|---|
|
1 |
1,005 |
|
2 |
1,013 |
|
4 |
1,027 |
|
6 |
1,041 |
|
8 |
1,056 |
|
10 |
1,071 |
|
12 |
1,086 |
|
14 |
1,101 |
|
16 |
1,116 |
|
18 |
1,132 |
|
20 |
1,148 |
|
22 |
1,164 |
|
24 |
1,184 |
|
26 |
1,197 |
Fonte: , B. S. êti áli. Vogel's textbook of practical Organic Chemistry. quarta edição Londres: Longman, 1987. página .1312.
Como se pode perceber, a densidade de uma mistura de água e cloreto de sódio varia de acôrdo com a porcentagem de sal.
Verifica-se experimentalmente que uma mistura de água e cloreto de sódio, colocada num congelador, não congela a 0 grau Célsius. Essa mistura inicia seu congelamento abaixo de 0 grau Célsius (o valor exato depende do teor de sal), e a temperatura não permanece constante durante o congelamento, mas diminui gradualmente.
Quando aquecida, verifica-se que essa mistura não entra em ebulição a 100 graus Célsius. Ela começa a ferver acima de 100 graus Célsius (o valor exato depende do teor de sal), e a temperatura não permanece constante durante a ebulição, mas aumenta progressivamente.
Perceba, portanto, que uma mistura de água e cloreto de sódio possui propriedades que não são características da água nem do sal.
Agora podemos estabelecer uma importante diferença entre substância pura e mistura.
Uma substância pura, como o próprio nome diz, está pura, ou seja, não está misturada com outra substância ou com outras substâncias. Em geral, quando um químico se refere à substância água, por exemplo, ele está deixando subentendido que se refere à substância pura água.
Já uma mistura é a reunião de duas ou mais substâncias puras. A partir do momento em que elas são reunidas, deixam obviamente de ser consideradas substâncias puras. Elas passam a ser as substâncias componentes da mistura.

ATIVIDADE
Tema para pesquisa
O que é um densímetro e para que é usado nos postos de combustível?
Respostas e comentários
De ôlho na Bê êne cê cê!
• ê éfe zero seis cê ih zero um
“Classificar como homogênea ou heterogênea a mistura de dois ou mais materiais (água e sal, água e óleo, água e areia etcétera).“
O capítulo propicia o desenvolvimento dessa habilidade a partir deste ponto.
Para os estudantes, adquirir essa habilidade é essencial para o desenvolvimento de outra, a ê éfe zero seis cê ih zero três, mais à frente, neste mesmo capítulo.
Item 6
Note que a distinção entre substância pura e mistura também é feita do ponto de vista macroscópico.
Conforme já mencionado, deixamos o nível atômico-molecular para outro momento, em outro volume.
Atividade
Após a análise da tabela do item 6, sugira aos estudantes o exercício 10 do Use o que aprendeu.
Ele envolve a clássica situação do ovo cru que afunda na água pura, mas flutua se a água contiver concentração de sal de cozinha suficiente para que a solução aquosa se torne mais densa que o ovo.
Tema para pesquisa
A determinação da densidade é útil no contrôle de qualidade dos combustíveis em postos de gasolina. A adulteração pode ser constatada com o densímetro.
Caso julgue oportuno, pode-se também sugerir o seguinte tema:
“O que é dureza? No dia a dia, essa palavra é empregada com o mesmo sentido que a Ciência a emprega?”
Esse tema permite aos estudantes tomar contato com outra propriedade da matéria, a dureza, muito útil na caracterização de substâncias sólidas, especialmente rochas e minerais.
Misturas heterogêneas e misturas homogêneas
Ao adicionar um pouco de ferro em pó a um pouco de enxofre em pó, obtém-se uma mistura que não possui propriedades iguais em todos os seus pontos. Os pequenos fragmentos de ferro possuem as propriedades da substância ferro (cor cinza-metálica tê éfe = .1538 graus Célsius etcétera) e os pequenos fragmentos de enxofre possuem as propriedades da substância enxofre (cor amarela, tê éfe = 95 graus Célsius etcétera).
Trata-se de uma mistura heterogênea, um tipo de mistura que não possui as mesmas propriedades em toda a sua extensão.
Por outro lado, se colocarmos uma pitada de açúcar numa porção de água pura e mexermos com uma colhér por alguns minutos, obteremos uma mistura que possui as mesmas propriedades em toda a sua extensão. Assim, por exemplo, quaisquer porções dessa solução são incolores e têm a mesma densidade; enfim, compartilham as mesmas propriedades.
Esse é um exemplo de mistura homogênea, mistura que tem as mesmas propriedades em todos os seus pontos.


Número de fases
Quando estudamos uma amostra qualquer de matéria — seja ela substância pura ou mistura —, é bastante útil o conceito de fase.
Podemos definir fase como uma porção de uma amostra de matéria que apresenta as mesmas propriedades. Uma fase pode apresentar-se contínua ou fragmentada em várias partes.
Para deixar isso mais claro, considere a mistura de óleo e água mostrada na foto. Trata-se de uma mistura heterogênea, na qual uma fase é óleo e a outra fase é água. Nesse exemplo, ambas as fases são contínuas.
Voltemos ao exemplo da mistura de ferro e enxofre. Nela, os grãozinhos de ferro constituem uma fase, e os grãozinhos de enxofre constituem outra fase. Diferentemente da mistura de água e óleo, nesse caso cada fase apresenta-se fragmentada em muitas partes.
Numa mistura de água e açúcar, que é homogênea, existe uma só fase. Isso pode ser generalizado para todas as misturas homogêneas. Já que apresentam as mesmas propriedades em todos os seus pontos, são constituídas necessariamente por uma única fase.
Assim, concluímos que uma mistura homogênea apresenta uma só fase e uma mistura heterogênea apresenta duas ou mais fases.


ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• substância química • mistura • mistura homogênea • mistura heterogênea • fase
Respostas e comentários
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- substância química Porção de matéria que tem propriedades características, tais como temperatura de fusão, temperatura de ebulição e densidade.
- mistura Reunião de duas ou mais substâncias diferentes.
- mistura homogênea Mistura cujas propriedades (e composição) são as mesmas em toda a sua extensão.
- mistura heterogênea Mistura cujas propriedades (e composição) não são as mesmas em toda a sua extensão.
- fase Porção de uma amostra de matéria que apresenta as mesmas propriedades (e composição) em toda a sua extensão. Mistura homogênea, por exemplo, tem uma só fase e mistura heterogênea, duas ou mais.
EM DESTAQUE
As soluções e o cotidiano
Solução é o nome dado pelos químicos para qualquer mistura homogênea.
Quando você coloca um pouco de açúcar na água e mexe até obter uma só fase, está fazendo uma solução. O mesmo acontece se você adicionar um pouquinho de sal de cozinha à água e misturar bem.
Em Química, o verbo dissolver pode ser empregado de duas maneiras. Podemos usá-lo para nos referir ao ato praticado por uma pessoa ao fazer uma solução. Uma frase como “eu dissolvi o açúcar em água” exemplifica esse uso. Outro modo de usar o verbo dissolver é aplicá-lo a uma substância a fim de expressar a propriedade que a substância tem de misturar-se a outra, originando uma solução. Numa frase como “a água dissolve o açúcar”, temos um exemplo dêsse tipo de uso.
Quando uma substância é capaz de dissolver outra, costumamos chamá-la solvente. Assim, a água é um solvente para o açúcar, para o sal de cozinha, para o etanol (álcool comum) e para várias outras substâncias.
A substância que é dissolvida num solvente, a fim de fazer uma solução, é denominada soluto.
Se uma solução é preparada com o solvente água, dizemos que é uma solução aquosa. Ao dissolver açúcar em água, por exemplo, obtemos uma solução aquosa de açúcar, na qual a água é o solvente e o açúcar é o soluto.
São inúmeras as soluções presentes em nosso cotidiano, principalmente as soluções aquosas. Entre os exemplos destas últimas, temos os sucos de frutas, os refrigerantes (desconsiderando as bolhas de gás eventualmente presentes), a saliva, o plasma sanguíneo, a urina, a água da chuva e até mesmo a água potável.
Embora grande parte das soluções esteja no estado líquido, existem também soluções gasosas e soluções sólidas.
O ar atmosférico, convenientemente filtrado para eliminar partículas nele dispersas, é um exemplo de solução gasosa, na qual predominam o gás nitrogênio (cêrca de 78%) e o gás oxigênio (cêrca de 21%).
Entre as soluções sólidas, podemos destacar o ouro usado pelos joalheiros (mistura de ouro e cobre em proporção adequada) e o latão (mistura de cobre e zinco em proporção adequada).
Elaborado com dados obtidos de: Zoomdal, S. S.; Zoomdal, S. A.; DECOSTE, D. J. Chemistry. décima edição bóston: Cengage, 2018.



ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• solução • solvente • soluto
Respostas e comentários
De ôlho na Bê êne cê cê!
Em consonância com a habilidade ê éfe zero seis cê ih zero um da Bê êne cê cê, o objetivo principal do Em destaque do final do item 6 é caracterizar solução como qualquer mistura homogênea e apresentar exemplos cotidianos de soluções.
Em destaque
Ao trabalhar o texto As soluções e o cotidiano, resgate o conceito de substância pura.
Comente com os estudantes que a água encontrada na natureza não é pura. Eles poderão verificar isso ao fazer a leitura do rótulo de uma água mineral, por exemplo. Destaque que existem sais minerais dissolvidos na água, o que comprova que a água não é pura.
Explique que, para obter água pura, é necessário que ela passe por processos adequados, como a destilação (estudada logo mais à frente). Quando uma amostra de água é submetida a essa técnica de separação de misturas, a água vaporiza e, a seguir, condensa. Já microrganismos e minerais presentes não vaporizam e são separados da água.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- solução Nome pelo qual podemos chamar qualquer mistura homogênea.
- solvente Componente de uma solução que se considera aquele que dissolve os demais.
- soluto Componente da solução que está dissolvido no solvente.
Atividades
Após trabalhar o Amplie o vocabulário!, o momento é oportuno para propor aos estudantes os exercícios 11 a 13 do Use o que aprendeu e as atividades 18 e 19 do Explore diferentes linguagens.
7. Separação de misturas
Os materiais naturais são, em sua maioria, misturas de substâncias. Para que os químicos consigam estudar a composição, as propriedades e as transformações das substâncias, é essencial que consigam purificar as misturas.
Assim, em muitos laboratórios de pesquisa, o uso de técnicas de separação de misturas faz parte do dia a dia dos químicos. Tal assunto — separação de misturas — é muito vasto. Vamos aqui mostrar exemplos de métodos químicos que permitem separar algumas misturas presentes no cotidiano, por exemplo, areia e água, óleo e água, água e sal.
Separação de mistura de areia e água
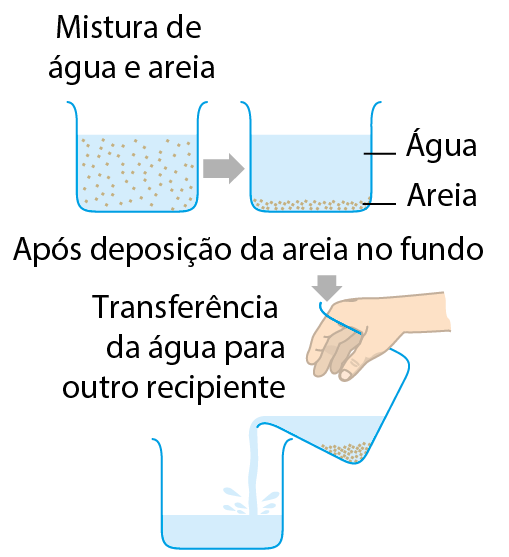
A mistura de areia e água é heterogênea e formada por duas fases. Uma delas é a água, e a outra é a areia.
Uma maneira de separar essa mistura é esperar que a areia se deposite no fundo do recipiente. (Essa deposição de sólido no fundo do frasco é chamada sedimentação.) Após a deposição da areia, pode-se cuidadosamente transferir a água para outro recipiente. Restarão, no fundo do frasco original, a areia e um pouco de água (esse resíduo de água pode ser eliminado, por exemplo, esperando que evapore). Essa técnica de separação, esquematizada a seguir, é chamada decantação.
Para separar misturas heterogêneas sólido/líquido existe outro processo, um pouco mais trabalhoso, porém de maior eficiência que a decantação. É a filtração (veja a figura a seguir), técnica que consiste em despejar a mistura sôbre uma superfície porosa, o filtro.
O filtro permite que a fase líquida o atravesse, mas retém a fase sólida, propiciando a separação de ambas. O princípio de funcionamento do filtro pode ser comparado, simplificadamente, ao das peneiras. O papel-filtro, bastante empregado em laboratórios, é elaborado com fibras de papel entrelaçadas de modo que os orifícios entre elas (invisíveis a ôlho nu) atuem como os orifícios de uma peneira. As partículas formadoras da água são tão pequenas que passam por esses orifícios. Já as partículas de areia, maiores que eles, são retidas pelo papel.
Esquema de decantação
Fonte: , J. (edição). Oxford dictionary of Chemistry. quinta edição Oxford: Oxford University Press, 2004. página 173.
a
Esquema de filtração
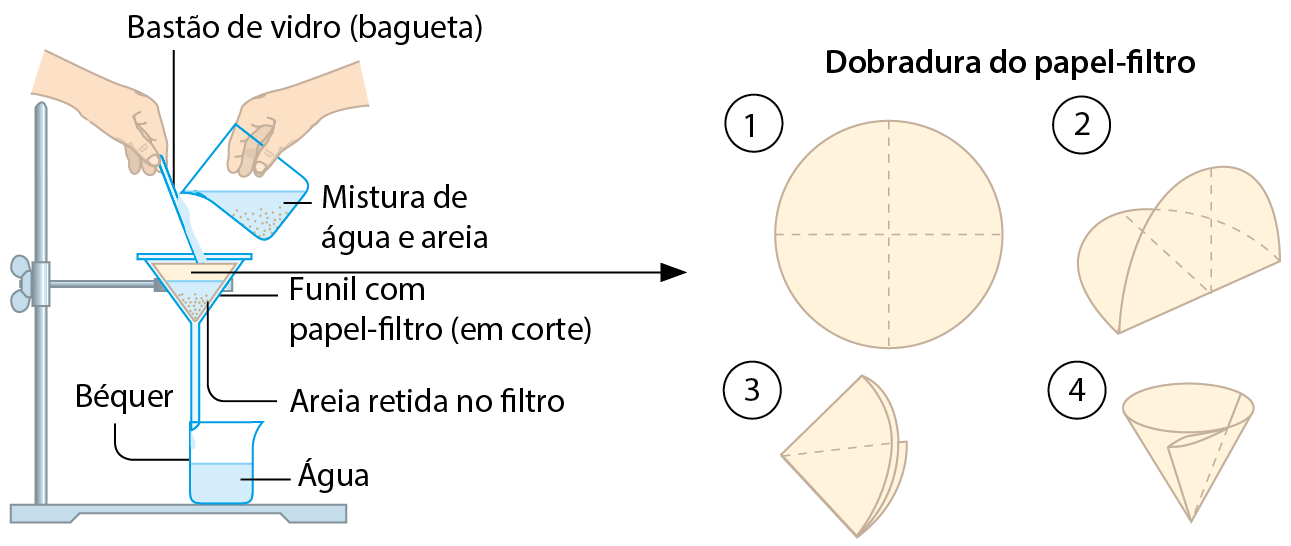
Fonte: réris, D. C. Quantitative Chemical analysis. nona edição Nova York: Freeman, 2016. página 36.
ATENÇÃO!
Por razão de segurança, para realizar qualquer experimento de Química você deve ter a AUTORIZAÇÃO e a SUPERVISÃO de seu professor, mesmo que pareça ser algo inofensivo.
Respostas e comentários
De ôlho na Bê êne cê cê!
• ê éfe zero seis cê ih zero três
“Selecionar métodos mais adequados para a separação de diferentes sistemas heterogêneos a partir da identificação de processos de separação de materiais (como a produção de sal de cozinha, a destilação de petróleo, entre outros).“
A partir deste ponto, o capítulo propicia aos estudantes o desenvolvimento dessa habilidade, por meio do texto e das atividades propostas.
A destilação do petróleo é tratada no próximo capítulo, razão pela qual o trabalho com a ê éfe zero seis cê ih zero três prosseguirá naquele capítulo.
Separação da mistura de óleo e água
Ao misturar óleo de cozinha e água, obtemos uma mistura heterogênea na qual a fase superior é o óleo, menos denso, e a inferior é a água, mais densa.
Para separar misturas heterogêneas líquido/líquido como essa, os químicos utilizam um aparelho de vidro, o funil de separação, que aparece ilustrado no esquema. A mistura é colocada dentro dele. A torneira é ligeiramente aberta, permitindo o escoamento gradual da fase inferior, que é recolhida em outro frasco. Fechando a torneira no exato momento em que a fase inferior acabou de escoar, consegue-se a separação das duas fases: a inferior é recolhida no frasco, e a superior permanece no funil de separação.
Esquema do funil de separação
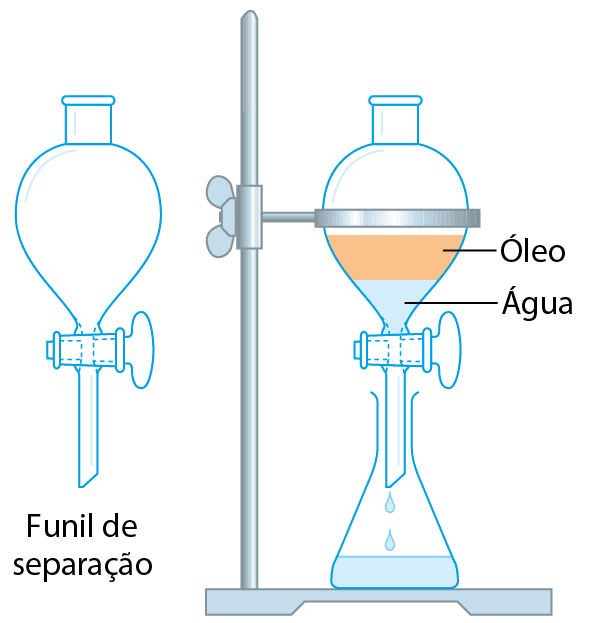
Fonte: Bettelrim, F. A. êti áli. Introduction to General, Organic, and Biochemistry. décima segunda edição bóston: Cengage. 2020. página 171.
Separação da mistura de água e sal
Para separar uma mistura homogênea de sal e água (uma solução aquosa de sal), podemos simplesmente esperar pela evaporação completa da água, por exemplo, sob ação do calor solar. Assim que a evaporação acabar, restará o sal.
Esse processo tem larga utilização nas salinas, instalações nas quais a água do mar é colocada em tanques largos e rasos para que vá evaporando gradualmente.
Com a evaporação da água, obtém-se uma mistura de substâncias sólidas. Esta, a seguir, passa por outro processo de purificação, também denominado refino, durante o qual são eliminadas impurezas, principalmente duas delas (o cloreto de magnésio e o sulfato de magnésio), que, se não fossem eliminadas, dariam sabor amargo ao produto final, o sal de cozinha.
A evaporação é uma técnica barata, usada para se obter o componente sólido que está dissolvido no líquido. O componente líquido (a água, no caso) é perdido no processo.
Mas qual seria o procedimento para obter água pura a partir da água do mar?

Respostas e comentários
Projetos
O Projeto 4 (do final do livro) pode ser realizado quando o conteúdo separação de misturas tiver sido trabalhado com os estudantes.
Ele versa sôbre uma separação de misturas envolvendo filtração e subsequente evaporação do solvente.
O Projeto 5 (do final do livro) também pode ser realizado nessa altura do curso.
Trata-se da separação de uma mistura heterogênea líquido/líquido.
Esses projetos são comentados neste Manual do professor, junto das respectivas ocorrências no final do livro do estudante.
Interdisciplinaridade
Uma nota histórica: a palavra salário tem origem no latim salarium.
Os soldados romanos recebiam o pagamento em sal, que, dada sua importância (inclusive na conservação de alimentos, por meio da salga), podia ser trocado por outros bens necessários. No Império Romano da Antiguidade, o sal funcionava, portanto, como bem para permuta.
Para separar a mistura de água e sal e recuperar também a água, emprega-se a destilação, ilustrada a seguir. A mistura é aquecida e a água entra em ebulição, mas o sal não. O vapor de água é resfriado quando passa pelo interior do condensador e, com isso, condensa-se. A água líquida, isenta de sal, é recolhida no recipiente da direita e, ao final, restará sal sólido no frasco da esquerda.
Esquema da destilação

Fonte: bróun, T. êti áli. Chemistry: the central science. décima quinta edição Nova York: Pearson, 2022. página 58.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• decantação • filtração • funil de separação • destilação
Organização de ideias
MAPA CONCEITUAL
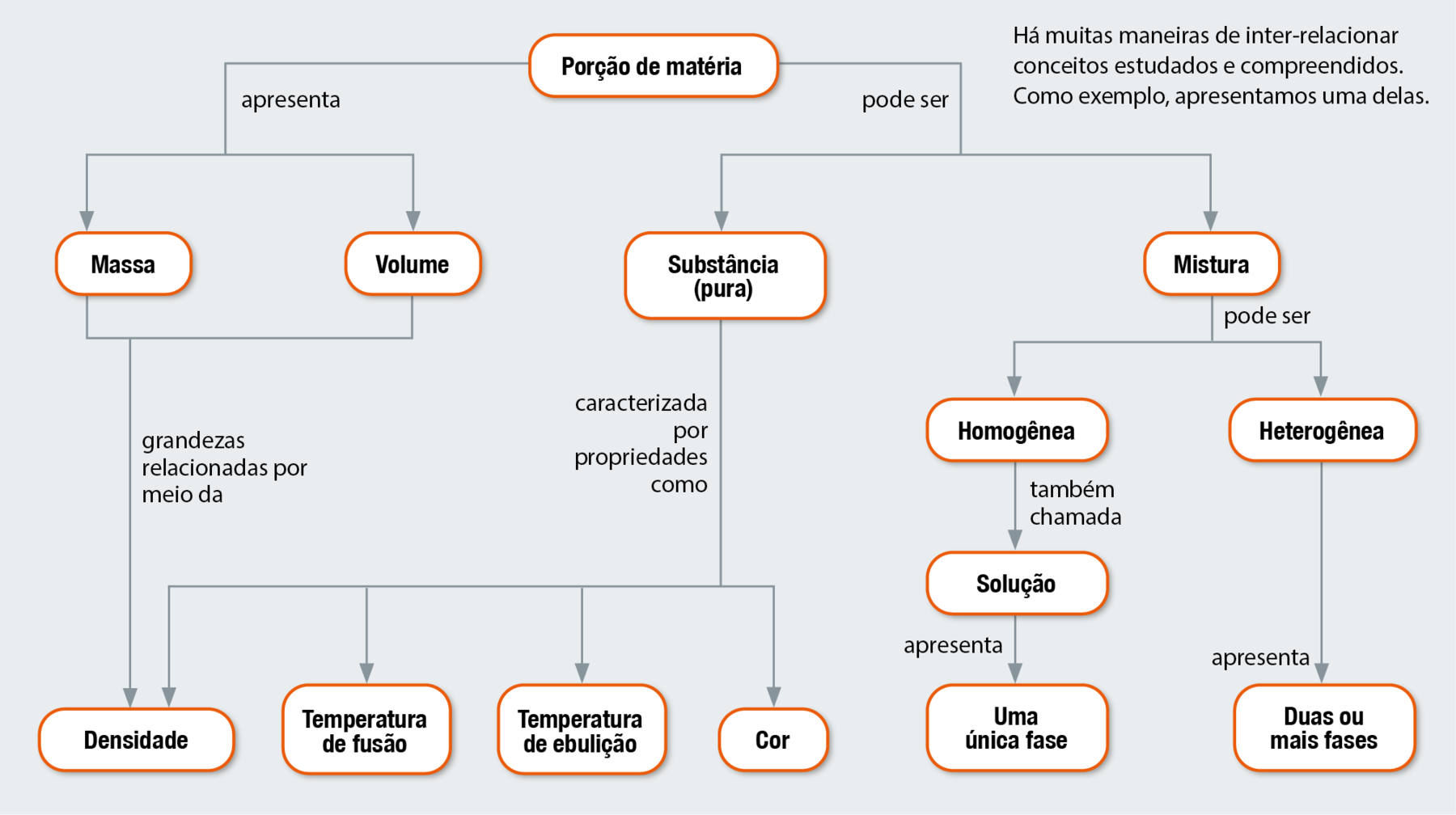
Respostas e comentários
Atividades
Após o Amplie o vocabulário!, proponha os exercícios 14 a 17 do Use o que aprendeu.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- decantação Método de separação de misturas heterogêneas com o auxílio da fôrça da gravidade.
- filtração Método de separação de misturas heterogêneas no qual um filtro retém uma fase e deixa a outra passar.
- funil de separação Equipamento para a separação de mistura heterogênea de fases líquidas.
- destilação Método de separação de misturas homogêneas em que um componente é vaporizado e, a seguir, condensado e recolhido em outro frasco.

Atividades
Use o que aprendeu
- Quando você sai de uma piscina e se expõe ao sol, sua pele fica seca depois de algum tempo. É correto dizer que a água:
- vaporizou?
- evaporou?
- entrou em ebulição?
- ferveu?
Justifique suas respostas.
- Às vezes, nos dias frios ou chuvosos, os vidros dos carros em que há alguém ficam embaçados do lado interno. Por que isso acontece?
- Em alguns automóveis há, no vidro traseiro, filamentos que servem de desembaçadores. Existe um botão no painel que, ao ser apertado, faz esses filamentos se aquecerem e, por causa disso, o vidro é desembaçado.
Proponha uma explicação para o fato de os filamentos aquecidos desembaçarem o vidro.
- Uma churrasqueira é feita de ferro. Sabendo que a temperatura de fusão do ferro é 1.538 graus Célsius, o que você pode afirmar sôbre a temperatura do carvão em brasa que está na churrasqueira durante o preparo do churrasco? Explique.
- A temperatura de fusão do ouro é 1.064 graus Célsius e a do rubi é 2.053 graus Célsius. Após um incêndio, foram encontrados os restos de um anel feito de ouro e rubi. O ouro estava todo deformado, pois derreteu durante o incêndio, mas o rubi mantinha seu formato original. O que se pode afirmar sôbre a temperatura das chamas durante o incêndio? Justifique sua resposta.
- Em uma lata de refrigerante temos a indicação “Contém 350 mililitros”. Esse volume equivale a quantos:
a) centímetro cúbico?
b) litros?
c) decímetro cúbico?
- Uma garrafa de água mineral traz a inscrição “Contém 1,5 litro”.
- Quantos centímetros cúbicos (cê ême3) de água há na garrafa?
- Quantos mililitros (ême éle) de água há na garrafa?
- Quantos decímetros cúbicos (dê ême3) de água há na garrafa?
- Quantos copos de capacidade 250 mililitros podem ser enchidos com 1,5 litro de água?
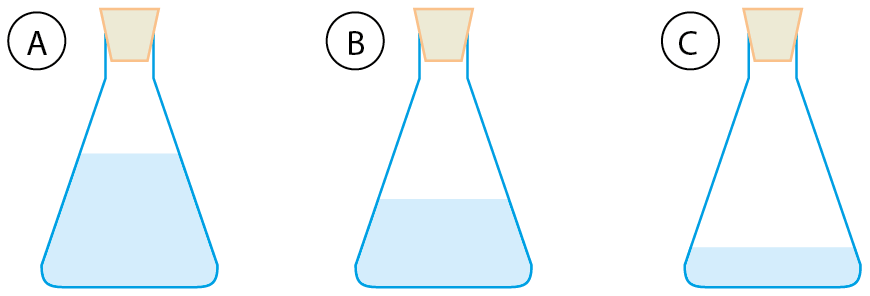
- Em três frascos iguais, que chamaremos A, B e C, foram colocadas massas iguais dos líquidos incolores benzeno (d = 0,88 grama por mililitro), água (d = 1,0 grama por mililitro) e clorofórmio (d = 1,49 grama por mililitro), um em cada frasco. Observe o desenho que mostra os três frascos, e conclua qual o líquido colocado em cada um. Justifique sua resposta.
ATENÇÃO!
Benzeno e clorofórmio NÃO DEVEM SER MANIPULADOS pelos estudantes, pois são líquidos voláteis altamente tóxicos.
- Um ovo de galinha, inteiro e cru, foi colocado num recipiente com água e afundou. Após dissolver algumas colheradas de sal de cozinha na água, o ovo passou a flutuar no líquido.
- Por que o ovo inicialmente afunda?
- A densidade do ovo se altera durante o experimento?
- Explique por que o ovo passa a flutuar após algum tempo.
- Quando você coloca um pouco de groselha (a bebida, não a fruta) na água e mexe bem, obtém uma mistura homogênea ou uma mistura heterogênea? Justifique.
- Considere uma solução aquosa de açúcar.
- O que é uma solução?
- Nessa solução, qual é o solvente? E o soluto?
- O que significa dizer que uma solução é aquosa?
- O que significa dizer que a água tem a propriedade de dissolver o sal de cozinha?
- Vários pequenos pedaços de dois materiais sólidos estão misturados. Um dêsses materiais tem densidade 1,2 grama por mililitro e o outro, 2,7 gramas por mililitro. Explique como um líquido de densidade 1,6 grama por mililitro, que não dissolve nem danifica esses sólidos, pode ser útil para separá-los.
Respostas e comentários
Respostas do Use o que aprendeu
1. a) Sim, pois vaporização é a transição da fase líquida para a fase vapor (fase gasosa).
b) Sim, pois a vaporização lenta e sem a formação de bolhas é denominada evaporação.
c) Não, pois não aconteceu a formação de bolhas (ao nível do mar, a água entra em ebulição a 100 graus Célsius, e não é essa a temperatura da superfície da pele).
d) Não, pois “ferver” é uma palavra empregada como sinônimo de “ebulir”.
2. O vapor de água presente na atmosfera interna do automóvel (proveniente, principalmente, do ar expirado) encontra a superfície fria dos vidros e se condensa sôbre eles.
3. Os filamentos aquecem o vidro e, consequentemente, a água que estava condensada na superfície dele. Essa água evapora, o que desembaça o vidro.
4. Uma vez que a churrasqueira não sofre fusão durante o churrasco, pode-se afirmar que a temperatura do carvão em brasa, durante o churrasco, não ultrapassa .1538 graus Célsius.
5. Se o ouro derreteu, a temperatura superou .1064 graus Célsius. Se o rubi não chegou a derreter, a temperatura não ultrapassou .2053 graus Célsius.
6. a) 350 centímetros cúbicos, pois 1 mililitro = 1 centímetro cúbico.
b) 0,350 litro, pois 1 litro = .1000 mililitros.
c) 0,350 decímetros cúbicos, pois 1 litro = 1 decímetro cúbico.
7. a) .1500 centímetros cúbicos
b) .1500 mililitros
c) 1,5decímetro cúbico
8. O volume de 1,5 litros de água corresponde a .1500 mililitros. Dividindo .1500 mililitros por 250 mililitros, obtém-se 6. Isso significa que o volume .1500 mililitros é 6 vezes maior que o volume 250 mililitros e, portanto, 6 copos podem ser enchidos.
9. Como há massas iguais dos três líquidos, o menos denso possui o maior volume, e o mais denso possui o menor volume. Assim, o benzeno, que tem menor densidade, é o líquido com maior volume e está no frasco A. O clorofórmio tem maior densidade, é o líquido de menor volume e se encontra no frasco C. A água, de densidade intermediária, está, portanto, no frasco B.
10. a) Porque sua densidade é maior que a da água.
b) Não. O que se altera é a densidade do líquido devido à dissolução do sal de cozinha.
c) A dissolução do sal de cozinha provoca um aumento da densidade do líquido. Quando essa densidade superar a densidade do ovo, este, por ser agora menos denso que o líquido, passará a flutuar nele.
11. Uma mistura homogênea, pois todas as suas partes têm as mesmas propriedades (cor e sabor, por exemplo).
12. a) Uma solução é uma mistura homogênea, ou seja, uma mistura em que há apenas uma fase.
b) O solvente é a água e o soluto é o açúcar.
c) Significa que, nessa solução, o solvente é a água.
13. Significa que, quando o sal de cozinha é misturado com a água e bem agitado, fórma-se uma solução aquosa.
14. A densidade do líquido está entre a dos dois sólidos. Como o líquido não os dissolve nem danifica, o sólido de densidade 1,2 grama por mililitro flutuará nele, e o que tem densidade 2,7 gramas por mililitro afundará. Isso permite separar os “vários pequenos pedaços” com certa facilidade.
- Uma pessoa tem um copo com uma mistura de água e óleo de cozinha. Tem também uma lata vazia, um prego, um martelo e dois copos limpos. Como ela pode separar a mistura de água e óleo usando esses materiais?
- Como você faria para separar uma mistura de serragem e areia?
- Explique como você faria para separar uma mistura de sal de cozinha e areia.

Atividades
Explore diferentes linguagens
A critério do professor, estas atividades poderão ser feitas em grupos.
ESQUEMA
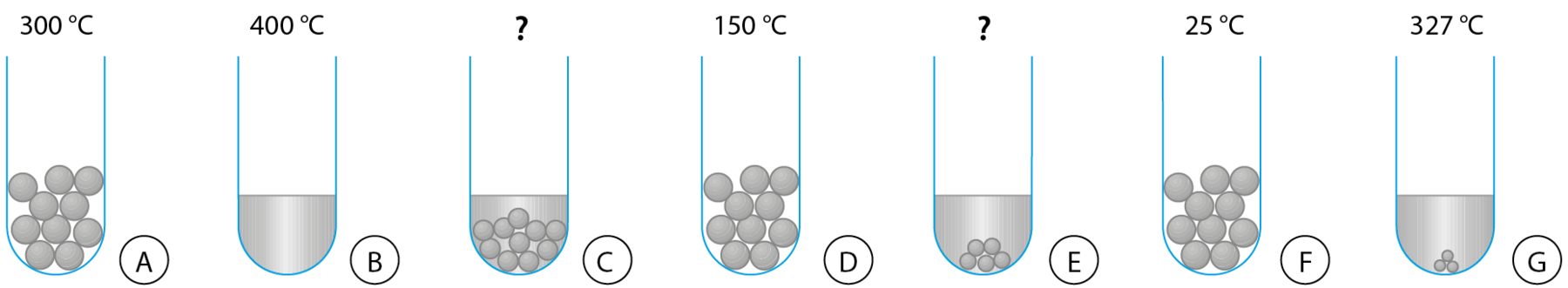
1. Num laboratório, pedacinhos do metal chumbo foram aquecidos até derreter completamente. Os desenhos mostram, de modo esquemático, o que há dentro do frasco em diferentes momentos do aquecimento.
Os desenhos não foram colocados na ordem correta e, em dois deles, falta a indicação da temperatura.
- Qual é a ordem correta dos desenhos?
- Qual é a temperatura em C? E em E? Justifique.
ANÚNCIO
2. Lojas de materiais para piscinas vendem um produto chamado “cloro líquido” e outro chamado “cloro sólido”.Consulte a tabela de temperaturas de fusão e de ebulição, fornecida neste capítulo, e comente se esses produtos podem ser a substância pura cloro. Justifique.

GRÁFICO
O gráfico mostra como varia, com o passar do tempo, a temperatura de uma amostra de água que recebe calor de uma chama de modo contínuo e regular. (O experimento é feito ao nível do mar.) Esse gráfico é denominado curva de aquecimento da água. O ponto A corresponde à situação inicial e o ponto F, à situação final. As atividades 3 a 12 se referem à interpretação do gráfico.
Curva de aquecimento da substância água em pressão atmosférica ao nível do mar
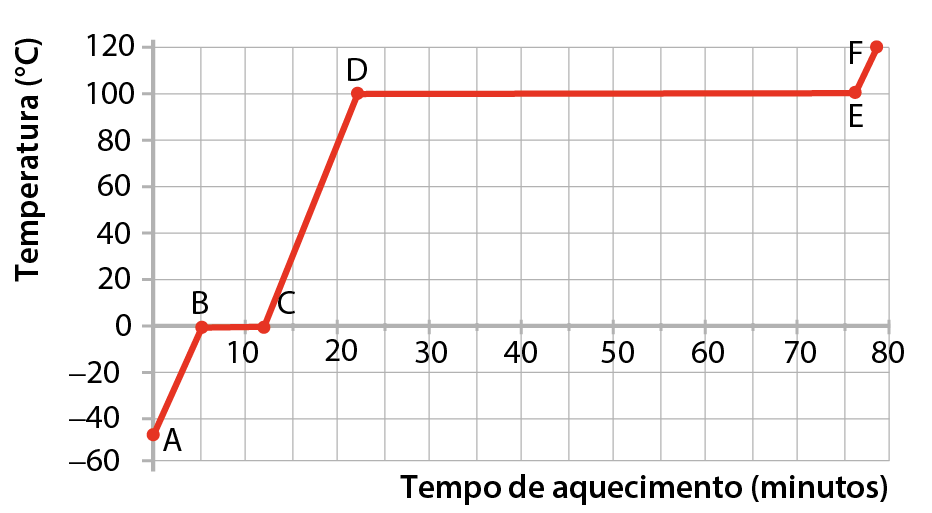
Fonte: Elaborado a partir de bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova York: Pearson, 2022. página 536.
Respostas e comentários
15. Espera-se uma descrição em que se faz um furo no fundo da lata ou na parte inferior da lateral. Assim, a lata pode atuar como se fosse um funil de separação improvisado. O dedo pode servir de “torneira”. A mistura de óleo e água é colocada na lata e a fase inferior (água) escorre primeiro para fóra, pelo furo, sendo coletada em um copo. O óleo, que escoa a seguir, é coletado em outro copo.
16. Um modo de executar a separação é adicionar água à mistura. A serragem flutua e a areia permanece no fundo. A serragem pode ser coletada, por exemplo, com uma peneira suficientemente fina. A água que permanece no recipiente com a areia pode ser entornada para outro recipiente (decantação). Tanto a serragem quanto a areia estarão molhadas, e a água nelas presente pode ser eliminada por evaporação.
17. Um modo de realizar a separação é acrescentar água à mistura, que dissolve o sal de cozinha, mas não a areia. A areia pode ser separada por filtração e, a seguir, seca por evaporação da água. O filtrado (a solução aquosa de sal de cozinha que atravessa o filtro) fornece o sal de cozinha seco após a evaporação da água.
Respostas do Explore diferentes linguagens
1. a) F, D, A, C, E, G e B.
b) Tanto em C quanto em E, a temperatura é 327 graus Célsius. Durante a fusão de uma substância pura, a temperatura permanece constante (no valor denominado temperatura de fusão). Como em C e em E o chumbo está em fusão, a temperatura deve ser igual à do desenho G, que também ilustra o chumbo em fusão.
2. Uma das tabelas do capítulo informa que o cloro tem temperatura de ebulição 34 graus Célsius. Assim, acima da temperatura de –34 graus Célsius, o cloro está em fase gasosa e, portanto, a substância comercializada não deve ser a substância pura cloro. Professor, para seu conhecimento: o “cloro sólido” é um sal do tipo hipoclorito, que contém em sua composição o elemento químico cloro. Geralmente é hipoclorito de cálcio, éle. Já o “cloro líquido” é uma solução aquosa contendo geralmente hipoclorito de sódio, éleóh. É o ânion hipoclorito (cêéleóh–), presente nesses produtos, que atua na desinfecção da água.
- Qual é a temperatura da água em cada um dos pontos de A a F?
- Em que trechos (A-B, B-C etcétera) a água sofre aumento de temperatura?
- Em que trechos a temperatura da água permanece constante?
- Qual é o estado de agregação da água no trecho A-B e no trecho C-D?
- Que fenômeno ocorre no trecho B-C?
- Que fenômeno ocorre no trecho D-E?
- Qual é o estado de agregação da água no trecho E-F?
- Como se denomina a temperatura da água no trecho B-C?
- Como se denomina a temperatura da água no trecho D-E?
- Uma amostra de água absorve mais calor para sofrer fusão ou para sofrer ebulição? Explique como concluiu.
CHARGE

13. a) Procure no capítulo dados que lhe permitam responder à pergunta:
. . Em que faixa de temperatura existe nitrogênio líquido (na pressão correspondente à do nível do mar)?
- Com base na resposta anterior, decida se é possível que a mão de uma pessoa viva esteja na temperatura de nitrogênio líquido.
- Pesquise sôbre aplicações do nitrogênio líquido em diferentes setores da sociedade. Cite as propriedades do nitrogênio líquido que são aproveitadas nessas aplicações.

INTERPRETAÇÃO DE RESULTADOS
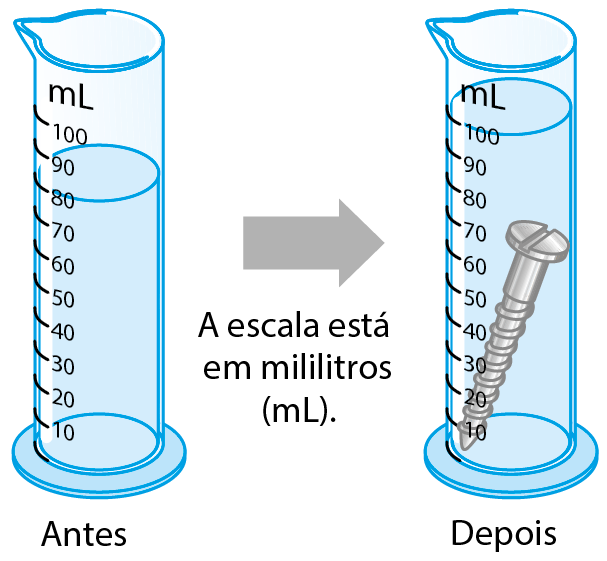
- Um estudante desejava medir o volume de um parafuso grande. Para isso, colocou água numa proveta e leu o volume. Em seguida, jogou o parafuso dentro da proveta e leu novamente o volume. Os desenhos ilustram o que ele observou.
- Qual é o volume do parafuso?
- Sabendo que a massa do parafuso é 157,4 gramas, determine a densidade do material de que ele é feito, em grama por mililitro.
FOTOGRAFIA
15. A mesma massa de um mesmo líquido (de cor alaranjada), numa mesma temperatura, foi colocada em cada um dos quatro frascos mostrados na foto.
Em qual dos frascos o volume de líquido é maior? Explique.

Respostas e comentários
3. A: –50 grau Célsius, B: 0 grau Célsius, C: 0 graus Célsius, D: 100 graus Célsius, E: 100 graus Célsius, F: 120 graus Célsius.
4. A-B, C-D e E-F.
5. B-C e D-E.
6. Sólido no trecho A-B e líquido no trecho C-D.
7. Fusão.
8. Ebulição.
9. Gasoso.
10. Temperatura de fusão da água.
11. Temperatura de ebulição da água.
12. O gráfico mostra que o trecho D-E é mais longo que o trecho B-C, ou seja, leva mais tempo para a ebulição ocorrer. Como a chama fornece calor de modo contínuo e regular, conclui-se que a amostra de água absorve mais calor na ebulição do que na fusão.
13. a) Segundo uma tabela do capítulo, o nitrogênio tem tê éfe = –210 graus Célsius e tê e = –196 graus Célsius. Assim, há nitrogênio líquido (na pressão ao nível do mar) entre –210 graus Célsius e –196 graus Célsius.
b) Não.
c) Podemos esperar que os estudantes citem as aplicações do poder refrigerante do nitrogênio líquido, como em equipamentos hospitalares e laboratoriais.
14. a) O volume do parafuso é 20 mililitros, que corresponde a quanto o nível da água subiu.
b) Dividindo a massa pelo volume, temos:
Densidade é igual a 157,4 gramas sobre 20 mililitros
= 7,87 gramas por mililitro
15. Espera-se que os estudantes, com base no fato de serem massas iguais de um mesmo líquido a uma mesma temperatura, concluam que o volume de todas as amostras é igual, apesar de a fórma adquirida por elas ser diferente. Essa atividade permite comentar que as indicações de volume existentes em béqueres e erlenmeyers são grosseiras. Já as das provetas são menos imprecisas.
tê cê tê Ciência e Tecnologia
A atividade 13 do Explore diferentes linguagens insere-se no tema Ciência e Tecnologia, da macroárea de mesmo nome. Por meio dela, os estudantes conhecerão a importância do nitrogênio líquido em diversos setores de ciência aplicada que requerem conservar amostras biológicas por longos períodos.
CHARGE
- A charge mostra um navio petroleiro afundando, com vazamento de petróleo no mar.
- Use o conceito de densidade para explicar por que o navio flutua se o seu casco estiver intacto, mas afunda caso ele sofra rompimento.
- A densidade do petróleo é menor que a da água do mar. Dessa informação, pode-se deduzir que existe um ERRO CIENTÍFICO na ilustração. Explique que erro é esse.

CENA DE FILME
- Uma cena de filme mostra um ladrão colocar dez barras de ouro, de volume 1 litro cada (equiparável ao de uma embalagem de leite longa vida), dentro de um saco de pano e, a seguir, sair correndo do local do crime. Considerando que a densidade do ouro é 19,3 gramas por mililitro e que 1 litro = 1.000 mililitros, responda:
- Qual é a massa do ouro roubado?
- Admitindo que o saco de pano aguente, seria possível o ladrão correr com o que roubou?

TIRINHA

- O humorista explora o duplo sentido da palavra solução. Explique os significados dessa palavra no linguajar diário e na terminologia química.
- Que característica a mistura líquida mencionada deve ter para que ela possa ser considerada uma solução no sentido químico do termo?
Seu aprendizado não termina aqui
Peça a pessoas que estejam habituadas com trabalhos na cozinha que mostrem a você os métodos que utilizam para separar “coisas que estejam misturadas”. A seguir, compare esses métodos com as técnicas de separação de misturas estudadas neste capítulo.
Respostas e comentários
16. a) A densidade do conjunto formado pelo navio e pelo seu conteúdo (carga, ar etcétera) é menor do que a da água, por isso ele flutua. O rompimento permite a entrada de água e isso faz a densidade do conjunto passar a ser maior que a da água.
b) Como o petróleo é menos denso que a água, ele não afunda na água, e sim flutua.
17. a) Se cada 1 mililitro de ouro tem massa 19,3 gramas, então .1000 mililitros (1 litro) tem massa .19300 gramas, ou seja, 19,3 quilogramas. Assim, as dez barras terão massa de 193 quilogramas.
b) Não, o ouro seria muito pesado para ser carregado, ainda que o ladrão não corresse.
18. No linguajar diário, solução é aquilo que resolve uma situação, um problema ou uma dificuldade, é a resposta a uma pergunta. Na terminologia química, denomina-se solução uma mistura homogênea, ou seja, uma mistura que tem uma só fase.
19. Deve ter as mesmas propriedades em toda a sua extensão, isto é, deve apresentar uma só fase.
De ôlho na Bê êne cê cê!
A atividade 16 do Explore diferentes linguagens promove argumentar com base em fatos, dados e informações confiáveis, para formular conclusões referentes a uma situação que envolve consciência socioambiental (competência geral 7 e competência específica 5), bem como analisar, compreender e explicar fenômenos, exercitando a curiosidade para buscar respostas com base em conhecimentos das Ciências da Natureza (competência específica 3).
A seção Seu aprendizado não termina aqui, por sua vez, favorece exercitar a empatia, o diálogo e a cooperação, fazendo-se respeitar e promovendo o respeito ao outro, com acolhimento e valorização da diversidade de indivíduos, seus saberes, identidades, culturas e potencialidades, sem preconceitos de qualquer natureza (competência geral 9), continuar aprendendo, compreender a aplicação de conceitos fundamentais das Ciências da Natureza, bem como dominar processos envolvidos na atividade científica, de modo a sentir segurança no debate de questões científicas, tecnológicas e do mundo do trabalho (no caso, referentes à atividade culinária) (competência específica 2).