
CAPÍTULO 3 Ondas eletromagnéticas e modelo atômico de Bór

Motivação
A critério do professor, esta atividade poderá ser realizada em grupos.

Objetivo

Averiguar se descargas elétricas interferem na recepção do sinal das emissoras de rádio ei ém.
Você vai precisar de:
- um rádio ei ém com antena
- uma pilha de 1,5 vôlti
- fita adesiva
- uma sala que possa ser totalmente escurecida
- dois pedaços de fio elétrico fino com as extremidades desencapadas (PEÇA A UM ADULTO que as desencape)
Procedimento
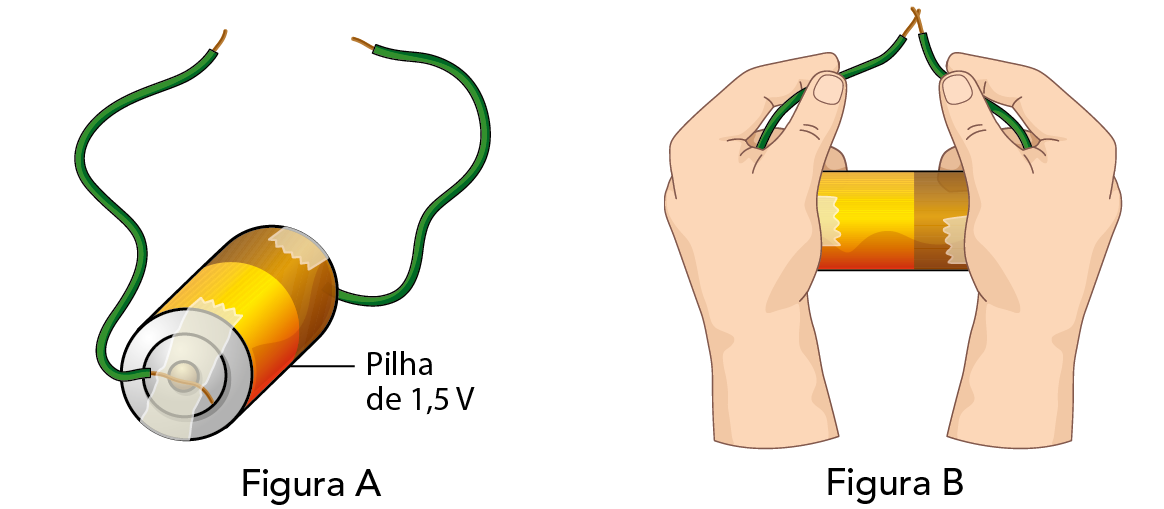
- Grude, com fita adesiva, uma das extremidades de um fio no polo positivo da pilha e uma das extremidades do outro fio no polo negativo, como mostra a figura A.
- Segure os fios pela parte encapada. Escureça a sala. Raspe repetidas vezes as extremidades soltas dos dois fios, como na figura B. Nessa etapa do experimento você deve ter constatado que, ao raspá-las, ocorreu um leve faiscamento. Clareie a sala.
- Ligue o rádio e sintonize uma emissora ei ém.
- Segure a pilha próximo à antena e volte a raspar repetidas vezes as extremidades dos fios. O que acontece com a qualidade da recepção da emissora quando as extremidades são raspadas? Como explicar o observado?
- Ao final, remova os fios para que suas extremidades não permaneçam encostadas, o que descarregaria a pilha.
Desenvolvimento do tema
1. Ondas
Ondas em uma corda
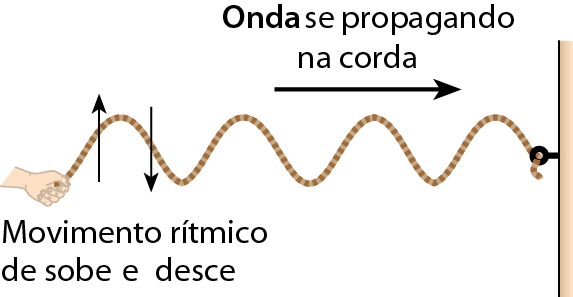
Considere uma corda esticada, com uma de suas extremidades presa a uma parede e a outra segurada por uma pessoa. Se a pessoa realizar um movimento rítmico de sobe e desce com a mão, fará com que uma onda se propague na corda esticada, como mostra o esquema.
O conceito de onda
Ondas são perturbações regulares que se propagam, mas não transportam matéria. As ondas apenas transportam energia. A Ondulatória é a parte da Física que estuda as ondas e os fenômenos relacionados a elas.
Fonte: , V. J.; , D. J. Inquiry into Physics. oitava edição Boston: Cengage, 2018. página 215.
Ondas apresentam efeitos detectáveis
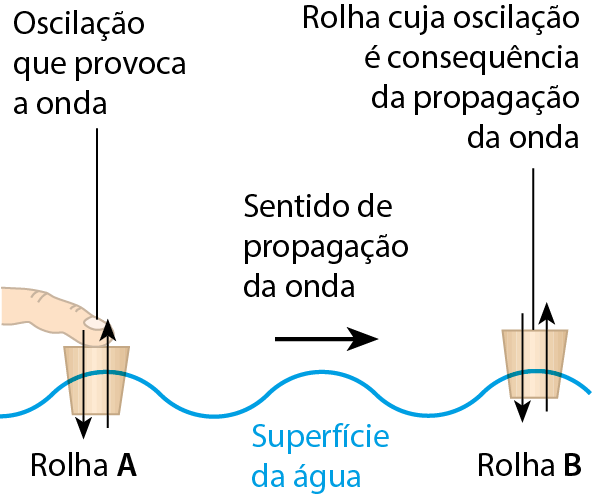
Considere duas rolhas de cortiça, A e B, flutuando na superfície parada da água, a certa distância uma da outra. Utilizando o dedo para fazer com que a rolha A realize um movimento de sobe e desce, a água, inicialmente parada, também começará a oscilar. Aparece uma onda na superfície da água. E a outra rolha, B, que estava inicialmente parada, também passa a oscilar num movimento de sobe e desce. A onda transporta energia de uma rolha até a outra, colocando-a em movimento.
Se a água fosse invisível, não veríamos a onda que se propaga em sua superfície. Mas, se uma rolha flutuante começasse a oscilar, estaríamos observando uma evidência da propagação da onda.
Esse ponto é muito importante para você entender o que será estudado neste capítulo: mesmo que uma onda não seja vista, os seus efeitos podem ser detectados, isto é, podem ser percebidos de algum modo. Nesse exemplo, uma simples rolha funciona como um detector de ondas.
Fonte: bóu, L. êti áli. Smithsonian supersimple Physicsthe ultimate bite-size study guide Londres: Dorling Kindersley, 2021. página 113.
Frequência de uma onda
Uma das características importantes de qualquer onda é sua frequência, ou seja, o número de oscilações por unidade de tempo. A unidade mais comum usada internacionalmente para expressar a frequência de uma onda é o hertz, simbolizado por agá zê, que pode ser interpretado como uma oscilação por segundo.
Assim, por exemplo, dizer que a corda de um violino, colocada em vibração pelo músico, emite uma onda sonora de frequência 440 agá zê (lê-se 440 hertz) significa dizer que essa onda sonora produzida pelo instrumento realiza quatrocentas e quarenta oscilações a cada segundo.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• onda
• frequência
• hertz (agá zê)
2. Ondas: mecânicas versus eletromagnéticas
Ondas em cordas, ondas na superfície da água e ondas sonoras são exemplos de ondas mecânicas. Esse tipo de onda precisa de um meio material para se propagar e, portanto, não se propaga no vácuo (ausência de matéria).
Já a luz é classificada no grupo das ondas (ou radiações) eletromagnéticas, aquelas que não necessitam de um meio material para propagar-se, ou seja, aquelas que conseguem se propagar no vácuo.
Outros exemplos de ondas eletromagnéticas são o infravermelho, o ultravioleta, as ondas de rádio e de tevê, as micro-ondas, os raios X e os raios gama.
Todas as ondas eletromagnéticas possuem a mesma velocidade de propagação no vácuo: 300 mil quilômetros por segundo. Nos materiais, essa velocidade é menor, embora nos gases seja praticamente a mesma. As diversas ondas eletromagnéticas diferem quanto à frequência e, em decorrência dela, nos seus efeitos, na sua utilidade prática e no tipo de dispositivo necessário para detectá-las.
O esquema a seguir mostra o chamado espectro eletromagnético e os nomes atribuídos às várias ondas eletromagnéticas, dependendo de sua frequência.

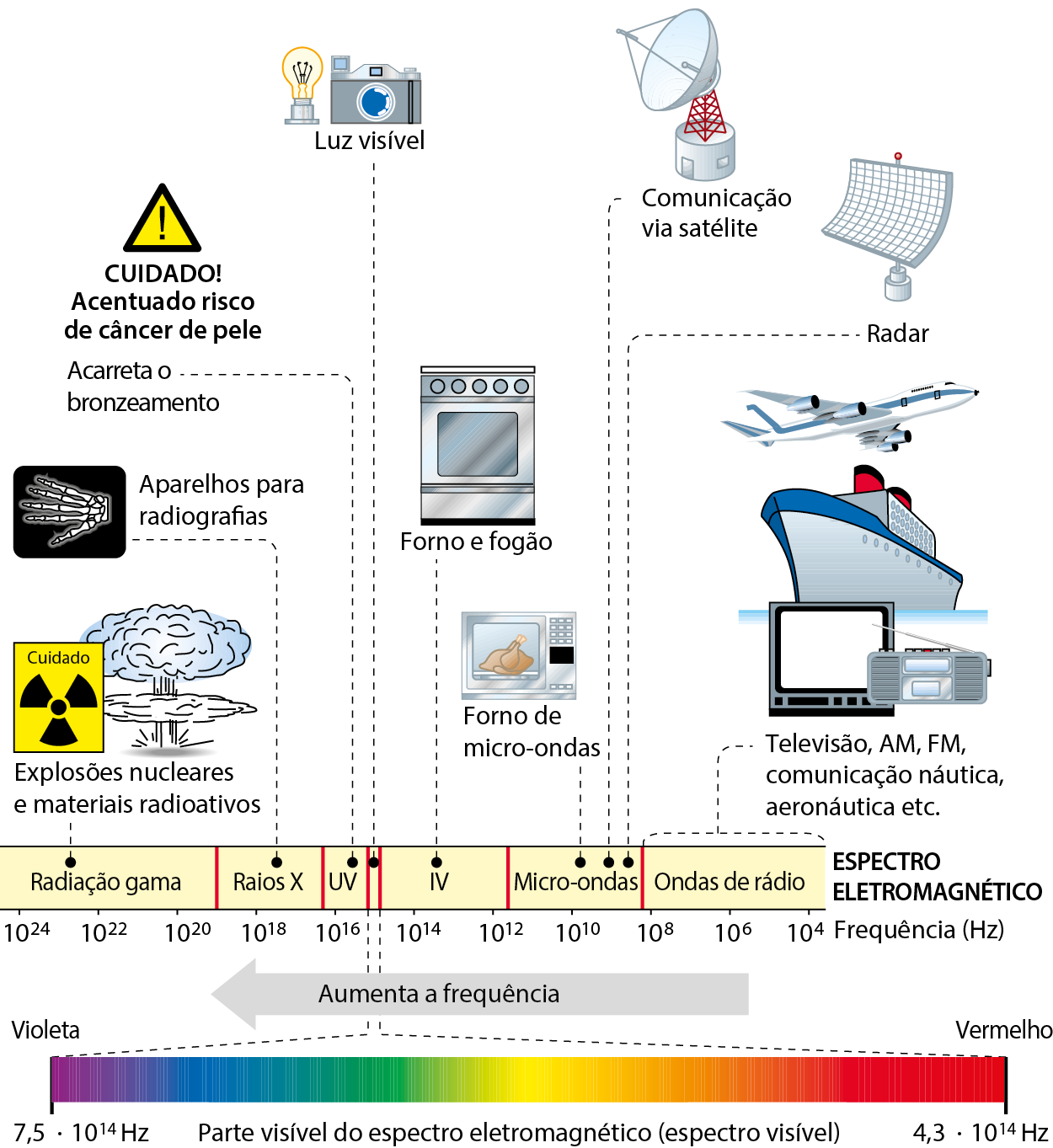
Representação esquemática fóra de proporção do espectro eletromagnético, mostrando os diferentes nomes dados às ondas eletromagnéticas dependendo da frequência (u vê indica ultravioleta, e í vê, infravermelho). Lembre-se de que significa .10000, significa ..1000000, e assim por diante.
Fonte: Figura elaborada a partir de uólquer, J. Halliday & Resnick Fundamentals of Physics. décima edição reeditada e estendida. Hoboken: John Wiley, 2018. página 973.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• onda mecânica
• onda eletromagnética

3. Características e aplicações das ondas eletromagnéticas
Rádio ei ém
As emissoras de rádio ei ém transmitem sua programação por meio de ondas eletromagnéticas de frequências entre 535 quilorrértz e .1605 quilorrértz (1 cá agá zê = 1 quilohertz = rértiz). Cada emissora tem sua frequência específica dentro dessa faixa, e quando você sintoniza a emissora está selecionando a frequência dela.

Transmissões em ei ém estão muito sujeitas a interferências de algumas outras fontes de radiações eletromagnéticas, como os fios de alta-tensão e os raios (relâmpagos).
No experimento da abertura do capítulo, ao raspar as pontas dos fios você produziu uma simulação de descarga elétrica, um raio em pequeníssima escala. E, como você provavelmente percebeu, isso já é o suficiente para causar ruídos na recepção do sinal da emissora ei ém.
Rádio éfe ême e tevê
Transmissões em éfe ême são realizadas por meio de ondas eletromagnéticas na faixa de frequências de 88 mégarrértis a 108 mégarrértis (1 ême agá zê = 1 megahertz = rértiz).
Ao contrário do ei ém, o sinal éfe ême sofre pouca ou nenhuma interferência de raios ou de fios de alta-tensão, mas tem um alcance bem menor.
As emissoras de tevê também transmitem imagem e som por meio de ondas eletromagnéticas. Cada canal de tevê tem sua própria frequência.
Os canais 2 a 6 de vê agá éfe (do inglês very high frequency) correspondem à faixa de 54 mégarrértis a 88 mégarrértis, e os canais 7 a 13, à faixa de 174 mégarrértis a 216 mégarrértis. A transmissão éfe ême é feita num intervalo de frequências entre os canais 6 e 7 de tevê. A transmissão dos canais 14 a 69 de U agá éfe (ultra high frequency) corresponde à faixa de 407 mégarrértis a 806 mégarrértis.

Telefone celular
A região coberta pela telefonia celular é dividida em áreas, chamadas células. Cada célula possui uma estação com antena, ligada à central de telefonia. Um aparelho celular comunica-se com essa estação por meio de duas ondas eletromagnéticas: uma que é enviada do aparelho para a estação, e outra, da estação para o aparelho.
Cada estação permite que um número limitado de aparelhos esteja em uso simultâneo. Por isso, em células com muitos usuários é frequente haver congestionamento do sistema.

Micro-ondas
As ondas eletromagnéticas com frequências na faixa aproximada de rértiz (1 gê agá zê = 1 gigahertz) a rértiz correspondem às micro-ondas.
Nos fornos de micro-ondas existe um transmissor que emite micro‑ondas de frequência apropriada dentro do compartimento em que o alimento é colocado. Tais ondas transferem energia para as moléculas de água do alimento. A água se aquece e, por consequência, aquece também os demais constituintes do alimento. Materiais como o vidro, a cerâmica e o plástico não são aquecidos diretamente pelo aparelho.

As micro-ondas são empregadas em transmissões via satélite (tevê, telefonia, rádio etcétera). Os aparelhos de localização por gê pê ésse recebem sinais de satélites em órbita por meio de micro-ondas. Esse tipo de onda eletromagnética também é usado nos radares, aparelhos que emitem micro-ondas e captam o retôrno dessas ondas após serem refletidas por objetos. Radares permitem avaliar a posição e/ou a velocidade de objetos como aviões, mísseis e automóveis.


EM DESTAQUE
Refletores parabólicos
Quando um feixe de ondas eletromagnéticas paralelas atinge um refletor parabólico côncavo, essas ondas são refletidas e passam todas por um mesmo ponto, denominado ponto focal do refletor.
Por causa disso, essas estruturas são muito úteis na recepção de sinais fracos emitidos de locais distantes, tais como ondas de rádio provenientes de satélites de comunicação ou ondas de luz provenientes de uma estrela. As ondas, após a reflexão, são concentradas em um único ponto e, por isso, o sinal é amplificado.
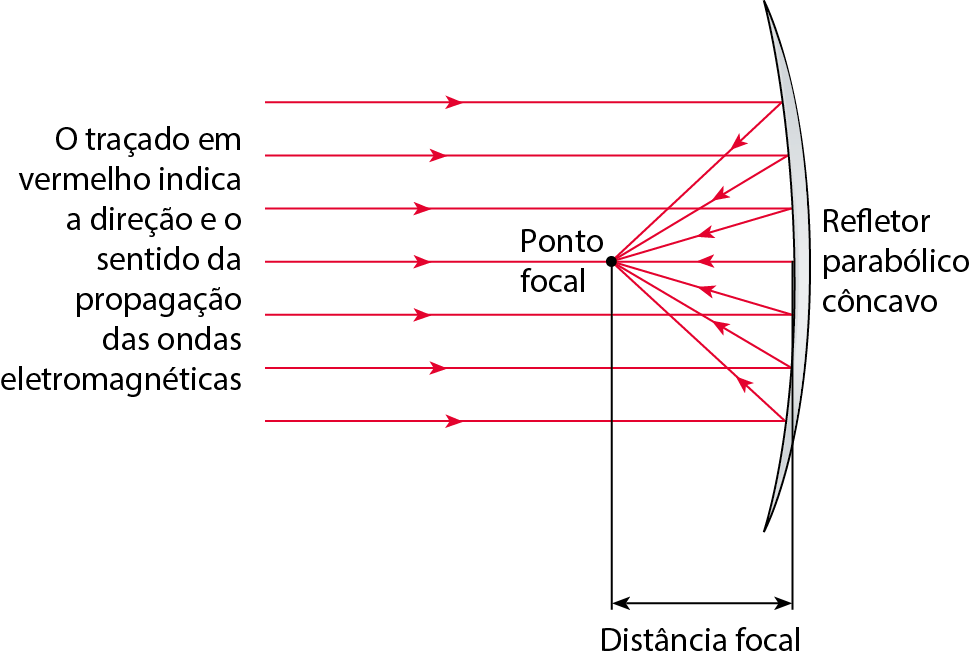
Fonte: , V. J.; , D. J. Inquiry into Physics. oitava edição Boston: Cengage, 2018. página 341.

Elaborado com dados obtidos de: iãng, D.; , S. Cutnell & Johnson Physics. décima primeira edição Hoboken: John Wiley, 2018.
Luz visível
A retina humana é capaz de perceber as ondas eletromagnéticas de frequências desde aproximadamente rértiz até cêrca de rértiz. Dentro dessa faixa, chamada espectro visível, estão todas as cores do arco-íris, que, embora muitas pessoas digam serem sete, na verdade são infinitas, já que há inúmeros tons de vermelho, de alaranjado, de amarelo etcétera
Os tons de vermelho aparecem na extremidade de frequência mais baixa do espectro visível, e o violeta aparece na extremidade de frequência mais alta.
Infravermelho
Infravermelho significa “abaixo do vermelho”. Esse nome indica que a frequência dessas ondas, não percebidas pelo ôlho humano, é inferior à frequência da luz vermelha.
O infravermelho é o responsável, por exemplo, por boa parte do transporte de calor de uma fogueira até as pessoas ao seu redor, da chama de um forno até o alimento que está assando e de um ferro de passar roupa em funcionamento até quem o está utilizando.

ATIVIDADE
Para discussão em grupo
O dispositivo conhecido como “termômetro digital sem contato” determina a temperatura corporal quando posicionado a poucos centímetros da pele. O aparelho tem um receptor que, apontado para a testa, capta a radiação infravermelha emitida pelo organismo e, a partir dela, afere a temperatura.
Com base nestas informações, que contra-argumento pode ser apresentado para refutar a fake news: “Os termômetros digitais são perigosos! Quando direcionados à testa, emitem raios que atingem a glândula pineal e causam danos a ela”.
Ultravioleta
Ultravioleta quer dizer “acima do violeta”. Tal nome indica que a frequência dessas ondas eletromagnéticas, que também não são percebidas pelo olho humano, é superior à frequência da luz violeta.
O Sol envia para a Terra, juntamente com a luz visível, ondas eletromagnéticas de outras frequências, como o infravermelho e o ultravioleta. Mais da metade das ondas ultravioleta provenientes do Sol que chegam à Terra é absorvida pelo gás ozônio presente numa camada da atmosfera situada a cêrca de 20 quilômetros a 30 quilômetros de altitude, conhecida como camada de ozônio.
Essa absorção é fundamental, pois o ultravioleta oferece consideráveis riscos a muitos organismos. No ser humano, por exemplo, a exposição prolongada ao ultravioleta pode provocar, entre outros problemas, o câncer de pele e a catarata, distúrbio que deixa a lente do ôlho (anteriormente denominada cristalino) esbranquiçada.

Raios X
Os raios X foram descobertos em 1895 pelo físico alemão (1845-1923) ao trabalhar com um aparelho que produzia descargas elétricas em gases a baixa pressão.
O próprio descobridor verificou que os diferentes tecidos do corpo humano são atravessados de modo desigual pelos raios X. Isso conduziu a uma aplicação prática em Medicina: as radiografias.
Radiografia é uma imagem produzida em um filme fotográfico por raios X que atravessaram o corpo humano. Os ossos absorvem os raios X muito melhor que outros órgãos, o que faz com que apareçam como regiões claras no filme após este ser revelado. Os músculos, ao contrário, permitem boa passagem dos raios X, e estes, chegando ao filme, produzem as regiões mais escuras vistas após a revelação.
A radiografia é importante para determinados diagnósticos médicos. Contudo, a exposição repetida aos raios X oferece riscos à saúde, como o aumento da probabilidade de câncer. Por isso, os técnicos de radiografia usam aventais de chumbo e protegem-se atrás de uma parede dêsse metal, que bloqueia a passagem de raios X.
Clique no play e acompanhe a reprodução do Áudio.
Transcrição do áudio
[LOCUTOR] O acidente radiológico em Goiânia
[Locutor] Em setembro de 1987, Goiânia foi palco de um acidente com material radioativo que provocou a contaminação de mais de mil pessoas e gerou sérias consequências econômicas, sociais e ambientais, tornando-se um dos maiores desastres desse tipo do mundo. [Locutor] A tragédia começou em 1985, quando o Instituto Goiano de Radioterapia foi desativado e abandonado. Um aparelho usado para o tratamento de câncer que empregava o césio-137 como fonte de radiação foi deixado no local onde funcionava o Instituto. [Locutor] Em 13 de setembro de 1987, dois coletores de material reciclável encontraram o aparelho e o levaram para casa, antes de vender suas peças ao ferro-velho. Ao desmontarem o equipamento, a cápsula de chumbo que continha o material radioativo foi rompida, liberando cloreto de césio-137, um pó branco com brilho azulado. O componente brilhante despertou a curiosidade de vizinhos, amigos e parentes e se espalhou por vários locais, propagando a contaminação pela população da região. [Locutor] Nenhuma das pessoas expostas ao material radioativo conhecia os riscos que ele oferecia. Entre outros efeitos biológicos, a radiação é capaz de causar a quebra de ligações químicas em moléculas biológicas, como a do DNA, podendo assim provocar mutações no material genético e a morte celular. [Locutor] Os efeitos podem ser imediatos ou tardios e dependem da dose de radiação absorvida pelo organismo, do tempo de exposição ao material, do tipo de célula ou tecido exposto e da reação de cada organismo. Doses baixas de radiação apresentam possibilidades de efeitos tardios, como o desenvolvimento de algum tipo de câncer. [Locutor] Aqui cabe um parêntese: como a radiação, que pode ter efeitos tão nocivos ao organismo, é empregada no tratamento de câncer? A radioterapia baseia-se no fato de que algumas células tumorais apresentam maior sensibilidade à radiação do que as células saudáveis. Assim, com a incidência de níveis controlados de radiação sobre o tumor, o tratamento radioterápico busca a morte das células tumorais e a preservação das células saudáveis. [Locutor] Entre 30 de setembro e 20 de outubro de 1987, a Comissão Nacional de Energia Nuclear constatou que cerca de 250 pessoas estavam contaminadas pela irradiação do césio-137. Nesse grupo, 129 tinham rastros da substância dentro e fora do organismo. Foram hospitalizadas, naquela ocasião, 49 pessoas, das quais 20 necessitaram de cuidados médicos intensivos. Quatro vítimas morreram no período de quatro semanas. [Locutor] Além das pessoas que tiveram contato direto com a substância, foram expostos à radiação os profissionais da saúde que trataram das vítimas, bombeiros, policiais militares e outros profissionais que trabalharam na segurança, na descontaminação e na remoção dos resíduos contaminados. [Locutor] O material contaminado, que incluía roupas, objetos e até mesmo pedaços de construções e o solo, foi selado em tambores e caixas que foram então lacrados em contêineres. Esses contêineres foram levados para um depósito de lixo radioativo provisório e, por fim, para um depósito definitivo, construído dentro de um parque na cidade de Abadia de Goiás, a 20 quilômetros de distância de Goiânia. O depósito continua sendo monitorado, porque o material ainda emite radiação, e, segundo estudos científicos, essa emissão cessará apenas em meados do ano de 2187. [Locutor] A importância da segurança no uso, manuseio, manutenção e descarte de materiais radioativos, para a segurança e preservação de seres vivos e do meio ambiente, foi sem dúvida um dos grandes aprendizados após o acidente.
Raios gama
Os raios gama possuem frequência superior aos raios X e são ainda mais penetrantes e perigosos. Eles são produzidos por alguns materiais radioativos.
Nas explosões nucleares são emitidas enormes doses de raios gama. Nas usinas nucleares, processos envolvendo o núcleo dos átomos também produzem esses raios. Nesse caso, a radiação é retida por blindagens especialmente construídas para isso.
Os raios gama são usados, de modo controlado, sob indicação e supervisão médica, em uma técnica chamada radioterapia. Ela permite tratar pacientes com câncer em determinados estágios da doença. Nessa técnica, os raios gama são dirigidos para o local do tumor e matam células cancerosas.




ATIVIDADE
Tema para pesquisa
Você conhece a área do conhecimento chamada Física Médica? Pesquise a atuação dos profissionais dessa área, bem como quais universidades brasileiras oferecem esse curso.
4. Modelo atômico de Bór
Espectros atômicos
Se a luz solar ou a de uma lâmpada de filamento incandescente (aquelas que, no passado, foram largamente empregadas em residências) atravessar um prisma, ela será decomposta em várias cores, que são popularmente conhecidas como arco-íris. Cientificamente, o que se obtém é chamado de espectro da luz visível.
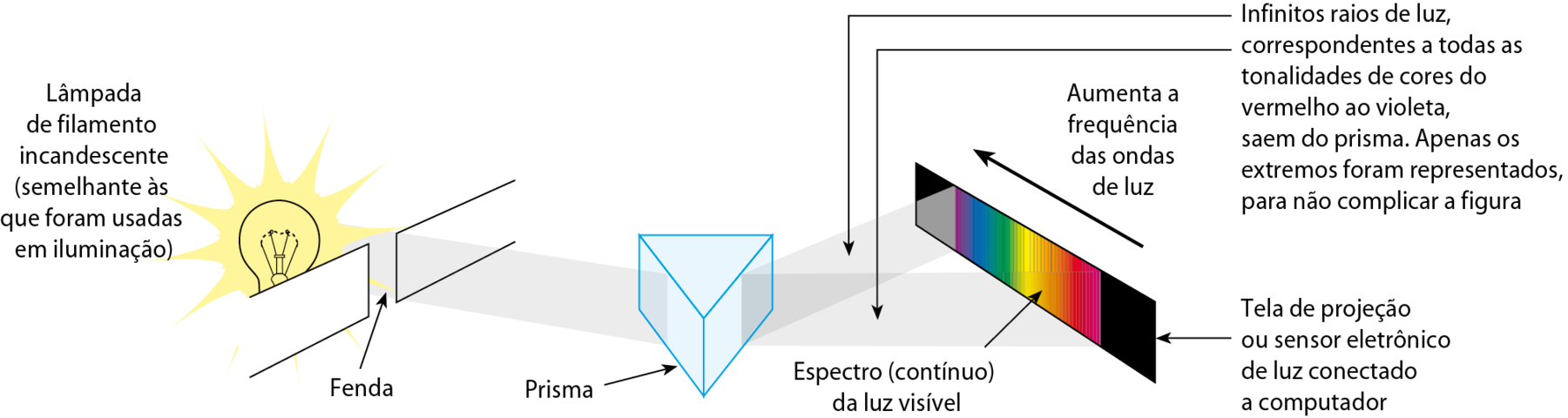
Fonte: iãng, H. D.; FREEDMAN, R. A. University Physics. décima quinta edição Harlow: Pearson, 2020. página .1116.
Se esse experimento for repetido utilizando a luz proveniente de uma lâmpada de gás (similar às lâmpadas fluorescentes, mas sem a pintura branca no vidro que a envolve), não obteremos o espectro completo. Apenas algumas linhas estarão presentes, correspondendo somente a algumas frequências das ondas de luz visível. Essas linhas formam o espectro de linhas ou espectro atômico.

Fonte: róbinsson, J. K.; , J. E.; , R. C. Chemistry. oitava edição Hoboken: Pearson, 2020. página 170.
Alguns exemplos de espectros atômicos são representados na figura a seguir.

Fonte: , J. Chemistry. quinta edição Nova iórqueMcGraw-Hill, 2020. página 243.
Postulados do modelo atômico de Bór
O modelo atômico de Bór, uma proposta para explicar o espectro de linhas de elementos químicos, foi desenvolvido pelo dinamarquês Bór (1885-1962), em 1913. Para elaboração de seu modelo atômico, o cientista propôs alguns postulados (afirmações consideradas verdadeiras sem demonstração, pontos de partida para um raciocínio). Entre esses postulados estão os seguintes:
- Os elétrons nos átomos movimentam-se ao redor do núcleo em trajetórias circulares (chamadas de camadas, ou níveis, e designadas por K, L, M, N etcétera; a camada mais próxima do núcleo é designada pela letra K, e assim sucessivamente).
- Cada um dêsses níveis tem um valor determinado de energia. (Por isso, são também denominados níveis de energia.)
- Não é permitido a um elétron permanecer entre dois níveis.
- Um elétron pode passar de um nível para outro de maior energia, desde que absorva energia externa (ultravioleta, luz visível, infravermelho etcétera). Quando isso acontece, dizemos que o elétron foi excitado ou que ocorreu uma transição eletrônica para um nível de maior energia (veja o esquema A).
- Um elétron excitado pode sofrer transição eletrônica de retôrno ao nível inicial. Nesse caso, há liberação de energia, por exemplo, como luz visível ou ultravioleta (esquema B).
Uma novidade dêsse modelo é que a energia dos elétrons é quantizada, ou seja, apresenta apenas determinados valores.
Utilizando o modelo de Bór, podem-se explicar os espectros atômicos (esquema C). Os elétrons são excitados pela energia elétrica, na lâmpada de gás. Em seguida, ao retornarem aos níveis de menor energia, liberam energia na fórma de luz. Como a cor da luz emitida depende da diferença de energia entre os níveis envolvidos na transição e como essa diferença varia de elemento para elemento, a luz apresentará cor característica para cada elemento.

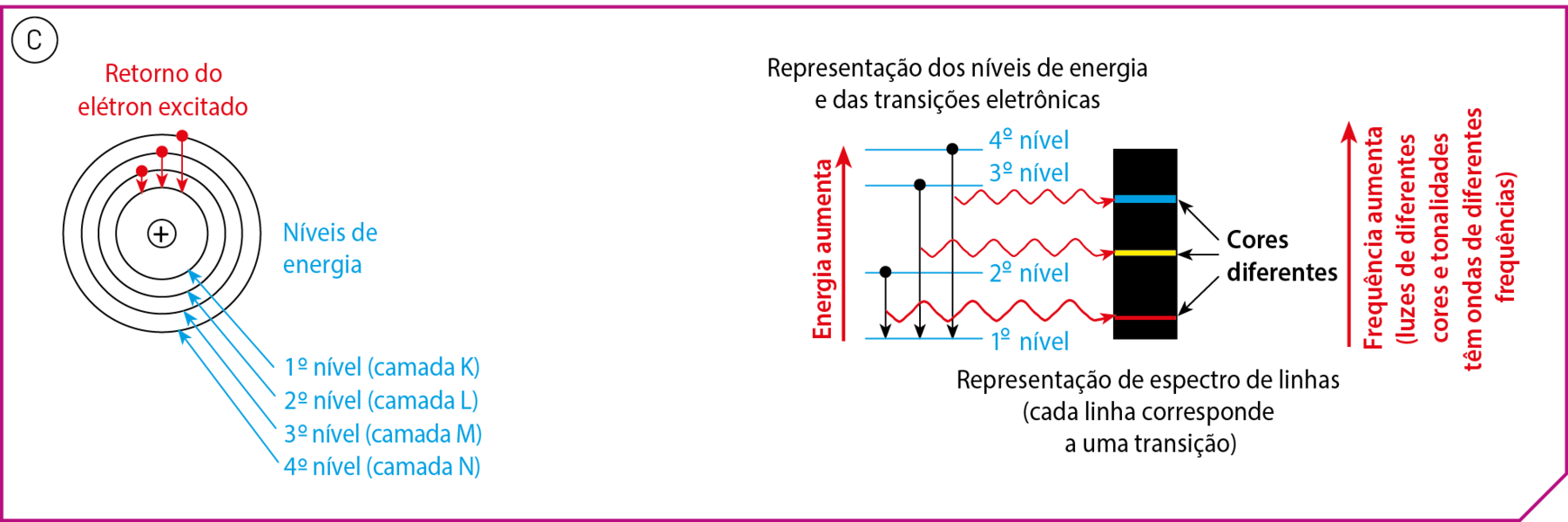
Fontes: Esquemas A, B e C elaborados a partir de uólquer, J. Halliday & Resnick Fundamentals of Physics. décima edição reeditada e estendida. Hoboken: John Wiley, 2018. página .1207; Silberberg; M. S.; AMATEIS; P. G. Chemistry: the molecular nature of matter and change. oitava edição Nova iórqueMcGraw-Hill. 2018. página 305.
5. Algumas aplicações do modelo de Bór
O teste da chama
O procedimento que comentaremos a seguir é conhecido como teste da chama. Ele teve importância histórica como um dos métodos empregados na detecção de certos elementos metálicos em amostras de minerais. Devido aos riscos potenciais envolvidos, NÃO deve ser realizado pelos estudantes!
Na ponta (curvada em fórma de pequeno círculo) de um fio feito de níquel e crômio (metais que não interferem no resultado do experimento), coloca-se uma pequena amostra de cloreto de sódio (êne áCl) e leva-se à chama de um bico de Bansen, segurando-o com um pregador de madeira ou fixado a um bastão de vidro para não queimar os dedos. Isso está mostrado na foto A.
A observação que se faz é que a chama, inicialmente azul bem clara, quase transparente, adquire uma intensa coloração amarela. Repetindo-se esse procedimento, porém utilizando brometo de sódio (êne áBr) ou iodeto de sódio (êne áI), também se observa que a chama adquire coloração amarela.
Como esse fio, levado à chama sem a presença do composto, não produz coloração na chama, isso parece indicar que o sódio deve ser o responsável pela coloração.
De fato, ao repetir esse procedimento com compostos de alguns outros elementos metálicos, percebe-se que cada um deles produz uma cor característica ao ser submetido à chama. Algumas dessas cores estão relacionadas na tabela que traz as cores emitidas pelos átomos de alguns elementos no teste da chama.
A cor no teste da chama é uma característica do elemento metálico presente no composto analisado.

|
Elemento |
Cor |
|---|---|
|
Sódio |
Amarelo |
|
Potássio |
Violeta |
|
Cálcio |
Vermelho-tijolo |
|
Estrôncio |
Vermelho-carmim |
|
Bário |
Verde-amarelado |
|
Cobre |
Verde-azulado |
Fontes: , D. D.; , S. D. General Chemistry. décima primeira edição Boston: Cengage, 2017. página 216; , N. J. Principles of Chemistry: a molecular approach. quarta edição Harlow: Pearson, 2021. página 367.
Explicação da luz emitida no teste da chama
Quando os átomos de um elemento são colocados na chama, o calor excita alguns elétrons, isto é, faz com que passem para níveis de maior energia. Ao voltarem aos níveis iniciais, liberam energia na fórma de luz de várias cores, que são características dos átomos de cada elemento; são as cores que aparecem no espectro atômico do elemento. A mistura dessas cores, emitidas simultaneamente por diversos átomos, resulta na cor vista no teste da chama.


Fogos de artifício
Quando os fabricantes desejam produzir fogos de artifício coloridos, eles misturam à pólvora compostos de certos elementos químicos apropriados.
Para obter a cor amarela, por exemplo, adicionam sódio. Para conseguir o vermelho-carmim, colocam estrôncio. Quando querem o verde-azulado, usam cobre. Desejando o verde, empregam bário.
A cor que um elemento dá aos fogos de artifício é a mesma que ele tem no teste da chama. No momento em que a pólvora explode, a energia liberada na explosão excita os elétrons dêsses átomos. Quando retornam aos níveis de menor energia, liberam luz colorida: exatamente a cor que seria vista no teste da chama.
ATENÇÃO!
NUNCA caia na tentação de manipular fogos de artifício. Acidentes sérios, com queimaduras e até morte, atestam o risco que é manuseá-los.


Luminosos e lâmpadas de gás
Os luminosos de neônio e as lâmpadas de vapor de sódio ou mercúrio são dispositivos de funcionamento similar. Neles, há uma substância em fase gasosa (gás neônio, vapor de sódio e vapor de mercúrio, respectivamente), cujos elétrons são excitados pela energia elétrica. Quando esses elétrons retornam a níveis de menor energia, há a emissão de luz.
Nos luminosos de gás neônio, a luz emitida é vermelha, e, nas lâmpadas de vapor de sódio, é amarela.
Nas lâmpadas de vapor de mercúrio, também conhecidas como lâmpadas fluorescentes, há liberação de quantidade apreciável de ultravioleta, que não é visível. A pintura que reveste tais lâmpadas contém uma substância especial (denominada fluorescente), que absorve o ultravioleta e reemite luz branca, visível.




Teclas e ponteiros fosforescentes
Alguns materiais, quando absorvem ultravioleta ou outras variedades de ondas eletromagnéticas, emitem luz visível. Esse fenômeno é chamado genericamente de luminescência.
Quando a emissão ocorre imediatamente após a absorção, o fenômeno é chamado de fluorescência. Se, por outro lado, a emissão demorar alguns segundos ou até mesmo algumas horas, é denominado fosforescência. As teclas de interruptores e os ponteiros de relógio que brilham no escuro são feitos de materiais fosforescentes. Alguns elétrons são excitados quando esses materiais estão iluminados e, gradualmente, retornam à situação inicial, emitindo luminosidade. Por isso, quando apagamos as luzes, permanecem visíveis durante algum tempo.

6. Distribuição eletrônica nas camadas
Distribuição eletrônica do hidrogênio ao argônio
Cada uma das camadas eletrônicas pode comportar um diferente número máximo de elétrons. Por exemplo, a primeira das camadas comporta no máximo 2 elétrons, a segunda, no máximo 8, e a terceira, no máximo 18.
Existe uma tendência de os elétrons ocuparem camadas de energia mais baixa. Quando os elétrons estão na situação de menor energia possível, dizemos que o átomo está em seu estado fundamental.
Usando técnicas experimentais adequadas, os cientistas determinaram a distribuição eletrônica em camadas para os átomos dos elementos químicos, ou seja, quantos elétrons há em cada um dos níveis da eletrosfera dos átomos (eletricamente neutros e no estado fundamental). A seguir, veja a distribuição eletrônica dos átomos de hidrogênio (Z = 1) até argônio (Z = 18).

Fonte: bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova iórquePearson, 2022. página 313.
O átomo de hidrogênio (Z = 1) apresenta 1 próton e 1 elétron. Esse elétron situa-se na primeira camada. No caso do hélio (Z = 2), há dois prótons no núcleo e 2 elétrons na primeira camada. (Os nêutrons presentes situam-se sempre no núcleo, junto com os prótons.)
O átomo de lítio (Z = 3) tem 3 prótons no núcleo e 3 elétrons na eletrosfera, dos quais dois ocupam a primeira camada, preenchendo-a, e o terceiro ocupa a segunda camada. À medida que percorremos a tabela periódica, a cada aumento de uma unidade no número atômico, tem-se aumento de 1 próton no núcleo e de 1 elétron na eletrosfera. Esse elétron adicional tende a ocupar a camada de menor energia que ainda tenha capacidade para comportá-lo. Quando uma camada está preenchida, o elétron adicional ocupa uma nova camada.
Esse raciocínio se aplica bem aos primeiros elementos, até o argônio. A partir daí, observa-se que alguns elétrons ocupam uma camada mais externa, mesmo que a anterior não esteja totalmente preenchida. Isso é explicado por um modelo mais avançado, o modelo de subníveis, que pode ser estudado no Ensino Médio e na Universidade.
Distribuições eletrônicas:
: K–1
₂agá ê: K–2
₃éle i: K–2 L–1
₄bê ê: K–2 L–2
bit: K–2 L–3
centésimo: K–2 L–4
: K–2 L–5
: K–2 L–6
éfe: K–2 L–7
₁₀êne ê: K–2 L–8
₁₁êne á: K–2 L–8 M–1
: K–2 L–8 M–2
etcétera
Distribuição eletrônica dos elementos representativos
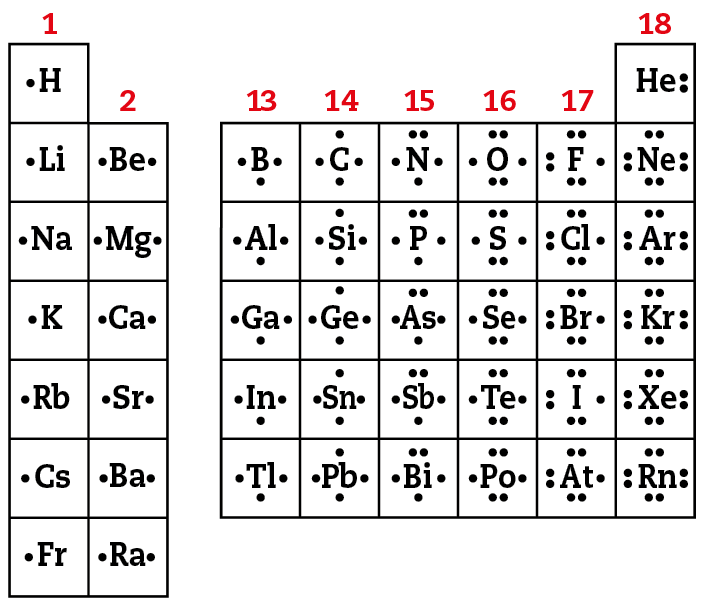
O esquema a seguir apresenta a distribuição eletrônica de diversos elementos representativos (grupos 1, 2 e de 13 a 18).
Analise o esquema com atenção. As informações nele contidas serão bastante úteis para evidenciar que existe uma relação entre a distribuição eletrônica de um elemento e sua posição na tabela periódica, ou seja, seu período (linha, horizontal) e seu grupo (coluna, vertical).


Fonte: bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova iórquePearson, 2022. página 313.
7. Distribuição eletrônica e tabela periódica
Número de camadas eletrônicas e período do elemento
Analisando os dados do esquema anterior, é possível perceber que os elementos do primeiro período (agá e agá ê) apresentam átomos com uma camada eletrônica, elementos do segundo período (éle i, bêê, bê, cê, êne, óh, éfe e êne ê) apresentam átomos com duas camadas e assim sucessivamente até os elementos do sétimo período, cujos átomos têm sete camadas.
Concluímos, portanto, que elementos de um mesmo período apresentam átomos com igual número de camadas eletrônicas. Além disso, o número de camadas eletrônicas com elétrons é igual ao número do período do elemento na tabela periódica.
Camada de valência e grupo do elemento
Pelos dados do esquema reproduzido anteriormente, também é possível perceber que os átomos de elementos de um mesmo grupo (família) apresentam em comum o número de elétrons na última camada.
Os átomos de elementos do grupo 1 apresentam 1 elétron na última camada. A diferença entre a eletrosfera de seus átomos está no número de camadas. O átomo de agá (primeiro período) tem uma camada, o de éle i (segundo período) duas camadas, o de êne á (terceiro período) três camadas etcétera
Os átomos de elementos do grupo 2 têm 2 elétrons na última camada, os do grupo 13 têm 3 elétrons na última camada, os do grupo 14 têm 4 elétrons e assim por diante.
A camada mais externa do átomo de um elemento químico é aquela envolvida diretamente no estabelecimento de união com . Ela é denominada camada de valência e os elétrons dessa camada são chamados de elétrons de valência.
Elementos de um mesmo grupo (mesma família) da tabela periódica têm o mesmo número de elétrons na camada de valência.
Exceção a isso é o elemento hélio (zê = 2). Seus átomos apresentam 2 elétrons na camada de valência, mas ele não é colocado no grupo 2. Suas propriedades não se assemelham às dos elementos daquele grupo, mas sim às dos gases nobres (êne ê, á érre, , xis ê, ). Por isso, o hélio é considerado gás nobre e é incluído no grupo 18 da tabela periódica.
Fonte: Xâng, R.; , K. A. Chemistry. edição Nova iórque: McGraw-Hill, 2019. página 368.
Organização de ideias
MAPA CONCEITUAL

Atividades
Use o que aprendeu
- Faça uma lista das utilidades das ondas eletromagnéticas em seu dia a dia. Confronte-a com a de seus colegas e, a seguir, responda: a humanidade teria a mesma qualidade de vida se não utilizasse as tecnologias associadas às ondas eletromagnéticas? Justifique sua opinião.
- Na sua opinião, qual dos tipos de onda eletromagnética é o mais útil para você em seu dia a dia? Por quê?
- Os raios X não são úteis apenas em Medicina. Pesquise e responda qual é a utilidade dos raios X:
- na segurança de aeroportos;
- na indústria.
- Em algumas cidades brasileiras existem sensores no pavimento das ruas, espaçados a intervalos predeterminados, que, pressionados sucessivamente pelas rodas de um veículo, permitem avaliar a velocidade dele e, se estiver acima do permitido, fotografá-lo. Algumas pessoas chamam esse dispositivo de “radar”.
Explique por que essa denominação não está correta.
- Boa parte dos satélites usados em comunicação são geoestacionários, ou seja, orbitam ao redor da Terra completando uma volta a cada 24 horas, o que faz com que estejam em órbita sempre sôbre uma mesma região. Explique por que é conveniente que um satélite usado em comunicações seja geoestacionário.
- Pesquise em que época viveu e qual foi sua contribuição para a humanidade. Como o trabalho de outros cientistas possibilitou essa contribuição? Elabore um pequeno texto explicando que o conhecimento científico é uma produção coletiva. Use argumentos válidos que façam parte de seus conhecimentos e/ou que você tenha pesquisado em fontes confiáveis de informação.
- O rubídio é um metal alcalino que se encontra no quinto período da tabela periódica. Sem consultar a tabela, é possível dizer quantas camadas eletrônicas apresenta um átomo dêsse elemento e quantos elétrons há em sua camada de valência? Justifique sua resposta.
- O chumbo é o elemento do sexto período, grupo 14. Sem consultar a tabela periódica, é possível prever quantos elétrons há na camada de valência de um átomo de chumbo? Explique.
- Dois dos elementos químicos representativos muito importantes para a saúde óssea têm as seguintes características: um deles apresenta átomos com quatro camadas eletrônicas e dois elétrons na última delas; os átomos do outro têm três camadas eletrônicas e cinco elétrons na última camada.
- Você consegue prever o período e o grupo dêsses elementos na tabela periódica, sem consultar o esquema de distribuições eletrônicas apresentado no texto? Justifique.
- Agora, consulte a tabela periódica e diga que elementos são esses.
- Os átomos de um elemento químico presente em quantidade apreciável no corpo humano apresentam 8 prótons e 8 elétrons (além de nêutrons, é claro).
- Qual é a distribuição eletrônica nas camadas dos átomos dêsse elemento?
- A que grupo da tabela periódica ele deve pertencer?
- Os átomos de outro elemento químico presente em quantidade apreciável no corpo humano têm 6 prótons e 6 elétrons (e também nêutrons).
- Qual é a distribuição eletrônica nas camadas dos átomos dêsse elemento?
- A que grupo da tabela periódica ele deve pertencer?
Seu aprendizado não termina aqui
O efeito das ondas eletromagnéticas de diferentes frequências sobre a saúde humana é o tema de muitos estudos científicos. De vez em quando, surgem novas descobertas. Fique atento às notícias sobre esse assunto, pois ele certamente é de seu interesse.

Fechamento da unidade
Isso vai para o nosso blog!


Os elementos químicos
A critério do professor, a classe será dividida em grupos e cada um deles criará e manterá um blog na internet sôbre a importância do que se aprende em Ciências da Natureza. Nesta atividade, a meta é selecionar informações (acessar, reunir, ler, analisar, debater e escolher as mais relevantes e confiáveis) relacionadas aos tópicos a seguir para incluir no blog.
