UNIDADE A

CAPÍTULO 1 Reações químicas e Teoria Atômica de Dalton

Respostas e comentários
Este capítulo e seus conteúdos conceituais
- Retomada de temperatura de fusão, temperatura de ebulição e densidade, algumas das propriedades que caracterizam substâncias
- Distinção entre substância e mistura de substâncias
- Transformação química
- Reagentes e produtos
- Lei de lavoziêr
- Lei de prust
- Teoria Atômica de Dalton
- Elementos químicos e seus símbolos versus substâncias químicas e suas fórmulas
- Equação química
Nesta unidade, os estudantes conhecerão alguns modelos atômicos e o conceito de elemento químico. Diversas das habilidades da unidade temática Matéria e energia da Bê êne cê cê, referentes ao 9º ano, têm seu desenvolvimento vinculado a esta unidade, sendo que o trabalho com algumas delas prossegue na unidade B.
Este capítulo se inicia com a retomada de alguns conceitos trabalhados no volume do 6º ano, de modo a propiciar a todos os estudantes, inclusive aos que porventura não estudaram esses temas anteriormente, os pré-requisitos necessários ao estudo do modelo atômico de Dalton.
A partir da conceituação macroscópica de reação química, o capítulo trabalha a Lei de lavoziêr (conservação da massa) e a Lei de prust (proporções constantes) como generalizações de fatos experimentais. O texto Em destaque do item 5 permite aos estudantes entender a diferença entre lei e teoria, possibilitando discutir, na sequência, que a Teoria Atômica de Dalton é uma proposta para explicar as leis de lavoziêr e de prust.
A seguir, o capítulo relata a composição de algumas substâncias, conduzindo à percepção de que a fórmula de uma substância expressa a sua composição, e explica a utilização de equações químicas para representar reações.
Os estudantes têm, ao final do capítulo, uma primeira aproximação ao conceito de elemento químico (no modelo de Dalton), que será aprimorado no capítulo seguinte, conduzindo à conceituação atual (na qual cada elemento químico corresponde a átomos com determinado número atômico).
De ôlho na Bê êne cê cê!
A imagem e o texto de abertura dêste capítulo contribuem para o desenvolvimento da competência específica 3, pois, assim como em outras oportunidades posteriores neste capítulo, estimulam os estudantes a analisar, compreender e explicar características, fenômenos e processos relativos ao mundo natural e social, como também as relações que se estabelecem entre eles, exercitando a curiosidade para fazer perguntas e buscar respostas com base nos conhecimentos das Ciências da Natureza.
Motivação

EM DESTAQUE
Por que estudar Química?
“A Química está no centro de muitos assuntos de interêsse público, como a melhoria de assistência médica, a conservação de recursos naturais, a proteção ao meio ambiente e o fornecimento de energia necessária para manter a sociedade funcionando. Com a Química, descobrimos e temos continuamente melhorado fármacos, fertilizantes, pesticidas, plásticos, painéis solares, Lédis e materiais de construção. Também descobrimos que algumas substâncias químicas são potencialmente prejudiciais à saúde ou ao ambiente. Isso significa que devemos nos certificar de que os materiais com os quais entramos em contato são seguros. Como cidadão e consumidor, é interessante que você entenda os efeitos, tanto positivos quanto negativos, que os produtos químicos podem ter, além de ser importante que tenha um visão equilibrada a respeito dos usos que se podem fazer deles.
reticências
Quem são os químicos e o que eles fazem? As pessoas que são graduadas em Química assumem diversas funções na indústria, no govêrno e na universidade. As que vão para a indústria trabalham em laboratórios, desenvolvendo novos produtos (pesquisa e desenvolvimento), analisando materiais (contrôle de qualidade), ou auxiliando os clientes na utilização dos produtos (vendas e serviços). Aquelas com mais experiência ou treinamento podem se tornar gerentes ou diretores. Os químicos como fôrça de trabalho científica são peças-chave em governos (institutos nacionais de saúde, departamentos de energia e agência de proteção ambiental empregam químicos) e universidades. Além disso, uma graduação em Química prepara pessoas que queiram desenvolver uma carreira em ensino, reticências pesquisa biomédica, ciência da informação, trabalhos associados ao meio ambiente, vendas técnicas, agências reguladoras governamentais e direito de patentes.
Fundamentalmente, os químicos desempenham três papéis:
(1) produzem novos tipos de matéria: materiais, substâncias ou combinações de substâncias com propriedades desejadas; (2) medem as propriedades da matéria; (3) desenvolvem modelos que explicam e/ou preveem as propriedades da matéria.Um químico, por exemplo, pode trabalhar em um laboratório, buscando descobrir novos fármacos. Outro pode concentrar-se no desenvolvimento de instrumentos que meçam as propriedades da matéria em nível atômico. Outros químicos podem, ainda, utilizar materiais e métodos existentes para entender como os poluentes se deslocam no meio ambiente ou como os medicamentos são processados no corpo. Por fim, outro químico irá desenvolver uma teoria, escrever um código computacional e executar simulações de computador que ajudarão a entender como as moléculas se movem e reagem. A empresa [empreitada, atuação] química coletiva é uma mistura rica de todas essas atividades.”
Fonte: bróun, T. L. êti áli. Química: a ciência central. décima terceira edição São Paulo: Pearson, 2016. página 5-6.


ATIVIDADE
Certifique-se de ter lido direito
Procure no dicionário qualquer palavra cujo significado não conheça.
Respostas e comentários
Motivação
Capacitar o estudante a ler e interpretar textos relacionados à ciência é uma das metas do curso de Ciências da Natureza.
Nos capítulos em que há textos de abertura na seção Motivação, é importante que eles sejam lidos em voz alta, em sala, e que cada uma de suas passagens seja comentada e explicada.
Preste atenção especial às palavras cujo significado os estudantes porventura não conheçam.
A leitura e a interpretação dos textos de outras fontes, presentes nesta obra, auxiliam os estudantes a compreender que a aquisição de informações de textos escritos requer leitura atenta, capacidade de concentração (foco) e cuidadosa interpretação.
Trata-se de conteúdo procedimental e, portanto, é a prática continuada que aprimora significativamente a capacitação do leitor.
tê cê tês Economia e Ciência e Tecnologia
O texto Em destaque no início do capítulo abrange os Temas Contemporâneos Transversais Trabalho e Ciência e Tecnologia, respectivamente pertencentes às macroáreas Economia e Ciência e Tecnologia. O texto ajuda a elucidar a relevância da Química no contexto contemporâneo e fornecer uma visão do mundo do trabalho que pode influir nas escolhas alinhadas ao projeto de vida dos estudantes.
Protagonismo da mulher
Aproveite a foto da química atuando no laboratório para enfatizar a necessidade de valorização do protagonismo da mulher nas diversas áreas de atuação social, artística e profissional. Aproveite para ressaltar a igualdade entre todas as pessoas, independentemente de fatores como sexo, religião, características individuais e condição socioeconômica, e que uma sociedade democrática e plural não pode tolerar preconceitos de nenhuma espécie.
De ôlho na Bê êne cê cê!
Ao explorar a importância da Química na sociedade e a atuação dos profissionais da área, o texto “Por que estudar Química?” favorece o desenvolvimento: da competência geral 6, pois incentiva o estudante a valorizar a diversidade de saberes e vivências culturais e apropriar-se de conhecimentos e experiências que lhe possibilitem entender as relações próprias do mundo do trabalho e fazer escolhas alinhadas ao exercício da cidadania e ao seu projeto de vida, com liberdade, autonomia, consciência crítica e responsabilidade; e da competência específica 4, porque auxilia em avaliar aplicações e implicações políticas e culturais da ciência e de suas tecnologias para propor alternativas aos desafios do mundo contemporâneo, incluindo aqueles relativos ao mundo do trabalho.
Desenvolvimento do tema
1. Recordando mudanças de fase da água
Iniciamos este capítulo revisando alguns conceitos de grande importância para o estudo de Ciências no 9º ano. Neste item, vamos relembrar as mudanças que a água pode sofrer entre as fases sólida, líquida e gasosa.
ATENÇÃO!
Por razão de segurança, para realizar qualquer experimento de Química você deve ter a AUTORIZAÇÃO e a SUPERVISÃO de seu professor.
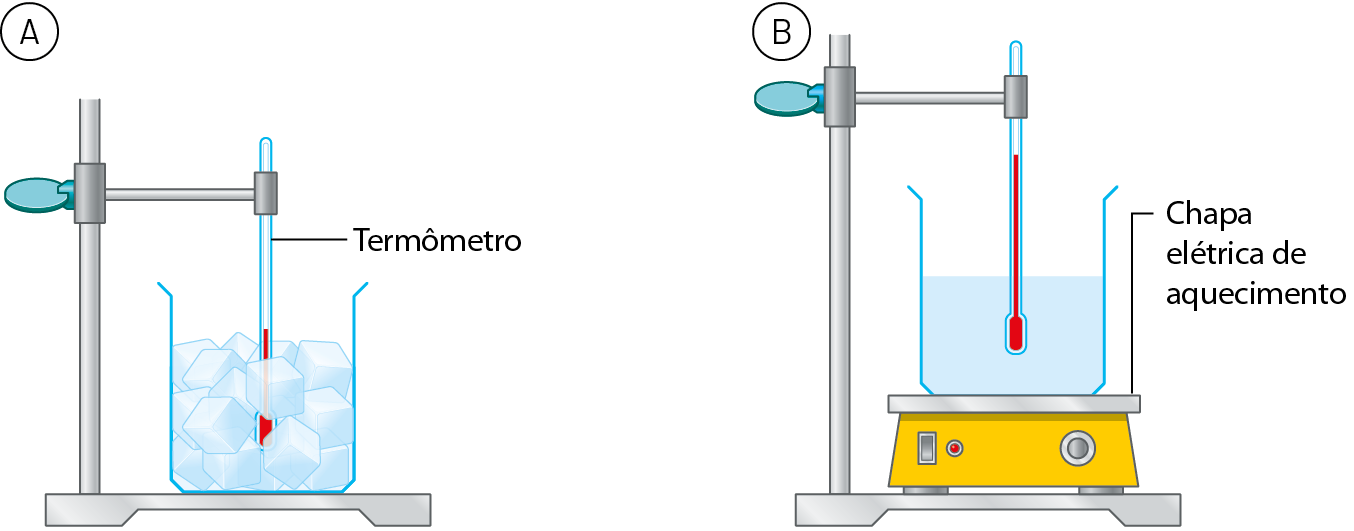
A figura A ilustra um recipiente de vidro contendo cubos de gelo que acabaram de ser retirados do freezer e estão a – 18 graus Célsius (isto é, 18 graus Célsius abaixo de zero). A sala está localizada ao nível do mar e sua temperatura é de 25 graus Célsius.
Observando atentamente a indicação do termômetro para monitorar a temperatura do conteúdo do frasco, com o passar do tempo verifica-se que ela sobe gradualmente até chegar a 0 grau Célsius. Nessa temperatura, o gelo começa a derreter e, enquanto não derrete completamente, a temperatura não se altera, permanecendo no valor constante de 0 grau Célsius. Após todo o gelo derreter, a temperatura volta a subir gradualmente até chegar a 25 graus Célsius, a mesma da sala. A partir daí, ela se mantém constante.
A seguir, em uma segunda parte do experimento, essa água líquida a 25 graus Célsius é aquecida com o auxílio da aparelhagem mostrada na figura B. Notamos que a temperatura sobe gradualmente até 100 graus Célsius, quando a água entra em ebulição. Enquanto a água permanece em ebulição, a temperatura mantém-se constante em 100 graus Célsius.
Inicialmente, a água estava na fase sólida. Posteriormente, passou para a fase líquida e, finalmente, para a fase gasosa. As mudanças de fase (também chamadas mudanças de estado de agregação) recebem nomes conforme mostra o esquema a seguir:
Esquema de mudanças de fase da água
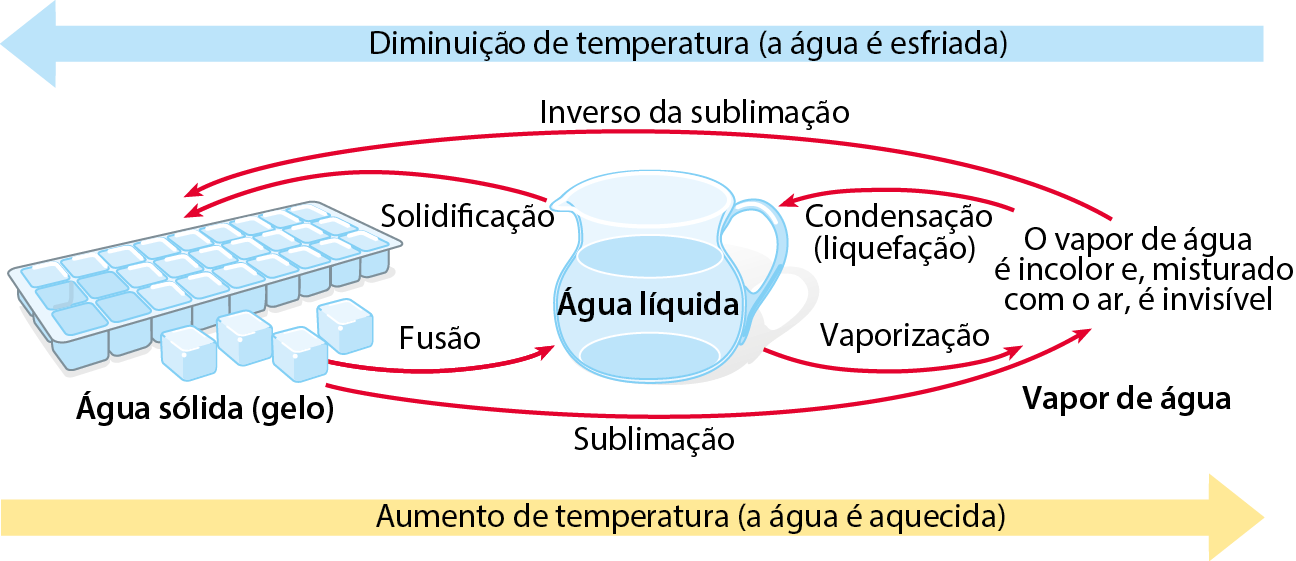
A vaporização, passagem da fase líquida para a gasosa, pode ocorrer de fórma lenta, na temperatura ambiente e sem a formação de bolhas, como no caso de uma roupa secando no varal. Nesse caso, a vaporização é denominada evaporação.
A vaporização também pode acontecer com a formação de bolhas durante o aquecimento do líquido. Nesse caso, é chamada ebulição (popularmente, fervura). A água, ao nível do mar, sofre ebulição na temperatura de 100 graus Célsius.
Respostas e comentários
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero um
“Investigar as mudanças de estado físico da matéria e explicar essas transformações com base no modelo de constituição submicroscópica.”
Essa habilidade é desenvolvida nos capítulos 1 e 4. Neste capítulo 1, os estudantes retomarão as mudanças de fase e sua nomenclatura. Isso já foi abordado no volume do 6º ano (pois era necessário para caracterizar substância química e desenvolver habilidades como ê éfe zero seis cê ih zero um,ê éfe zero seis cê ih zero dois e ê éfe zero seis cê ih um dois) e é retrabalhado integralmente aqui para que todos os estudantes tenham acesso aos pré-requisitos para o restante do desenvolvimento da habilidade ê éfe zero nove cê ih zero um, no capítulo 4.
Os estudantes perceberão, neste capítulo, que as temperaturas de fusão e de ebulição possibilitam fazer previsões sôbre a fase em que uma substância se encontra em função da temperatura (quando submetida à mesma pressão à qual se referem os dados de temperatura de fusão e de ebulição considerados).
Algumas atividades dêste capítulo envolvem situações em que os estudantes devem utilizar os conceitos adquiridos em contextos ligados a aplicações práticas (por exemplo, atividades 1 a 11 do Explore diferentes linguagens).
No capítulo 4, os aspectos submicroscópicos dessa habilidade serão desenvolvidos, e os estudantes serão capazes de usar modelos para explicar e representar mudanças de fase da matéria.
Conteúdo atitudinal sugerido
• Interessar-se pelas ideias científicas e pela Ciência como maneira de entender melhor o mundo que nos cérca.
Essa é uma atitude que se pretende desenvolver ao longo de todo o curso de Ciências e é bastante oportuna a este capítulo.
De ôlho na Bê êne cê cê!
Os itens dêste capítulo, por abordarem temas introdutórios ao estudo da Química, contribuem para o desenvolvimento: da competência geral 2, pois fornecem subsídios aos estudantes para que possam exercitar a curiosidade intelectual e recorrer à abordagem própria das ciências, incluindo a investigação, a reflexão, a análise crítica, a imaginação e a criatividade, com base nos conhecimentos das diferentes áreas; e da competência específica 2, pois ajudam a compreender conceitos fundamentais e estruturas explicativas das Ciências da Natureza, bem como dominar processos e práticas da investigação científica, de modo a sentir segurança no debate de questões científicas e do mundo do trabalho.
A temperatura de fusão (tê éfe) é uma temperatura característica na qual determinada substância sofre fusão (durante o aquecimento) ou solidificação (durante o resfriamento), a pressão constante. É também denominada ponto de fusão (pê éfe).
A temperatura de ebulição (tê e) é uma temperatura característica na qual determinada substância sofre ebulição (durante o aquecimento) ou liquefação (durante o resfriamento), a pressão constante. Também é conhecida como ponto de ebulição (pê ê).
No aquecimento ou no resfriamento de determinada substância, realizado a pressão constante, a temperatura permanece constante enquanto uma mudança de fase estiver se processando.
A temperatura de ebulição das substâncias pode variar bastante, dependendo da pressão atmosférica do local em que o experimento é realizado. A temperatura de fusão também varia, porém intensamente. A pressão atmosférica, por sua vez, se modifica sensivelmente com a altitude do local.
|
Substância |
TF |
TE |
|---|---|---|
|
Tungstênio |
3.414 |
5.555 |
|
Platina |
1.768 |
3.825 |
|
Ferro |
1.538 |
2.861 |
|
Ouro |
1.064 |
2.836 |
|
Prata |
962 |
2.162 |
|
Cloreto de sódio |
801 |
1.465 |
|
Alumínio |
660 |
2.519 |
|
Chumbo |
327 |
1.749 |
|
Enxofre |
95 |
445 |
|
Naftaleno |
80 |
218 |
|
Água |
0 |
100 |
|
Mercúrio |
‒39 |
357 |
|
Amônia |
‒78 |
‒33 |
|
Cloro |
‒102 |
‒34 |
|
Etanol |
‒114 |
78 |
|
Metano |
‒182 |
‒162 |
|
Nitrogênio |
‒210 |
‒196 |
|
Oxigênio |
‒219 |
‒183 |
|
Hidrogênio |
‒259 |
‒253 |
Fonte: HAYNES, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 3-4ésse ésse e 4-44ésse ésse.
2. Recordando densidade
A densidade de uma amostra de matéria é uma grandeza que indica a massa presente no volume ocupado por essa amostra.

A unidade da densidade é composta de uma unidade de massa dividida por uma unidade de volume, por exemplo, em grama por centímetro cúbico, grama por litro, quilograma por litro etcétera
A densidade de um mesmo material depende da temperatura. Uma mudança de temperatura provoca a dilatação (aumento de volume) ou a contração (diminuição de volume) do material, e isso interfere no valor da densidade. Alguns valores de densidade, a 25 graus Célsius, são apresentados na tabela.
As mudanças de fase provocam mudanças na densidade de uma substância. A água líquida, por exemplo, tem densidade 1 grama por centímetro cúbico, e a água sólida (gelo) tem densidade 0,92 gramas por centímetro cúbico.
|
Substância |
Densidade (g/cm3) a 25 °C |
|---|---|
|
Ósmio |
22,6 |
|
Platina |
21,5 |
|
Ouro |
19,3 |
|
Mercúrio |
13,5 |
|
Chumbo |
11,3 |
|
Prata |
10,5 |
|
Ferro |
7,87 |
|
Alumínio |
2,70 |
|
Cloreto |
2,17 |
|
Enxofre |
2,07 |
|
Água |
1,00 |
|
Sódio |
0,97 |
|
Lítio |
0,53 |
Fonte: HAYNES, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 3-4ésse ésse e 4-39ésse ésse.
Respostas e comentários
Itens 1 e 2
Retome com os estudantes os conceitos de temperatura de fusão (tê éfe), temperatura de ebulição (tê e) e densidade (dê), já estudados no 6º ano.
Julgando conveniente, realize um trabalho ativo com terminologias, propondo aos estudantes que redijam as conceituações de temperatura de fusão, temperatura de ebulição e densidade e as incluam na lista de verbetes do Amplie o vocabulário! que será desenvolvida ao longo do ano letivo (consulte, na parte inicial dêste Manual do professor, os comentários sôbre a finalidade pedagógica dessa seção da obra e sôbre como desenvolvê-la).
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- temperatura de fusão Temperatura constante em que uma substância sólida funde, quando aquecida a pressão constante.
- temperatura de ebulição Temperatura constante em que uma substância líquida entra em ebulição, quando aquecida a pressão constante.
- densidade Relação (divisão, razão, quociente) entre a massa e o volume de um objeto ou de uma amostra de substância ou material.
Analise com os estudantes os dados apresentados na tabela de temperatura de fusão (tê éfe) e temperatura de ebulição (tê e) para algumas substâncias, destacando que esse valores são obtidos com as substâncias submetidas a uma pressão equivalente à pressão média do ar ao nível do mar, que é uma a tê eme (lê-se “uma atmosfera”).
Explique que, em outras pressões, esses valores são diferentes. As modificações da temperatura de ebulição com a variação de pressão são bastante expressivas, e a tendência verificada experimentalmente é que, quanto menor a pressão, menor a temperatura de ebulição da substância. Por isso, em altitudes superiores ao nível do mar (e, portanto, pressões menores que uma a tê eme), a ebulição da água ocorre abaixo de 100 graus Célsius.
Saliente também que os valores de temperatura de fusão e de temperatura de ebulição referem-se às substâncias puras (isto é, não misturadas com outras substâncias).
Atividades
Após trabalhar o item 2 em sala de aula, proponha aos estudantes as atividades 1 a 16 da seção Explore diferentes linguagens.
3. Recordando o que é reação química
Neste capítulo e nos três seguintes, são apresentados alguns temas fundamentais da Química, ciência que se ocupa fundamentalmente de estudar:
- a composição das substâncias químicas;
- as propriedades das substâncias químicas;
- as transformações que as substâncias químicas podem sofrer para formar outras substâncias químicas e as condições necessárias para favorecer ou impedir tais transformações.
Os químicos consideram que uma substância é uma porção de matéria que tem propriedades bem definidas e que lhe são características. Entre essas propriedades estão a temperatura de fusão (tê éfe), a temperatura de ebulição (tê e), a densidade (dê), o fato de ser inflamável ou não, a cor etcétera.
Duas substâncias diferentes podem, eventualmente, possuir algumas propriedades iguais, mas nunca todas elas.




Quando uma ou mais substâncias transformam-se em uma ou mais substâncias diferentes, essa transformação é denominada reação química, ou transformação química.
Em outras palavras, reação química é um processo em que novas substâncias são formadas a partir de outras. Para saber se houve uma reação química, precisamos comparar as propriedades das substâncias presentes antes e depois da ocorrência da reação química.
Considere, por exemplo, que uma lata de alumínio vazia seja amassada. A substância inicialmente presente, o alumínio, possui exatamente as mesmas propriedades da substância presente no final, que também é o alumínio. Amassar a lata não é, portanto, uma transformação química, já que nenhuma nova substância foi formada.
Quando um objeto cai, uma folha de papel é rasgada, uma porção de areia é misturada à água, um giz é esmagado até virar pó e um prego é fincado na madeira, estamos diante de exemplos de transformações que não são reações químicas.


ATIVIDADE
Trabalho em equipe
A critério do professor, pode-se fazer uma visita guiada a uma indústria química.
O professor orientará previamente as equipes sôbre como proceder (antes, durante e depois).
Para uma atividade segura e proveitosa, siga as recomendações!
Respostas e comentários
Compreensão leitora
Saliente que, ao ler e estudar, os títulos frequentemente expressam ideias importantes. Neste capítulo, por exemplo, algumas das ideias-chave aparecem resumidas nos títulos. Além disso, palavras e expressões destacadas em itálico ou em negrito também enfatizam pontos que merecem a atenção do leitor.
Item 3
Ao trabalhar esse item, atente que, nele, substância é caracterizada macroscopicamente (isto é, por suas propriedades macroscópicas) e não por meio da constituição em nível atômico-molecular.
A discussão sôbre reações químicas foi iniciada no 4º ano, prevista na habilidade ê éfe zero quatro cê ih zero três (“Concluir que algumas mudanças causadas por aquecimento ou resfriamento são reversíveis (como as mudanças de estado físico da água) e outras não (como o cozimento do ovo, a queima do papel etcétera)”), e posteriormente retomada no 6º ano, na habilidade ê éfe zero seis cê ih zero dois (“Identificar evidências de transformações químicas a partir do resultado de misturas de materiais que originam produtos diferentes dos que foram misturados (mistura de ingredientes para fazer um bolo, mistura de vinagre com bicarbonato de sódio etcétera)”). Assim, neste momento, é necessário retomar essa temática, complementando-a com as informações apresentadas no livro do estudante.
Se julgar oportuno, proponha aqui também um trabalho ativo com terminologias, sugerindo aos estudantes que redijam as conceituações de reação química, reagente e produto e as incluam na lista de verbetes do Amplie o vocabulário! que será desenvolvida ao longo do ano letivo. Redações possíveis são:
- reação química Processo em que uma ou mais substâncias se transformam em outra ou outras substância ou substâncias.
- reagente Substância que, em uma reação química, se transforma em outra ou outras.
- produto Na reação química, substância que resulta da transformação ocorrida com o ou os reagente ou reagentes.
Aproveite a oportunidade propiciada pelo exemplo da reação química de combustão do etanol (ou álcool etílico, usado na desinfecção de superfícies e como combustível) para salientar que essa substância pode se inflamar facilmente na presença de calor, chama ou faíscas. Proponha uma reflexão individual (sem necessidade de manifestar-se em público): Na sua casa, as pessoas têm cuidado ao manusear e guardar etanol e outros produtos inflamáveis? A seguir, enfatize atitudes de segurança que as famílias devem ter quanto a materiais inflamáveis, mantendo-os longe de locais quentes, de chamas ou de aparelhos e interruptores elétricos (que podem produzir faíscas elétricas).
Atividades
Após o item 2, tem-se um bom momento para as atividades 17 a 21 do Explore diferentes linguagens.
Visita guiada
O Trabalho em equipe do item 3 propõe uma visita guiada a uma indústria química. Existem muitas opções que podem ser exploradas, por exemplo, nas áreas de polímeros, corantes e tintas, produtos hospitalares, medicamentos, cosméticos e fibras têxteis. Diversas empresas têm um departamento de relações públicas encarregado da comunicação entre a organização e o público. Em empresas de médio e grande porte, é comum que as ações dêsse setor da empresa incluam as visitas às suas instalações. Compareça previamente ao local e participe de uma dessas visitas. Registre o que puder (atentando, claro, às regras do local) em fotos, áudios e vídeos, a fim de utilizá-los para facilitar a roteirização. Atente, em especial, às explicações que serão dadas aos visitantes pelo profissional que os acolherá e guiará. Utilize o que obtiver nesse levantamento para estruturar a atividade conforme recomendado no texto Visitas guiadas, da parte inicial dêste Manual do professor.
Prepare a lista de objetivos da visita e discuta-a com os estudantes. Inclua perguntas para direcionar as observações. Exemplos: Que produtos são fabricados? Que matérias-primas são usadas? De onde elas provêm? Que técnicas e que equipamentos são utilizados na produção? Para que tipo de consumidor a produção se destina? (Consumidores? Indústrias? No Brasil? No exterior?) Que profissionais trabalham na indústria? Que formação precisam ter para a contratação? Que treinamentos recebem?
Se, na sua região, não houver indústrias químicas que possam ser visitadas, uma opção é um laboratório de química (de universidade ou de empresa). Outra opção, relativamente frequente, são as farmácias de manipulação, que têm laboratórios e profissionais da área de química.
Durante a segunda etapa, a visita propriamente dita, esteja atento a questões de segurança. Os estudantes devem estar identificados, e você e os demais agentes educacionais devem estar próximos deles o tempo todo, a fim de evitar quaisquer situações de risco. Lembre-se de que indústrias e laboratórios têm equipamentos delicados e quebráveis, vidrarias frágeis e dispositivos que funcionam sob aquecimento e/ou elevada pressão. Reforce com os estudantes, antes da visita e no seu decorrer, que não devem tocar em nada sem autorização nem se afastar do grupo.
Combine também previamente com os estudantes como as equipes deverão entregar os resultados solicitados na lista de objetivos. Estabeleça uma data e explique a fórma de apresentação. (Pôster? Cartaz digital? Relatório escrito? Produção de um vídeo ou áudio para podcast? Postagem no blog? Apresentação em sala usando Tê dê i cês?) Explique com clareza que aspectos são esperados, como os estudantes serão avaliados e esclareça todas as dúvidas.
Reagentes e produtos
As substâncias inicialmente existentes e que se transformam em outras devido à ocorrência de uma reação química são denominadas reagentes, e as substâncias nas quais se transformam são chamadas produtos. Assim, por exemplo, na combustão do etanol:

Representação da reação de decomposição do carbonato de cálcio (componente do calcário):

Representação da decomposição da água:



Certificar‑se de que uma reação química ocorreu nem sempre é fácil. Às vezes, só é possível em laboratórios adequadamente equipados para separar componentes das misturas obtidas e determinar suas propriedades. Há algumas evidências que podem estar associadas à ocorrência de reações químicas, mas nem sempre estão. Consideremos alguns exemplos relevantes:
- liberação de calor – As combustões são reações químicas e, quando ocorrem, há liberação de calor. Contudo, quando vapor de água condensa ou água líquida solidifica também há liberação de calor pela água, e esses processos são transições de fase, não reações químicas.
- mudança de cor – Quando um alvejante é derrubado em uma roupa colorida, há uma reação química que transforma o corante da roupa em uma substância incolor ou de coloração diferente da inicial. Contudo, se misturarmos tinta azul e tinta amarela, veremos a coloração verde, mas não há reação química entre as tintas, apenas sobreposição de suas cores.
- mudança de odor – Quando frutas, carnes e outros alimentos apodrecem, ocorrem reações químicas em que substâncias presentes nos alimentos se transformam em outras, de odor diferente do original. No entanto, quando você destampa um frasco de perfume, sente um odor não porque tenha havido reação química; aconteceu evaporação de parte do perfume e o vapor chegou até o interior do seu nariz.
- liberação de gás – Ao jogar um comprimido efervescente em água há uma reação química que produz gás carbônico. Por outro lado, quando acontece a ebulição de uma substância, formam‑se bolhas de vapor, mas não ocorre reação, e sim mudança de fase.
Respostas e comentários
tê cê tê Economia
Prosseguindo com o que é abordado no texto “Por que estudar Química?”, do início do capítulo, a proposta de visita guiada do boxe Trabalho em equipe insere-se na temática Trabalho (da macroárea de tê cê tês Economia), pois, ao visitar uma indústria química (ou um laboratório químico ou uma farmácia de manipulação) que envolva aplicação da Química em processos de pesquisa e/ou de produção, os estudantes têm a oportunidade de tomar contato com especificidades dessa área ligadas ao mundo do trabalho.
De ôlho na Bê êne cê cê!
A proposta de visita guiada do boxe Trabalho em equipe, além de retomar o trabalho com as competências específicas 2 e 3, já citadas anteriormente neste capítulo do Manual do professor, estimula também o desenvolvimento da competência geral 9, no que diz respeito a exercitar a empatia, o diálogo, a resolução de conflitos e a cooperação, fazendo-se respeitar e promovendo o respeito ao outro e aos direitos humanos, com acolhimento e valorização da diversidade de indivíduos e de grupos sociais, seus saberes, identidades, culturas e potencialidades, sem preconceitos de qualquer natureza.
4. A Lei da Conservação da Massa
O cientista francês Antuâne Láurent lavoziêr (1743-1794) estudou diversos processos químicos. Entre suas contribuições, a mais conhecida foi enunciada por ele após realizar diversas reações químicas dentro de recipientes fechados. Usando uma balança, lavoziêr determinou a massa do recipiente antes e depois de a reação química acontecer. Comparando as medidas, ele pôde enunciar que a massa final de um recipiente fechado, após ocorrer dentro dele uma reação química, é sempre igual à massa inicial.
Essa importante generalização é a Lei da Conservação da Massa, ou Lei de lavoziêr, que também pode ser enunciada de uma outra maneira: quando uma reação química é realizada num recipiente fechado, a massa dos produtos é igual à massa dos reagentes. Vejamos um exemplo:

Note que a massa do reagente (18 gramas) é igual à massa total dos produtos (2 gramas + 16 gramas = 18 gramas).
Mas por que lavoziêr escolheu recipientes fechados? Entre os reagentes e/ou entre os produtos de uma reação química podem existir substâncias gasosas, tais como o oxigênio, o hidrogênio e o gás carbônico. Se, por exemplo, uma substância gasosa for produzida numa reação, ela sairá espontaneamente do recipiente e sua massa não será medida pela balança como parte da massa final do sistema. Ao escolher recipientes fechados, lavoziêr eliminou dúvidas sôbre a possível entrada ou saída de gases do sistema.

Há quem considere a Lei de lavoziêr o marco inicial da Química. Essa lei incorporou-se até mesmo aos “saberes populares”, sendo frequentemente enunciada como: na natureza nada se cria, nada se perde, tudo se transforma.
Nos séculos dezoito e dezenove, cientistas verificaram que muitas substâncias podem ser decompostas. (Em uma reação de decomposição, um único reagente se transforma em dois ou mais produtos.) Água e carbonato de cálcio, por exemplo, são substâncias que podem ser decompostas, indicando que podem ser desmembradas em entidades químicas menos complexas. Por outro lado, nas condições experimentais utilizadas na época, substâncias como os gases hidrogênio, oxigênio e nitrogênio não se decompunham, sugerindo que já são constituídas de algo quimicamente elementar. Tais substâncias passaram a ser consideradas substâncias elementares e isso deu origem ao conceito de elemento químico que estudaremos oportunamente.
Respostas e comentários
Itens 4 e 5
Ao trabalhar os conteúdos conceituais, note a importância dos itens 4 e 5 (leis, generalizações de resultados empíricos) na preparação para o item 6 (teoria que possibilitou a racionalização dessas leis).
Este capítulo mostra aspectos relevantes na história da Química. Importante enfatizarmos ao docente que alguns dos exemplos de substâncias e de reações aqui mostrados não foram conhecidos e/ou estudados nas épocas mencionadas. Esses exemplos foram escolhidos pela conveniência didática. Além disso, utilizamos a linguagem atual da Química.
O final do item 4 menciona o conceito de elemento químico. Explique aos estudantes que, nas condições experimentais e analíticas utilizadas nos séculos dezoito e dezenove, percebia‑se que algumas substâncias podiam ser decompostas (reagir em reações químicas de decomposição) e outras não. Sob o ponto de vista do desenvolvimento histórico da Química, isso foi relevante porque suscitou experimentos e debates científicos relativos à busca das entidades elementares, entendendo‑se o adjetivo elementares, nesse contexto, sob o ponto de vista de composição química, ou seja, havia uma busca pelos elementos químicos que constituíam as substâncias.
Neste momento do curso, é importante esclarecer ao docente que não estamos usando o adjetivo elementares nesse sentido (ou seja, não estamos falando em Física de partículas e em partículas elementares), mas no contexto do desenvolvimento do pensamento químico nos séculos dezoito e dezenove, que, entre outras frentes de pesquisa, buscava pelos elementos químicos.
Substâncias como carbonato de cálcio e nitrato de amônio podiam ser decompostas. Outras, como gás nitrogênio, gás hidrogênio e gás oxigênio, não se decompunham, o que sugeria que são constituídas de entidades elementares. (Ao falar que não se verificou que essas substâncias se decompusessem, estamos nos referindo às condições experimentais vigentes nas épocas mencionadas e na capacidade de análise de produtos então existente, ou seja, não estamos falando de situações suficientemente energéticas para que haja quebra de ligações covalentes e ionização de átomos originando plasma.) O desenvolvimento científico envolve a participação de muitos indivíduos, experimentação diversificada, elaboração e teste de hipóteses.
O que expusemos dá uma breve noção da linha de raciocínio que conduziu à conceituação de elemento químico, que será comentada a seguir, no contexto da Teoria de Dalton, e, no capítulo 2, em sua conceituação atualmente em uso.
5. A Lei das Proporções Constantes
O estudo das reações de decomposição foi importante para que o francês prust (1754-1826) descobrisse que as substâncias compostas têm uma composição fixa.
Usaremos como exemplo a substância água, que é composta dos elementos hidrogênio e oxigênio. Veja os seguintes dados experimentais, referentes à decomposição de amostras de diferentes massas de água:
|
Decomposição de: |
água |
→ |
hidrogênio |
+ |
oxigênio |
|---|---|---|---|---|---|
|
9 g de água |
9 g |
1 g |
8 g |
||
|
18 g de água |
18 g |
2 g |
16 g |
||
|
27 g de água |
27 g |
3 g |
24 g |
||
|
100 g de água |
100 g |
11,11 g |
88,89 g |
Vamos dividir a massa de hidrogênio pela massa de oxigênio de cada um dêsses experimentos. Fazendo isso, chegamos a uma mesma fração.
Esses dados revelam que a proporção entre os elementos que compõem a água permanece constante: a massa de oxigênio sempre é 8 vezes maior que a massa de hidrogênio. Em outras palavras, a composição da água, em massa, é sempre de uma parte de hidrogênio para 8 partes de oxigênio.
Vejamos outro exemplo, o do gás carbônico:
|
Decomposição de: |
gás carbônico |
→ |
carbono |
+ |
oxigênio |
|---|---|---|---|---|---|
|
11 g de gás carbônico |
11 g |
3 g |
8 g |
||
|
22 g de gás carbônico |
22 g |
6 g |
16 g |
||
|
44 g de gás carbônico |
44 g |
12 g |
32 g |
||
|
100 g de gás carbônico |
100 g |
27,27 g |
72,73 g |
Dividindo a massa de carbono pela de oxigênio:
Assim, podemos afirmar que a composição do gás carbônico, em massa, é sempre de 3 partes de carbono para 8 partes de oxigênio.
Por meio de muitos estudos similares a esses, prust concluiu que a composição química das substâncias compostas é sempre constante, não importando qual sua origem. Em outras palavras, uma certa substância composta, seja obtida de fontes naturais ou produzida em laboratório, sempre é formada pelos mesmos elementos químicos numa mesma proporção em massa. Essa generalização ficou conhecida como Lei das Proporções Constantes, ou Lei de prust.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• Lei da Conservação da Massa
• Lei das Proporções Constantes
Respostas e comentários
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- Lei da Conservação da Massa Lei segundo a qual a massa inicial e a massa final de um recipiente fechado, dentro do qual ocorre uma reação química, são iguais.
- Lei das Proporções Constantes Lei segundo a qual a proporção entre os elementos que formam certa substância composta é sempre a mesma, não importando a origem dessa substância.
Atividades
Após o item 5, as atividades 22 e 23 do Explore diferentes linguagens já podem ser realizadas.
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero dois
“Comparar quantidades de reagentes e produtos envolvidos em transformações químicas, estabelecendo a proporção entre as suas massas.”
No item 5, os estudantes tomam contato com o fato de haver uma proporcionalidade entre as massas de reagentes e de produtos em uma reação química.
Esse conhecimento, aliado à conservação da massa (estudada no item 4), capacita os estudantes a realizar previsões como aquelas envolvidas nas atividades 22 e 23 do Explore diferentes linguagens.
Isso também possibilita a eles a compreensão de que as substâncias químicas apresentam composição constante (e que lhes é característica) e a percepção do embasamento experimental que Dalton usou para elaborar sua teoria.
Este capítulo também fornece condições para que os estudantes entendam como a Teoria Atômica de Dalton permitiu explicar a conservação da massa (Lei de lavoziêr) nas reações químicas e o fato de a composição das substâncias ser constante (Lei de prust).
Enfim, o desenvolvimento da habilidade ê éfe zero nove cê ih zero dois é relevante para a compreensão dos aspectos que tornaram a Teoria Atômica de Dalton conveniente para explicar relações ponderais (isto é, relações envolvendo proporções em massa), amplamente presentes na Química, e fornece aos estudantes pré-requisitos para o desenvolvimento da habilidade ê éfe zero nove cê ih zero três, que se inicia neste capitulo e prossegue nos capítulos 2 e 3.
EM DESTAQUE
Não confunda lei com teoria
Após realizar muitos experimentos, um cientista ou grupo de cientistas pode perceber regularidades naturais. Toda vez que uma regularidade é descoberta, pode ser enunciada usando palavras e/ou equações matemáticas e passa a ser denominada lei, ou princípio.
Para uma lei ser válida, ela não precisa ser explicada; basta que seja observada por meio de muitos experimentos. Em outras palavras, uma lei generaliza um comportamento regular das coisas, é uma regra seguida pela natureza.
Teoria, por outro lado, é uma proposta de explicação para uma ou mais leis que seja aceita pelos cientistas, pelo menos durante certo período de tempo, como sendo a melhor maneira de explicar acontecimentos (fenômenos) observados.
Porém, graças à descoberta de novas leis ou de novos fatos que ela não explique satisfatoriamente, uma teoria pode ser aperfeiçoada ou, até mesmo, substituída por outra.
Elaborado com dados obtidos de: , K.; , K. What is scientific knowledge? An introduction to contemporary epistemology of Science. Nova iórqueTaylor & Francis, 2020.

ATIVIDADE
Trabalho em equipe
Pesquisem e relatem exemplos de teorias que foram modificadas ou substituídas na história das Ciências da Natureza.
Os resultados obtidos nessa pesquisa podem ser usados como argumentos para sustentar a afirmação “a Ciência é uma atividade colaborativa”? Expliquem.
6. A Teoria Atômica de Dalton
Entre 1803 e 1808, o cientista inglês Djón Dalton (1766 -1844) propôs uma teoria para explicar as leis enunciadas por lavoziêr e prust. Essa teoria, que será comentada a seguir, ficou conhecida como Teoria Atômica de Dalton.
A palavra átomo vem do grego e significa “indivisível”. Ela foi usada pela primeira vez por alguns filósofos da Grécia Antiga que, com base em argumentos filosóficos, propunham que todas as porções de matéria são formadas por partículas muito pequenas e indivisíveis, os átomos. As ideias dêsses filósofos não foram muito além disso, porque não se fundamentavam em experimentos.
Dalton, ao contrário, baseou-se nos resultados de experimentos feitos por ele e por outros cientistas que o antecederam, entre eles lavoziêr e prust. Alguns pontos da sua teoria são:
- Todas as substâncias são formadas por átomos.
- Os átomos de um mesmo elemento químico são iguais em suas características (por exemplo, tamanho e massa).
- Os átomos dos diferentes elementos químicos são diferentes entre si (por exemplo, possuem massas diferentes).
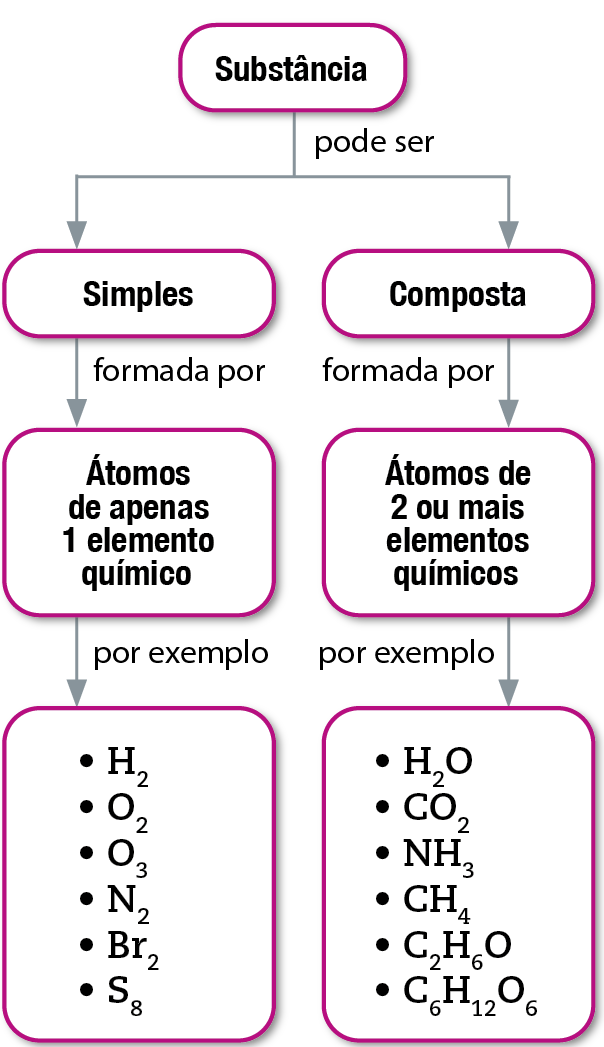
- As substâncias simples são formadas por átomos de um mesmo elemento químico.
- As substâncias compostas (também chamadas compostos químicos, ou simplesmente compostos) são formadas por átomos de dois ou mais elementos químicos diferentes, que se combinam sempre numa mesma proporção.
- Os átomos não são criados nem destruídos.
- Nas reações químicas, os átomos se recombinam.
Átomos

Substâncias simples

Substâncias compostas
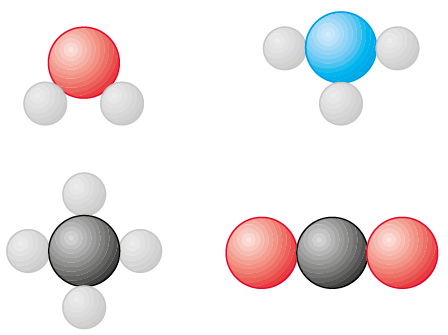
Representação de átomos, substâncias simples e substâncias compostas na Teoria Atômica de Dalton. (Os átomos estão representados por esferas em cores fantasiosas e ampliados dezenas de milhões de vezes.)
Fonte: , J. Chemistry. quinta edição Nova iórqueMcGraw-Hill, 2020. página 8.
Respostas e comentários
De olho na BNCC!
O texto “Não confunda lei com teoria” e o boxe Trabalho em equipe a ele adjacente oferecem oportunidade de continuar o desenvolvimento da competência geral 2 e da competência específica 2.
Além disso, o texto e o boxe mencionados, junto com o item 6, auxiliam os estudantes a compreender as Ciências da Natureza como empreendimento humano, e o conhecimento científico como provisório, cultural e histórico, de modo que favorecem o desenvolvimento da competência específica 1.
História da Ciência
A atividade proposta no Trabalho em equipe permite aos estudantes perceber o dinamismo da Ciência, evidenciando, entre outros aspectos, que o pensamento científico está permanentemente aberto ao questionamento e à reformulação, o que pode conduzir à reavaliação de opiniões e conclusões anteriores.
A atividade estimula os estudantes a desenvolver a capacidade de argumentar em exposições orais. (Aqui, pode ser útil ao docente o item Algumas considerações sôbre inferir, propor e argumentar, da parte inicial dêste Manual do professor.) Também auxilia na percepção de que as conquistas científicas normalmente são decorrência do trabalho de diversos membros da comunidade e não de atos isolados de personalidades singulares.
Marque uma data para que as equipes apresentem suas contribuições e organize uma divisão do tempo da aula para que todas possam se expressar, dentro do tempo estipulado por você. Dependendo do tamanho da turma, destine duas aulas à exposição. Combine antecipadamente o tempo, para que as equipes possam dividir com equidade sua atuação e ensaiar a apresentação, a fim de não exceder o tempo disponível. Insista para que elaborem um apresentação objetiva e não deixem de incluir a época em que os fatos relatados aconteceram, procurando contextualizá-los na história da humanidade por meio da menção de grandes eventos que ocorreram na época mencionada.
Ao final, faça um arremate retomando e salientando, dos pontos que foram expostos, aqueles que exemplificam que as Ciências envolvem um processo dinâmico, que o conhecimento científico é passível de reavaliação (é provisório), está associado à época, aos avanços e às limitações inerentes a ela (é histórico) e se insere em um arcabouço muito maior, que é o conhecimento humano (é cultural).
Itens 6 a 9
Uma teoria corresponde a uma hipótese que foi proposta para explicar fatos e, explicando‑os adequadamente, é aceita pela comunidade científica (pelo menos durante certo período de tempo, até que, à luz de fenômenos que não explique, precise ser aperfeiçoada ou substituída). A Teoria Atômica de Dalton permitiu explicar as leis de lavoziêr e de prust. Como os átomos apenas se recombinam durante uma reação química e não são destruídos nem formados, a massa de reagentes é sempre igual à de produtos (conservação da massa). Além disso, de acôrdo com ela, as moléculas de um composto químico são formadas por átomos unidos numa proporção bem definida de números inteiros (1 dois pontos 1, 1 dois pontos 2, 1 dois pontos 3, 1 dois pontos 4, 2 dois pontos 3 etcétera), explicando as proporções definidas. Isso lançou clareza na distinção entre substâncias compostas e misturas, já que as misturas não têm composição fixa, podendo apresentar proporção diversificada entre os seus constituintes.
Assim, não importando qual seja a massa da amostra de determinado composto que consideremos, a proporção entre as massas dos átomos presentes será sempre a mesma (proporções constantes), pois tal proporcionalidade decorre da massa individual dos átomos e da relação de números inteiros em que eles se combinam.
Com a teoria de Dalton, pôde‑se inferir que dois elementos podem, eventualmente, formar mais de um composto. De fato, diversos casos são conhecidos (como agáóh e agáóh; ésse ô e ésse ô; cê ó e cê ó), muitos deles evidenciados durante o século dezenove.
Percebe‑se, aqui, o aspecto preditivo do raciocínio científico e a oportunidade de auxiliar os estudantes a “associar explicações e/ou modelos à evolução histórica dos conhecimentos científicos envolvidos” e “aprimorar seus saberes e incorporar, gradualmente, e de modo significativo, o conhecimento científico” (Bê êne cê cê, 2018, página 323).

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• lei
• teoria
• Teoria Atômica de Dalton
7. Símbolos e fórmulas
Símbolos representam elementos
São conhecidos atualmente mais de 100 elementos químicos. Cada um deles tem um nome e um símbolo diferente. Os símbolos dos elementos são formados por uma ou duas letras. A primeira é sempre maiúscula e a segunda, caso exista, é sempre minúscula. O símbolo de um elemento vem de uma ou duas letras tiradas de seu nome em latim ou grego. Por causa disso, nem todos os símbolos têm relação lógica com o nome do elemento em português.
|
Elemento |
Símbolo |
|---|---|
|
Alumínio |
Al |
|
Bromo |
Br |
|
Cálcio |
Ca |
|
Carbono |
C |
|
Cloro |
Cl |
|
Cobre |
Cu |
|
Crômio |
Cr |
|
Enxofre |
S |
|
Ferro |
Fe |
|
Flúor |
F |
|
Fósforo |
P |
|
Hidrogênio |
H |
|
Iodo |
I |
|
Magnésio |
Mg |
|
Manganês |
Mn |
|
Mercúrio |
Hg |
|
Níquel |
Ni |
|
Nitrogênio |
N |
|
Ouro |
Au |
|
Oxigênio |
O |
|
Platina |
Pt |
|
Potássio |
K |
|
Prata |
Ag |
|
Sódio |
Na |
Fórmulas representam substâncias
Todas as substâncias são formadas por átomos. As substâncias simples são formadas por átomos de um único elemento, e as substâncias compostas são formadas por átomos de dois ou mais elementos diferentes.
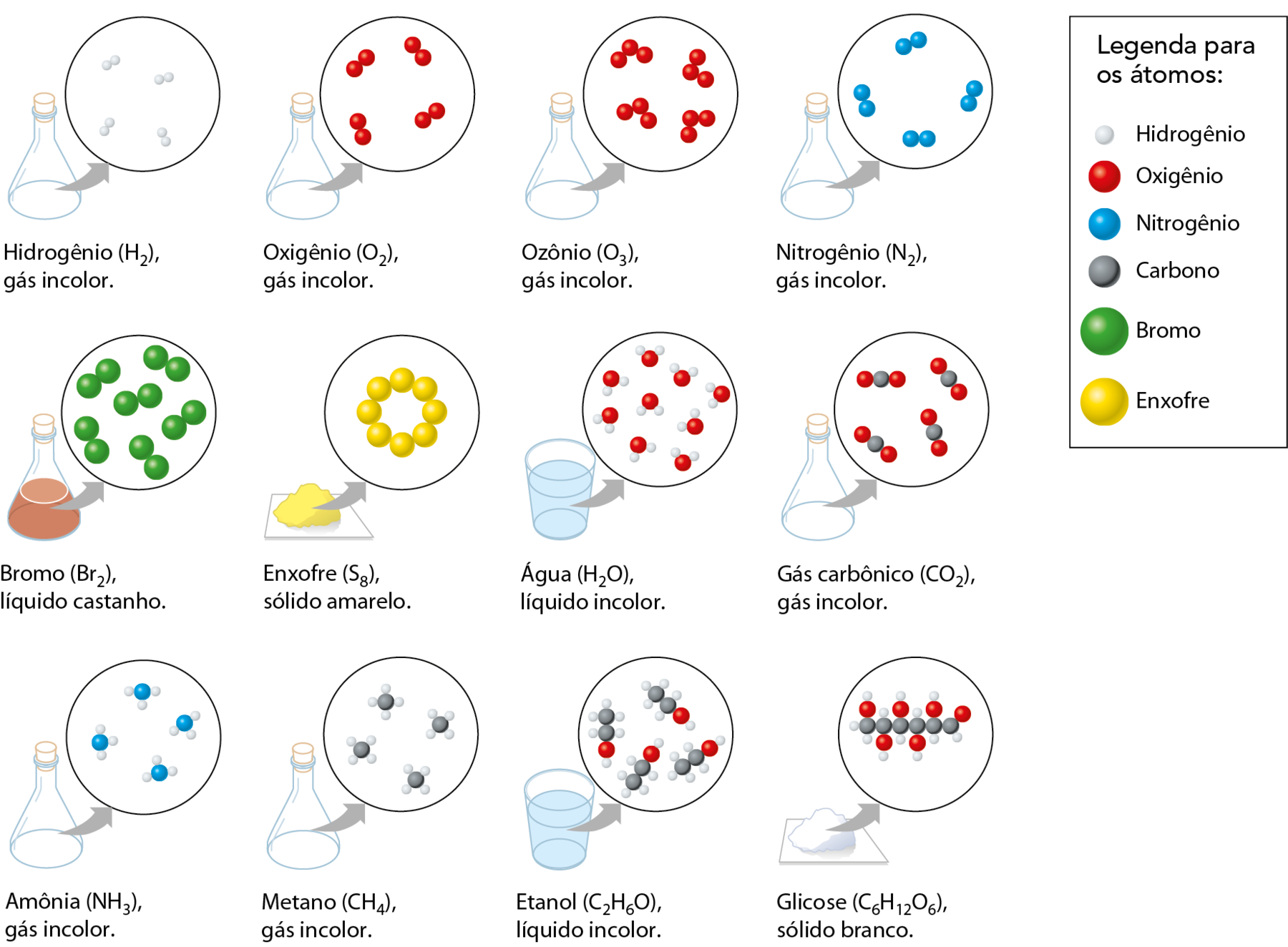
As moléculas são entidades formadas pela união de dois ou mais átomos. Para representar as moléculas de uma substância, seja ela simples ou composta, os químicos utilizam fórmulas. Você já deve ter ouvido falar que a fórmula da água é agáóh. Outros exemplos de fórmulas usadas pelos químicos são cê ó (gás carbônico), êne (gás nitrogênio), óh (gás oxigênio), óh (gás ozônio), cêagáóh (etanol), cêagáóh (glicose) e êne agá (amônia).
Na fórmula que representa a molécula de uma substância são colocados os símbolos dos elementos que tomam parte de sua composição e números, os índices de atomicidade (ou, simplesmente, índices), que indicam quantos átomos de cada elemento estão presentes na molécula. Se o índice de atomicidade não for escrito, é porque seu valor é 1. Assim, por exemplo:
- óh indica a substância cujas moléculas são formadas por dois átomos do elemento químico oxigênio.
- óh indica a substância cujas moléculas são formadas por três átomos do elemento químico oxigênio.
- agáóh indica a substância cujas moléculas são formadas por dois átomos do elemento químico hidrogênio e um átomo do elemento químico oxigênio.
- êne agá indica a substância cujas moléculas são formadas por um átomo do elemento químico nitrogênio e três átomos do elemento químico hidrogênio.

ATIVIDADE
Para fazer no seu caderno
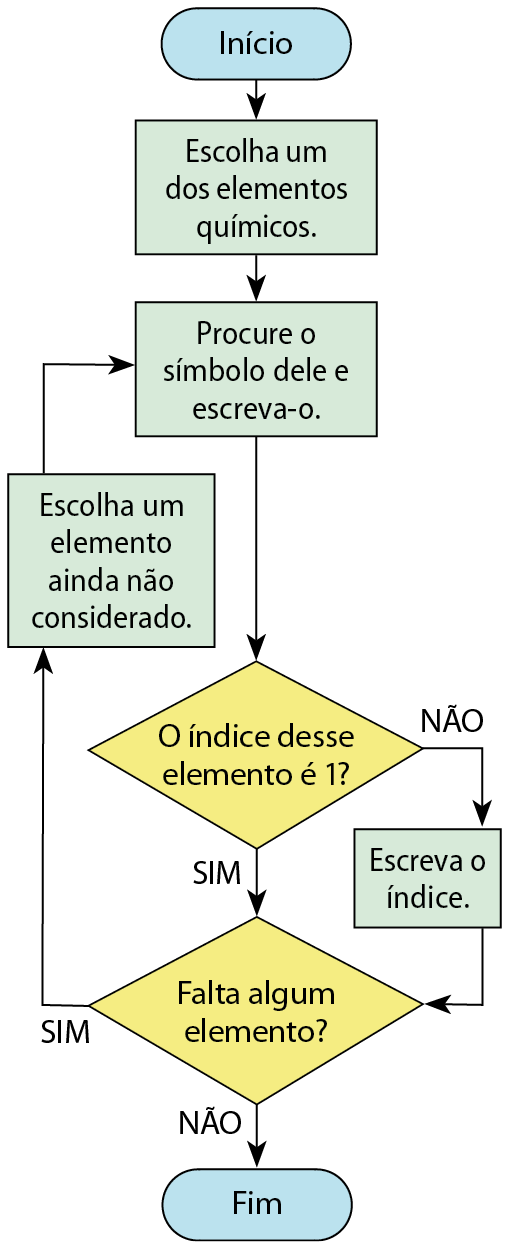
Este é um algoritmo possível para escrever a fórmula de uma substância a partir de um modelo que representa sua molécula (um modelo molecular):
- Escolha um dos elementos químicos presentes no modelo molecular.
- Procure na tabela periódica o símbolo que representa esse elemento químico.
- Escreva o símbolo dêsse elemento químico.
- Escreva, à direita do símbolo, um índice (número subscrito) que indique quantos átomos dêsse elemento existem na molécula. Se o índice for “1”, não precisa escrevê-lo.
- Há um ou mais elementos ainda não considerados? Se houver, escolha um deles e repita as instruções a partir do passo 2.
Crie um fluxograma que expresse esse algoritmo.
Respostas e comentários
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- lei Enunciado (matemático ou textual) que expressa uma regularidade da natureza.
- teoria Proposta de explicação para uma ou mais leis que é aceita pela comunidade científica, pelo menos durante algum tempo.
- Teoria Atômica de Dalton Teoria que inclui as seguintes ideias: as substâncias são formadas por átomos de elementos químicos; átomos não são criados nem destruídos; nas reações químicas, os átomos se recombinam.
Atente!
Deixaremos o estudo das substâncias iônicas e das substâncias metálicas, que não são formadas por moléculas, para o capítulo 4.
Noções de pensamento computacional
O boxe Para fazer no seu caderno do item 7 propõe uma atividade envolvendo pensamento computacional, algoritmo e fluxograma. (Veja o texto sôbre pensamento computacional na parte inicial dêste Manual do professor.)
Retome que um algoritmo é um conjunto de instruções sequenciais para executar procedimentos lógicos a fim de resolver um problema e que um algoritmo pode ser representado por meio de um fluxograma.
Os estudantes já têm conhecimento dêsses termos porque fazem parte da habilidade ê éfe zero seis ême ah zero quatro de Matemática (que abrange “construir algoritmo em linguagem natural e representá-lo por fluxograma que indique a resolução de um problema simples”) e também porque já apareceram no volume anterior desta obra.
A atividade solicita a elaboração de um fluxograma a partir do algoritmo fornecido. Um exemplo de resposta possível é o seguinte:

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• símbolo
• fórmula
• índice ou índice de atomicidade
Distinção entre substância simples e substância composta considerando a composição química
A teoria de Dalton nos permite compreender por que as substâncias compostas podem ser decompostas em outras substâncias menos complexas, mas as substâncias simples não podem.
As substâncias simples são formadas por átomos de apenas um elemento e as substâncias compostas, por átomos de dois ou mais elementos (veja o mapa conceitual).
Assim, as substâncias simples são consideradas substâncias elementares porque têm em sua constituição átomos de um único elemento químico.
Esquema com modelos para moléculas de algumas substâncias
Fonte: Elaborado a partir de , N. J. Principles of Chemistry: a molecular approach. quarta edição Harlow: Pearson, 2021. página 138-140.
Respostas e comentários
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- símbolo Representação gráfica de um elemento químico.
- fórmula Representação gráfica de uma substância química.
- índice ou índice de atomicidade Número que indica a quantidade de átomos de um elemento na molécula de uma substância.
Atividades
Ao final dêsse item 7, proponha aos estudantes a realização das atividades 24 a 27 do Explore diferentes linguagens.
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero três
“Identificar modelos que descrevem a estrutura da matéria (constituição do átomo e composição de moléculas simples) e reconhecer sua evolução histórica.”
Neste capítulo, os estudantes estabelecem um primeiro contato com uma concepção científica do átomo, no contexto da Teoria Atômica de Dalton. Você pode ampliar a discussão, comentando que essa teoria elucida a diferença de substâncias compostas e substâncias simples quanto à possibilidade de decomposição (veja comentário sôbre os itens 4 e 5, neste capítulo). As substâncias compostas (compostos químicos ou, simplesmente, compostos) são passíveis de se decompor porque têm, em sua composição, mais de um elemento químico. Em última instância, elas podem ser decompostas nas substâncias elementares (substâncias simples correspondentes aos elementos químicos presentes).
A Teoria Atômica de Dalton é empregada, neste capítulo, para explicar a Lei da Conservação da Massa e a Lei das Proporções Constantes (item 9).
O desenvolvimento da habilidade ê éfe zero nove cê ih zero três prosseguirá nos capítulos 2 e 3. No capítulo seguinte, os estudantes perceberão que há evidências experimentais que não são contempladas pelo modelo atômico de Dalton (carga elétrica, eletrização), que, em função disso, foi substituído. Isso vai ao encontro de desenvolver nos estudantes a percepção do dinamismo da Ciência.
Cabe, aqui, reforçar, nessa abordagem, a relevância da competência específica 1, que propõe compreender as Ciências da Natureza como empreendimento humano, e o conhecimento científico como provisório, cultural e histórico.
8. Equação química
Equação química representa reação química
Voltemos ao exemplo da decomposição da água. Levando em conta a composição das moléculas envolvidas, podemos representar essa reação da seguinte maneira:

A água, o reagente, é formada por moléculas agáóh; o gás hidrogênio e o gás oxigênio, os produtos, têm fórmulas, respectivamente, agá e óh. Assim, poderíamos representar a reação usando as fórmulas do reagente e dos produtos:
agáóh seta para direita agá + óh
Nessa representação falta, porém, a proporção correta entre as quantidades de moléculas envolvidas.
Uma representação mais correta é:
agáóh + agáóh seta para direita agá + agá + óh
ou seja,
2 agáóh seta para direita 2 agá + ó dois
Agora sim está expressa a verdadeira proporção entre as quantidades de moléculas que participam da reação.
Essa maneira de representar uma reação química é denominada equação química. O exemplo que acabamos de ver é a equação química que representa a decomposição da água.
Os números que indicam a proporção entre as quantidades de moléculas, numa equação química, são chamados coeficientes. Na equação anterior, o coeficiente da água é 2, o do gás hidrogênio é 2 e o do gás oxigênio é 1 (que não precisa ser escrito).

Outros exemplos de equações químicas são:


ATIVIDADE
Trabalho em equipe
Usando moedas de diferentes valores, fichas coloridas, bolinhas de massa de modelar, círculos de papel colorido, bolinhas de poliestireno expandido ou outro material que a imaginação sugerir, represente as moléculas dos reagentes e dos produtos das reações químicas cujas equações são:
seta para direita + ó dois
cê + óh seta para direita cê ó
êne + óh seta para direita doisêne ô
cê + doisagá seta para direita cê agá
êne + doisóh seta para direita doisêne ó dois
êne + agá seta para direita doisêne agá
cê agá + doisóh seta para direita cê ó + doisagáóh
Respostas e comentários
Conteúdo procedimental sugerido
• Utilizar moedas, fichas ou bolinhas de poliestireno expandido para elaborar modelos que representem, em nível atômico-molecular, algumas reações químicas (não muito complexas).
Esse conteúdo é o que se pretende desenvolver com o primeiro Trabalho em equipe do item 8. O segundo pretende fazer com que essas representações não fiquem confinadas ao plano qualitativo, na medida em que enfoca a conservação dos átomos e, por consequência, a proporcionalidade expressa pelos coeficientes estequiométricos.
A atividade 31 do Explore diferentes linguagens estende o trabalho dêsse conteúdo procedimental a outros exemplos de reações químicas.
Na realização da proposta dos dois boxes Trabalho em equipe, é fundamental que você atente a dois aspectos, a fim de favorecer a aprendizagem.
Primeiro, saliente que se trata de um modelo, uma concepção representativa.
Independentemente da escolha do material (contas de plástico, bolinhas de massa de modelar ou qualquer outro considerado conveniente), é fundamental destacar que se trata de uma representação. Ressalte que as cores empregadas não são reais e que os átomos não são esferas rígidas, são assim representados no modelo de Dalton.
Um segundo aspecto importante que requer sua intervenção: quando ocorre o rearranjo da maneira como os átomos estão ligados, as moléculas de reagentes transformam-se em moléculas de produtos. Assim, é pedagogicamente conveniente não estimular as equipes a representar simultaneamente moléculas de reagentes e de produtos, mas, ao contrário, representar primeiro as moléculas de reagentes e, a partir delas, por rearranjo das esferas que representam os átomos, representar as moléculas de produtos. Isso auxilia na compreensão de que os mesmos átomos existentes nos reagentes estarão nos produtos, porém combinados de modo diferente.
Balanceamento de equações químicas
Analisando os exemplos de equações químicas mostrados, é possível perceber que o número de átomos de um certo elemento químico é igual nos reagentes e nos produtos. Isso porque os átomos não são destruídos nem criados numa reação química.
Quando escrevemos uma equação química, ela deve estar corretamente balanceada, ou seja, os coeficientes devem estar corretamente indicados. Caso contrário, não estará sendo respeitado o fato de os átomos se conservarem.
Veja, por exemplo, a equação química:
êne + óh seta para direita êne ô
Ela não está corretamente balanceada, pois há menos átomos de nitrogênio (êne) e de oxigênio (óh) no lado do produto, mas ficará correta se colocarmos o coeficiente 2 na frente da fórmula êne ô.
êne + óh seta para direita 2 êne ô

ATIVIDADE
Trabalho em equipe
Verificar se, no trabalho em equipe proposto anteriormente, foi respeitado o princípio da conservação dos átomos.

Use a internet
Explore o balanceamento de equações químicas no simulador disponível em: https://oeds.link/WtE2N3. Acesso em: 6 junho 2022.
9. Explicação para as Leis de lavoziêr e de prust
Numa reação química os átomos apenas se recombinam. Como os átomos não são destruídos nem formados, a massa de reagentes é sempre igual à dos produtos. Isso explica a Lei de lavoziêr.
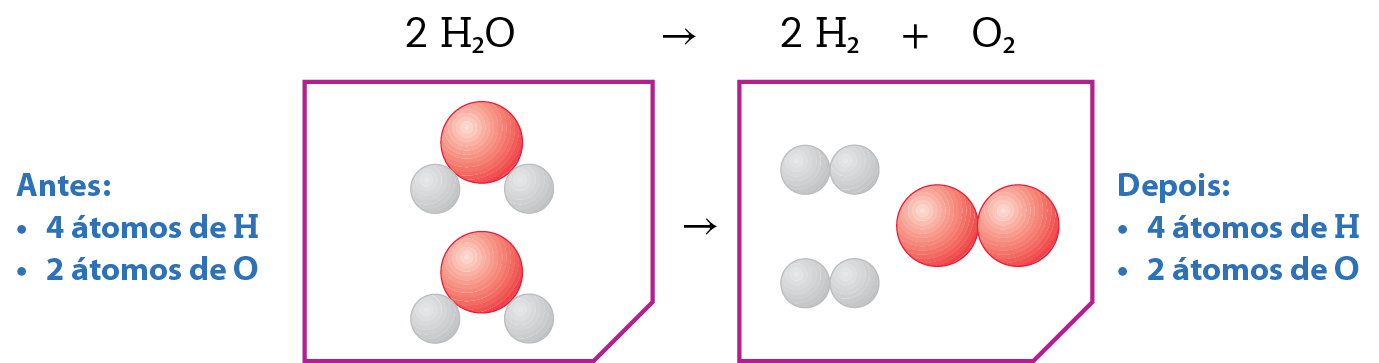
As moléculas de determinada substância são formadas por átomos unidos numa proporção bem definida. Não importa a quantidade da substância que consideremos. A proporção em que os átomos estarão presentes será sempre a mesma, o que explica a Lei de prust.


ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• equação química
• coeficiente (de uma equação química)
Respostas e comentários
Use a internet
O simulador recomendado reforça as atividades propostas anteriormente, permitindo que os estudantes interajam para realizar o correto balanceamento de diversas reações químicas.
À medida que os estudantes modificam os coeficientes de reagentes e de produtos, o simulador apresenta os modelos moleculares na tela, possibilitando que eles percebam que o correto balanceamento de uma equação química está vinculado à conservação dos átomos. O simulador tem duas ferramentas que podem ser acionadas para ajudar a realizar o balanceamento.
Ele também apresenta jogos com três diferentes níveis de dificuldade.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- equação química Representação gráfica para uma reação química.
- coeficiente (de uma equação química) Número colocado antes da fórmula de reagente ou produto para balancear uma equação química.
Se considerar oportuno, proponha aos estudantes a inclusão de mais dois verbetes na atividade:
- substância simples Substância constituída de átomos de um único elemento químico. Exemplos são o gás nitrogênio (ênedois), o gás oxigênio (óhdois), o gás hidrogênio (agádois) e o enxofre (ésse).
- substância composta Substância constituída de átomos de dois ou mais elementos químicos. Exemplos são a água (agádoisóh), o gás carbônico (cê ódois) e a sacarose (cêagáóh).
Atividades
Ao final do item 9, os estudantes têm condições de fazer as atividades 28 a 31 do Explore diferentes linguagens.
Organização de ideias
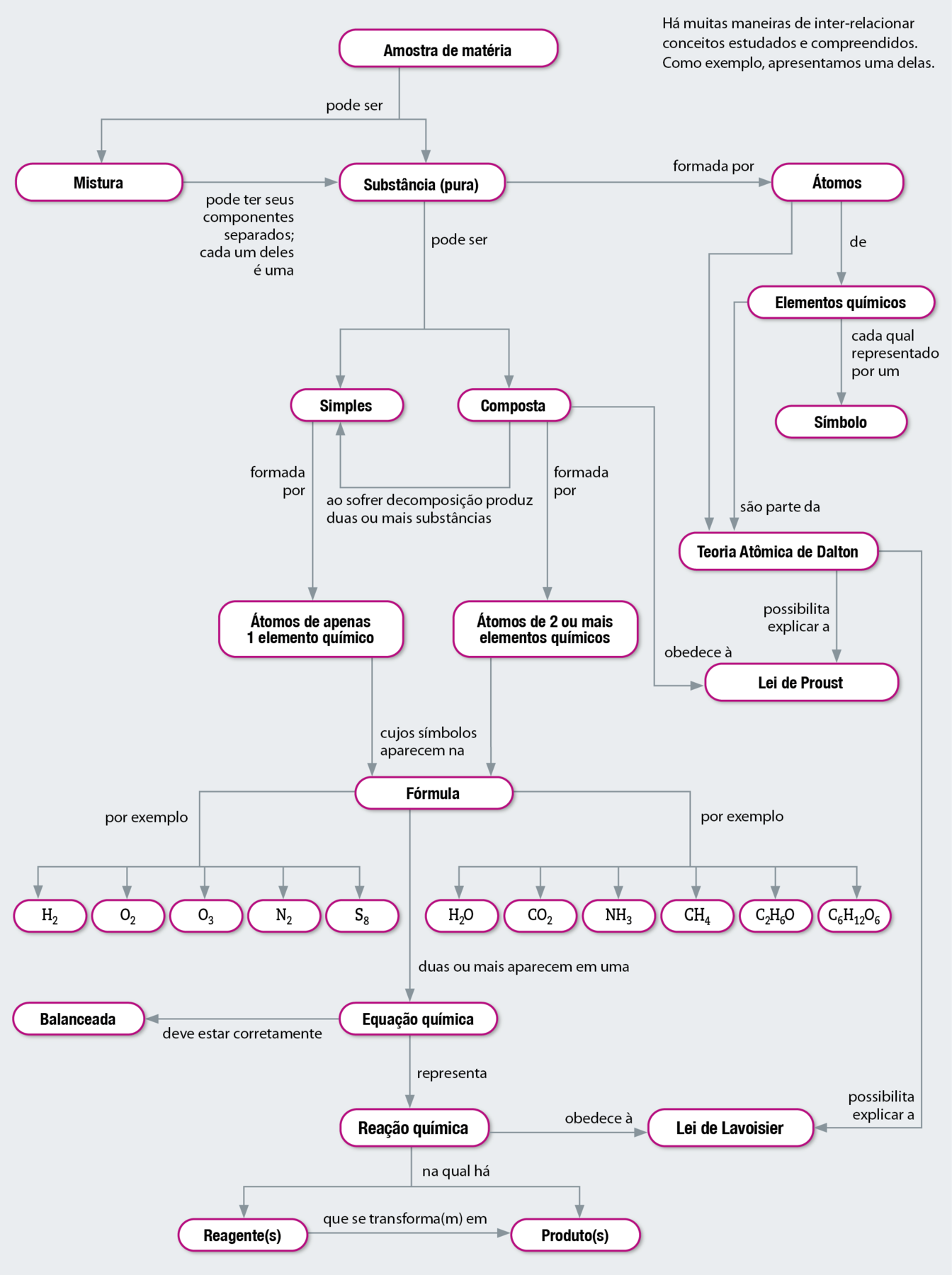
MAPA CONCEITUAL
Respostas e comentários
Projeto
O Projeto 1 (do final do livro) pode ser realizado a esta altura do curso. Ele ensina a fazer e utilizar uma “tinta invisível”, cujo funcionamento pode ser compreendido com o conceito de reação química.
Esse projeto é comentado neste Manual do professor, junto da respectiva ocorrência no final do livro do estudante.
Interdisciplinaridade
Os professores de Ciências e Língua Portuguesa podem abordar o conceito de polissemia, que é a multiplicidade de sentidos que uma palavra pode ter.
Há diversos termos empregados em Ciência e Tecnologia que, no linguajar do dia a dia ou no de outras áreas específicas do conhecimento, têm significado diferente.
Neste capítulo, há vários termos científicos em que ocorre polissemia, tais como: lei, princípio, teoria, elemento e fórmula.
Essa abordagem interdisciplinar pode se estender para a busca de outros exemplos encontrados em Ciências da Natureza. Os colegas de outros componentes podem ser convidados para que a atividade se expanda também a eles.

Atividade
Explore diferentes linguagens
A critério do professor, estas atividades poderão ser feitas em grupos.
INTERPRETAÇÃO DE EXPERIMENTO
Uma amostra de uma substância inicialmente sólida foi aquecida em laboratório, submetida à pressão atmosférica constante de uma cidade ao nível do mar. O gráfico representa a variação da temperatura em função do tempo, durante a realização do experimento.
Curva de aquecimento de uma substância pura em pressão atmosférica ao nível do mar
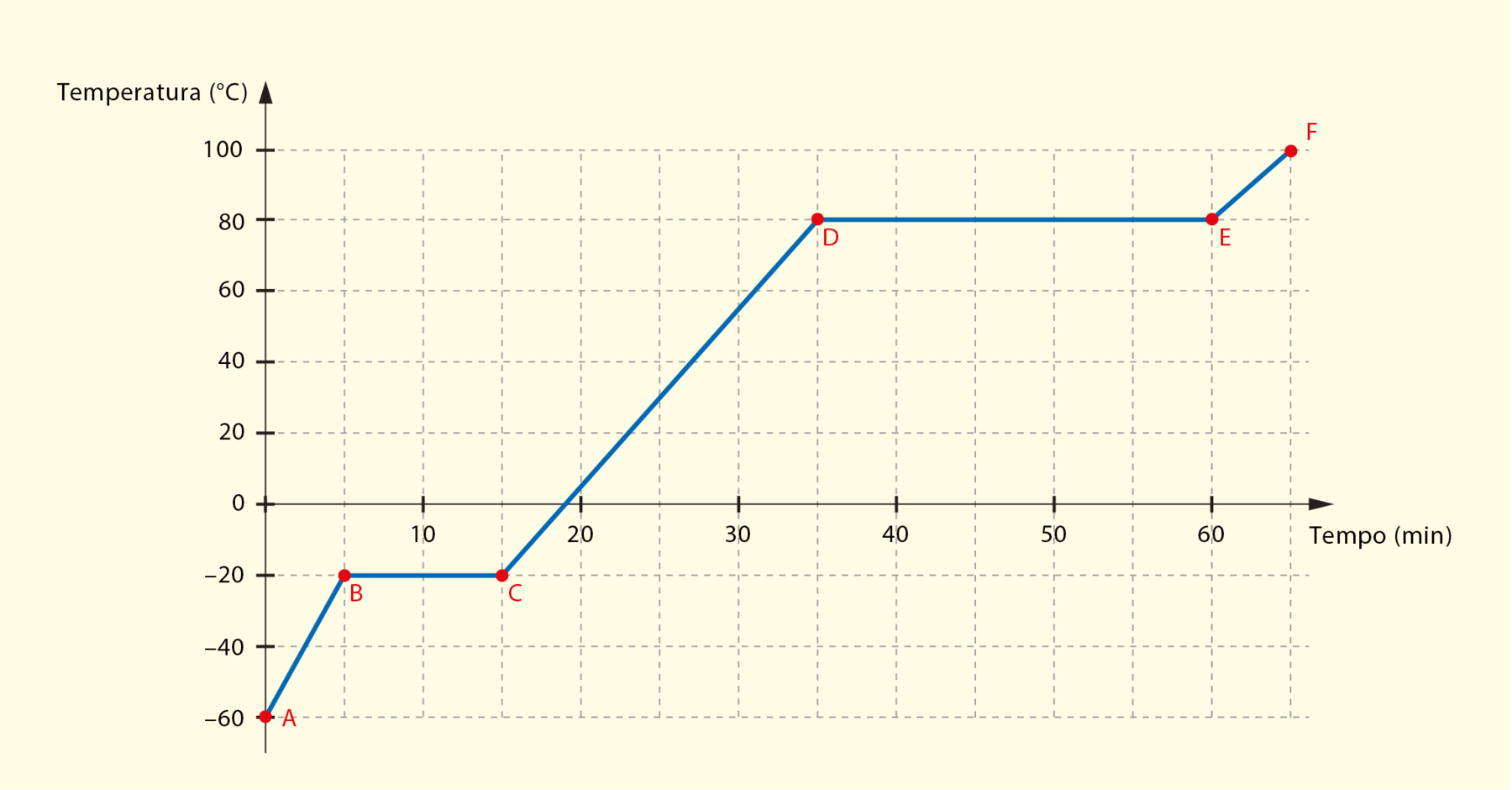
Fonte: Elaborado a partir de bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova iórque: Pearson, 2022. página 536.
- Qual era a temperatura da substância no tempo zero, isto é, quando o experimento começou? Qual ponto no gráfico (A, B, C, D, E) corresponde a essa situação?
- Nos trechos A bê, cedê e ê éfe, o que acontece com a temperatura da substância, à medida que o tempo passa?
- O que ocorre com a temperatura da substância nos trechos bê cê e dê ê, enquanto o tempo passa?
- Em que fase (sólida, líquida ou vapor) está a substância em cada um dos trechos que foram citados na atividade 2?
- Em que fase está a substância no ponto B? E no ponto C? O que ocorre no trecho bê cê?
- Em que fase está a substância no ponto D? E no ponto E? O que acontece no trecho dê ê?
- Qual é a temperatura de fusão dessa substância (na pressão em que o experimento foi realizado)? Quanto tempo levou para a amostra fundir completamente?
- Qual é a temperatura de ebulição dessa substância (na pressão em que o experimento foi realizado)? Quanto tempo levou para a amostra ebulir completamente?
- Se uma amostra dessa substância, inicialmente em fase vapor a 120 graus Célsius, for lentamente resfriada até –30 graus Célsius, nas mesmas condições de pressão em que foi realizado o experimento, a que temperatura é de se esperar que ela sofra condensação? E solidificação? Explique.
Respostas e comentários
Respostas do Explore diferentes linguagens
1. A temperatura da substância no instante inicial (tempo igual a zero) era –60 graus Célsius, correspondente ao ponto A no gráfico.
2. Nos trechos A bê, cedê e ê éfe, à medida que o tempo passa, a temperatura da substância aumenta, ou seja, há aquecimento da substância.
3. Nos trechos bê cê e dê ê, a temperatura da substância permanece constante com o passar do tempo.
4. A bê – Sólida
cedê – Líquida
ê éfe – Vapor
5. B – Sólida
C – Líquida
No trecho bê cê, acontece a fusão da substância, ou seja, ela passa da fase sólida para a fase líquida.
6. D – Líquida
E – Vapor
No trecho dê ê, ocorre a vaporização da substância, ou seja, ela passa da fase líquida para a fase vapor.
7. A temperatura de fusão dessa substância é –20 graus Célsius (na pressão em que o experimento foi realizado). A amostra começou a fundir no instante 5 minutos e terminou de fundir no instante 15 minutos. Então, o intervalo de tempo necessário para a amostra fundir completamente foi de 10 minutos.
8. A temperatura de ebulição dessa substância é 80 graus Célsius (na pressão em que o experimento foi realizado). A ebulição começou no instante 35 minutos e terminou no instante 60 minutos. Portanto, o intervalo de tempo necessário para a amostra ebulir completamente foi de 25 minutos.
9. É de se esperar que a substância sofra condensação a 80 graus Célsius e solidificação a –20 graus Célsius (nas condições de pressão em que o experimento foi realizado).
TABELA
A tabela apresenta as temperaturas de fusão e de ebulição de algumas substâncias, listadas em ordem alfabética. Utilize-a na realização das duas atividades a seguir.
|
Substância |
TF |
TE |
|---|---|---|
|
Água |
0 |
100 |
|
Alumínio |
660 |
2.519 |
|
Benzeno |
6 |
80 |
|
Bromo |
–7 |
59 |
|
Cobre |
1.085 |
2.560 |
|
Estanho |
232 |
2.586 |
|
Fenol |
41 |
182 |
|
Ferro |
1.538 |
2.861 |
|
Gálio |
30 |
2.229 |
|
Iodo |
114 |
184 |
|
Níquel |
1.455 |
2.913 |
Fonte: HAYNES, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 3-4ésse ésse e 4-44ésse ésse.

10. Uma engenheira está projetando uma peça metálica que será usada em um equipamento que operará a 300 graus Célsius e pressão atmosférica ao nível do mar.
Considerando apenas a temperatura de operação do equipamento como critério de seleção, quais dos metais — alumínio, cobre, estanho, ferro, gálio e níquel — poderiam ser usados para fazer a peça que está sendo projetada pela engenheira? Explique sua escolha.
11. Para a realização de um experimento de Química (em um laboratório situado ao nível do mar e adequadamente equipado para seguir todas as normas de segurança), é necessário que as substâncias água, benzeno, bromo e fenol estejam líquidas.
Deduza qual é a faixa de temperatura em que esse experimento deve ser realizado a fim de atender a essa exigência. Justifique sua resposta.
Nessa faixa de temperatura, em que fase estaria o iodo?
GRÁFICO
O gráfico expressa a relação entre massa (ême) e volume (vê) para o níquel e para o titânio.
Relação entre massa e volume para amostras de níquel e de titânio, a 25 graus
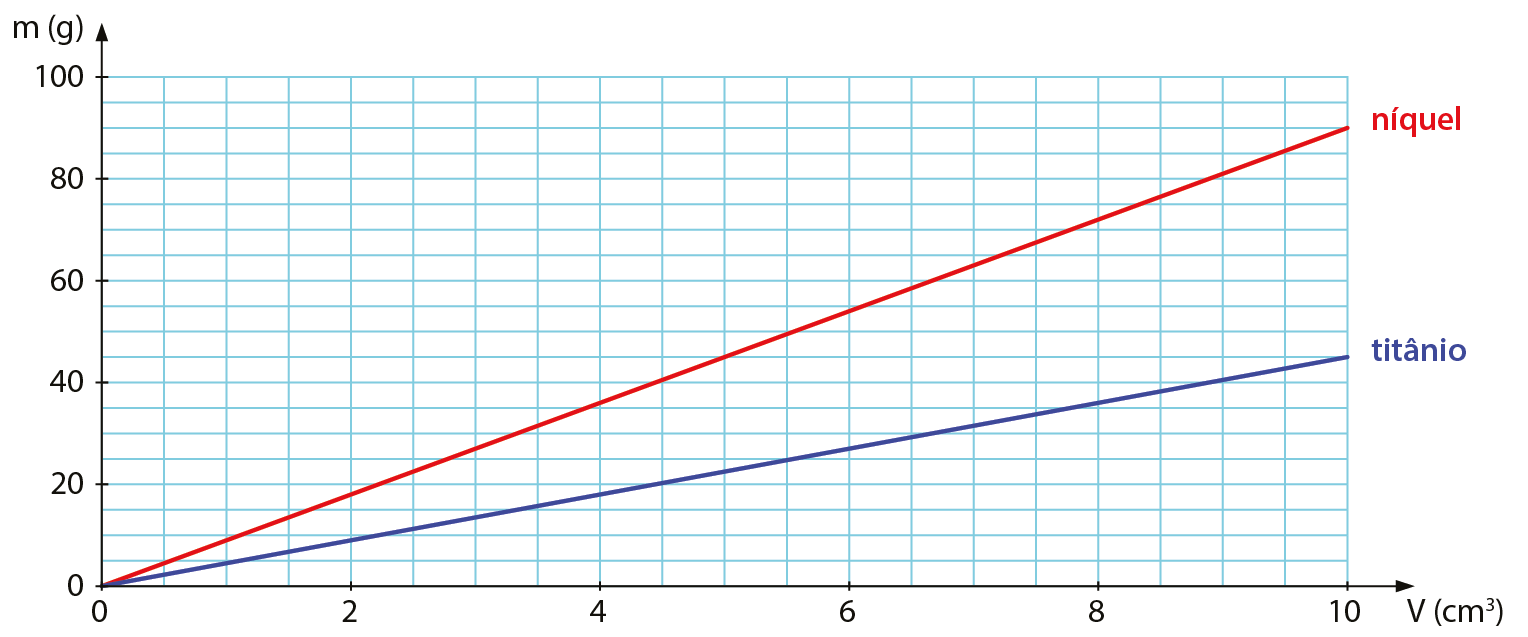
Fonte: Elaborado a partir de dados de HAYNES, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 4-75 e 4-91.
- Um pedaço de níquel e outro de titânio têm o mesmo volume. Qual tem maior massa?
- Considerando amostras de níquel e titânio de mesma massa, qual tem maior volume?
- Qual é a massa de um cubo maciço de níquel de volume 5 centímetros cúbicos?
- Uma esfera maciça de titânio tem massa 45 gramas. Qual é o volume dessa esfera?
- Qual dos dois metais é o mais denso? Quantas vezes ele é mais denso que o outro?
Respostas e comentários
tê cê tê Ciência e Tecnologia
As atividades 10 e 17 propiciam abordar o tê cê tê Ciência e Tecnologia (inserido na macroárea de mesmo nome), percebendo aplicações da Química, a fim de consolidar o conteúdo estudado no capítulo.
De ôlho na Bê êne cê cê!
As atividades da seção Explore diferentes linguagens, ao realizar propostas de interpretação de representações científicas, beneficiam o desenvolvimento da competência geral 4, que propõe utilizar diferentes linguagens, bem como conhecimentos das linguagens matemática e científica, para se expressar e partilhar informações, experiências e ideias em diferentes contextos e produzir sentidos que levem ao entendimento mútuo.
Respostas do Explore diferentes linguagens (continuação)
10. Poderiam ser utilizados os metais alumínio, cobre, ferro e níquel, pois apresentam temperatura de fusão superior a 300 graus Célsius e, portanto, são sólidos na temperatura de operação da máquina. (O gálio e o estanho não servem, pois estão líquidos a 300 graus Célsius.)
11. Das quatro substâncias citadas no enunciado, o fenol apresenta a maior temperatura de fusão (41 graus Célsius). Portanto, para garantir que todas as substâncias estejam líquidas, a temperatura mínima em que o experimento deve ser realizado é 41 graus Célsius.
Das quatro substâncias, o bromo apresenta a menor temperatura de ebulição (59 graus Célsius); então, para assegurar que todas elas estejam em fase líquida, a temperatura máxima em que o experimento deve ser feito é 59 graus Célsius.
Das quatro substâncias, o bromo apresenta a menor temperatura de ebulição (59 graus Célsius). Então, para assegurar que todas elas estejam em fase líquida, a temperatura máxima em que o experimento deve ser feito é 59 graus Célsius.
Assim, para que as quatro substâncias estejam líquidas, o experimento deve ser realizado entre 41 graus Célsius e 59 graus Célsius.
Nessa faixa de temperatura, o iodo é sólido, pois só funde a 114 graus Célsius.
12. Fixando-se um valor qualquer no eixo x (isto é, fixando-se um volume), a leitura do gráfico revela que o pedaço de níquel apresenta maior massa.
13. Fixando-se um valor no eixo y (isto é, fixando-se uma massa; é conveniente que ela seja menor que 45 gramas, para dar leitura nas duas retas dentro da faixa de volumes apresentada), a leitura do gráfico revela que o pedaço de titânio tem maior volume.
14. Considerando 5 centímetros cúbicos, no eixo x do gráfico, é possível ler que a massa que corresponde a esse volume de níquel é 45 gramas.
15. Considerando 45 gramas, no eixo y do gráfico, é possível ler que o volume que corresponde a essa massa de titânio é 10 centímetros cúbicos.
16. Comparando os dois metais, concluímos que o níquel é duas vezes mais denso que o titânio. Utilizando os exemplos de leitura do gráfico das atividades 14 e 15, podemos calcular a densidade dos dois metais. Uma amostra de 45 gramas de titânio apresenta volume 10 centímetros cúbicos e, portanto, a densidade do titânio é 4,5 gramas por centímetro cúbico. No caso do níquel, uma amostra de 45 gramas tem 5 centímetros cúbicos de volume e, assim, a densidade do níquel é 9,0 gramas por centímetro cúbico, o dôbro da densidade do titânio.
EQUAÇÕES QUÍMICAS

17. A siderurgia é o ramo da indústria que visa à obtenção de ferro a partir de minérios de ferro. Um dêsses minérios, denominado hematita, contém a substância óxido ferroso. Nas indústrias siderúrgicas, além do minério, também é empregado carvão, que é constituído da substância carbono. Duas reações químicas que ocorrem nos fornos siderúrgicos podem ser representadas pelas equações químicas a seguir:
carbono mais oxigênio seta para direita monóxido de carbono
óxido ferroso mais monóxido de carbono seta para direita ferro mais dióxido de carbono
- Explique o significado dos sinais de mais (mais) que aparecem nessas equações.
- Esclareça o que a seta (seta para direita) indica nessas equações.
- Expresse, com palavras, o que cada uma das equações químicas representa.
- Quais são os reagentes de cada uma das duas reações químicas?
- Quais são os produtos dessas duas reações químicas?
INTERPRETAÇÃO DE EXPERIMENTOS
Em uma série de experimentos químicos, seguindo todas as normas de segurança laboratorial, as substâncias nitrato de amônio, nitrito de amônio e amônia foram submetidas a condições que provocaram sua decomposição.
Os resultados estão expressos a seguir:
nitrato de amônio seta para direita óxido nitroso mais água
nitrito de amônio seta para direita nitrogênio mais água
amônia seta para direita nitrogênio mais hidrogênio
Duas das substâncias produzidas foram submetidas a condições adequadas para serem decompostas, e os resultados foram:
óxido nitroso seta para direita nitrogênio mais oxigênio
água seta para direita hidrogênio mais oxigênio
Testando as substâncias nitrogênio (ou gás nitrogênio), hidrogênio (ou gás hidrogênio) e oxigênio (ou gás oxigênio), os químicos verificaram que elas não se decompõem em nenhuma circunstância.
Fundamentado nessas informações, realize as atividades 18 a 21.
- No texto, foram citadas oito substâncias. Relacione o nome delas em seu caderno.
- Quais das oito substâncias relacionadas podem ser decompostas em outras substâncias?
- Quais das oito substâncias relacionadas são constituídas de mais de um elemento químico (isto é, são substâncias compostas, ou compostos químicos)? Justifique.
- Deduza quais são os elementos que compõem (isto é, que fazem parte da composição, da constituição química de) cada uma das substâncias respondidas na atividade 19.
Respostas e comentários
17. a) Os sinais de mais (mais) existentes nas equações podem ser lidos como “e”.
b) A seta (seta para direita) indica que as substâncias representadas à esquerda dela transformam-se na ou nas substância ou substâncias ésse à direita.
c) Primeira equação:
Carbono e oxigênio reagem formando monóxido de carbono.
Segunda equação:
Óxido ferroso e monóxido de carbono reagem formando ferro e dióxido de carbono.
d) Os reagentes da primeira reação são carbono e oxigênio, e os da segunda são óxido ferroso e monóxido de carbono.
e) O produto da primeira reação é monóxido de carbono, e os produtos da segunda são ferro e dióxido de carbono.
18. As oito substâncias citadas são: nitrato de amônio, óxido nitroso, água, nitrito de amônio, nitrogênio, amônia, hidrogênio, oxigênio.
19. Nitrato de amônio, nitrito de amônio, amônia, óxido nitroso e água.
20. São substâncias simples: (gás) nitrogênio, (gás) hidrogênio e (gás) oxigênio. A conclusão fundamenta-se no fato de essas substâncias não se decomporem em outras e estas, por sua vez, são substâncias elementares ou podem ser novamente decompostas até que se obtenham substâncias elementares.
21. O nitrato de amônio é composto dos elementos nitrogênio, hidrogênio e oxigênio; o nitrito de amônio é composto de nitrogênio, de hidrogênio e de oxigênio; a água é composta de hidrogênio e de oxigênio; a amônia é composta de nitrogênio e de hidrogênio; o óxido nitroso é composto de nitrogênio e de oxigênio.
Note que a atividade está fundamentada nas informações fornecidas e não requer o conhecimento das fórmulas representativas das substâncias envolvidas.
Para conhecimento do docente, as fórmulas são: nitrato de amônio: êne agáêne ô; nitrito de amônio: êne agáêne ô; amônia: êne agá; óxido nitroso: êneóh; água: agáóh; (gás) nitrogênio: êne; (gás) hidrogênio: agá; e (gás) oxigênio: óh. E as equações químicas que representam as reações mencionadas são:
êne agáêne ô seta para direita êneóh + 2 agáóh litros
êne agáêne ô seta para direita êne + 2 agáóh litros
2 êne agá seta para direita êne + 3 agá
2 êneóh seta para direita 2 êne + óh
2 agáóh litros seta para direita 2 agá + óh
PROPORÇÃO MATEMÁTICA
22. Os seguintes dados referem-se à decomposição da amônia:
|
Decomposição de: |
amônia |
→ |
nitrogênio |
+ |
hidrogênio |
|---|---|---|---|---|---|
|
17 g de amônia |
17 g |
? |
3 g |
||
|
34 g de amônia |
34 g |
28 g |
? |
||
|
51 g de amônia |
51 g |
? |
9 g |
- Use a Lei de lavoziêr para prever os valores que faltam e registre-os no seu caderno.
- Mostre que os valores obtidos obedecem à Lei de prust.
- O metano, também conhecido como “gás dos pântanos”, é uma substância composta pelos elementos carbono e hidrogênio. Considerando os dados a seguir, referentes à decomposição de diferentes quantidades dêsse gás, faça o que se pede nos itens a, b e c.
- Determine o valor de x e explique como chegou a ele.
- Copie os dados em seu caderno e determine os valores que devem ser colocados no lugar das interrogações. Explique o raciocínio que você usou para chegar a eles.
- Com base na resposta do item anterior, pode-se afirmar que a composição do metano, em massa, é de 75% de carbono para 25% de hidrogênio? Explique.
|
Decomposição de: |
metano |
→ |
carbono |
+ |
hidrogênio |
|---|---|---|---|---|---|
|
4 g de metano |
4 g |
3 g |
x |
||
|
8 g de metano |
8 g |
6 g |
? |
||
|
12 g de metano |
12 g |
9 g |
? |
||
|
16 g de metano |
16 g |
? |
? |
||
|
20 g de metano |
20 g |
? |
? |
||
|
100 g de metano |
100 g |
? |
? |
REPRESENTAÇÕES QUÍMICAS
- O ácido nítrico, representado por aga ene ó três, é muito útil na indústria química, especialmente na produção de fertilizantes.
- As indicações “H”, “N” e “óh”, que aparecem nessa representação, são símbolos químicos ou fórmulas químicas? O que indicam?
- A representação “aga ene ó três” é um símbolo químico ou uma fórmula química? O que representa?
- De acôrdo com essa representação, quantos átomos e quantos elementos formam a molécula do ácido nítrico?
MODELO CIENTÍFICO
25. Um dos assuntos dêste capítulo é a interpretação de modelos que representam as substâncias em nível molecular.
As perguntas dos itens a seguir referem-se à interpretação dos desenhos a seguir, nos quais esferas de uma mesma cor representam átomos de um mesmo elemento químico, e esferas de cores diferentes representam átomos de elementos distintos.
Responda, justificando, qual ou quais dos modelos representa ou representam:
- substância pura simples;
- substância pura composta;
- mistura de substâncias.
Respostas e comentários
22. a) Os valores que faltam podem ser obtidos igualando-se a soma das massas de nitrogênio e hidrogênio (produtos) à massa de amônia (reagente):
1ª linha: 14 gramas
2ª linha: 6 gramas
3ª linha: 42 gramas
b) A relação (divisão) entre as massas de nitrogênio e de hidrogênio,
Equação. Massa de nitrogênio sobre massa de hidrogênio
, é constante:
Equação. quatorze gramas sobre 3 gramas igual vinte e oito gramas sobre seis gramas igual quarenta e dois gramas sobre nove gramas.23. a) O valor de x pode ser obtido pela Lei de lavoziêr: x = 1 grama
b) Os demais valores podem ser determinados pela Lei de prust, usando a primeira linha como referência; os valores que faltam na segunda e na terceira linhas também podem ser determinados pela Lei de lavoziêr (como em a):

c) A última linha permite afirmar que 100 gramas de metano contém 75 gramas de carbono e 25 gramas de hidrogênio. Portanto, a afirmação é correta.
24. a) Símbolos químicos; representam elementos:
- H: indica hidrogênio;
- N: indica nitrogênio;
- O: indica oxigênio.
b) Fórmula química, que representa a molécula da substância: nela, há um átomo de hidrogênio, um de nitrogênio e três de oxigênio.
c) 5 átomos / 3 elementos.
25. Correspondem a substâncias puras aquelas amostras formadas pelo mesmo tipo de molécula, o que está mostrado apenas nos desenhos 1, 2, 3 e 4.
a) Quando as moléculas de uma substância pura são formadas por átomos de um mesmo elemento químico, trata-se de uma substância pura e simples. Isso corresponde aos desenhos 2 e 3.
b) Quando as moléculas de uma substância pura são formadas por átomos de dois ou mais elementos químicos, trata-se de uma substância pura e composta. Isso corresponde aos desenhos 1 e 4.
c) Misturas de substâncias estão representadas nos desenhos 5, 6, 7 e 8, em que há dois ou mais tipos diferentes de moléculas. Cada tipo de molécula representa uma substância componente da mistura.
26. Para os modelos da atividade anterior, considere a legenda:

- Procure no texto dêste capítulo o símbolo de cada um dêsses elementos químicos e escreva-os em seu caderno.
- Escreva a fórmula em cada um dos desenhos de 1 até 8 da atividade anterior.
27. Considerando o código ilustrado na legenda, escreva a fórmula que representa cada uma das seguintes moléculas.

- Este esquema representa um sistema antes e depois de uma reação química. As esferas vermelhas indicam átomos de oxigênio, e as azuis, átomos de nitrogênio.
- Escreva as fórmulas dos reagentes e do produto.
- Represente a reação que ocorreu por meio de uma equação química. Não se esqueça de balanceá-la.
Respostas e comentários
26. a) Hidrogênio: H
Flúor: F
Oxigênio: O
Carbono: C
b) 1.
2. óh
3. óh
4. cê agá
5. éfe e óh
6. agá, e éfe
7. óh e óh
8. cê agá e cêagá
Não há, em princípio, obrigatoriedade de os estudantes “adivinharem” a ordem em que habitualmente escrevemos os elementos químicos nas fórmulas. Assim, se algum estudante escrever agácê em vez de cê agá, ele estará correto à luz das informações de que dispõe.
É interessante comentar que há um costume para a ordem dos símbolos na fórmula e que você vai usá-la em sala, para os estudantes se habituarem a ela. Não há razão, porém, para cobrar tal conhecimento no 9º ano. Interpretar corretamente a quantidade e a diversidade de átomos numa molécula já é um importante passo para esse nível de escolaridade. Este comentário é extensivo às próximas atividades.
27. 1) éle
2) agáóh
3) agáóh
4) cêagá
5) cêagá
6) êne ô
7) êneóh
8) êne ô
9) cê ó
10) cê ó
11) ésse ô
12) ésse ô
13) agáésse ô
14) cê agáóh
15) cêagáóh
16) êne agá
17) êneagá
18) cêéleóh
19) agá cê éle ó três
20)
28. a) Reagentes: êne ô e óh.
Produto: êne ô.
b) No desenho inicial, há 4 moléculas de êne ô e duas moléculas de óh. No desenho final, há 4 moléculas de êne ô. Assim, concluímos que 4 moléculas de êne ô e duas moléculas de óh se transformaram em 4 moléculas de êne ô.
Isso pode ser equacionado como:
4 êne ô mais 2 ó dois seta para direita 4 êne ô
Mas, buscando a simplicidade dos menores números inteiros, podemos (de modo mais adequado) representá-la como:
2 êne ô mais ó dois seta para direita 2 êne ô
29. Nos desenhos, esferas de mesma cor indicam átomos de um mesmo elemento químico e esferas de cores diferentes, átomos de elementos distintos.
O desenho da situação inicial representa moléculas inicialmente presentes em um sistema. Após uma reação química envolvendo essas moléculas, sabe-se que o sistema final corresponde a um dos desenhos de A a F. Analise-os e conclua qual deles corresponde à situação final do sistema. Justifique, para cada um dos desenhos, por que ele pode ou não representar a situação final.
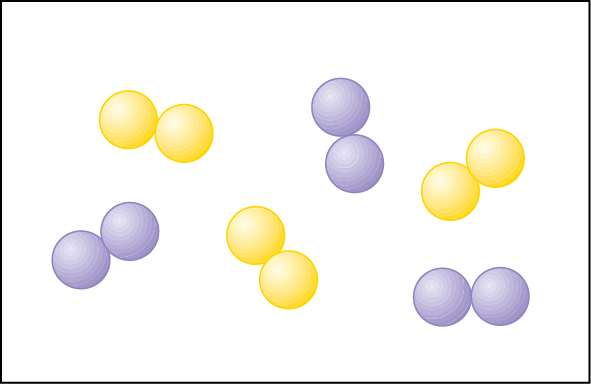
Situação inicial. Os átomos que formam as moléculas estão representados por esferas em cores fantasiosas e ampliados dezenas de milhões de vezes.
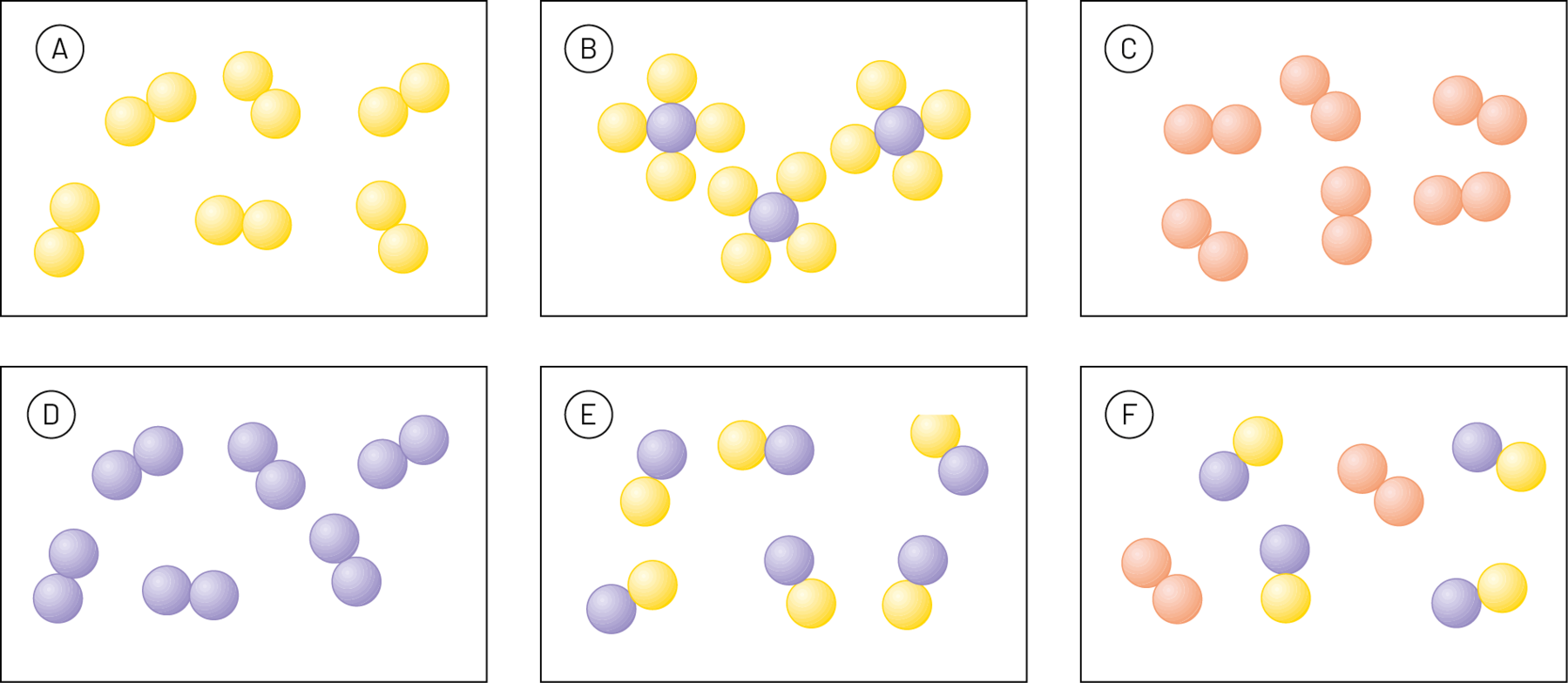
- Equação química é uma representação para determinada reação química. Como foi visto neste capítulo, todos os átomos presentes nos reagentes devem estar presentes nos produtos. Verifique se cada uma das equações químicas está balanceada e, no caso de não estar, faça o balanceamento.
- agá dois ó mais cê ó seta para direita agá mais cê ó
- ésse ô mais óh seta para direita ésse ô
- agáóh seta para direita agáóh mais óh
- cê ó mais óh seta para direita cê ó
- êne mais agá seta para direita êne agá
MODELO CIENTÍFICO
31. No seu caderno, represente cada uma das reações químicas equacionadas na atividade anterior. Utilize esferas coloridas para representar os átomos; uma cor para cada elemento químico.
Seu aprendizado não termina aqui
Neste capítulo, você estudou que a decomposição da água produz gás oxigênio e gás hidrogênio, e que este último é combustível e oferece sério risco de explosão. Apesar disso, já há muitos estudos para o desenvolvimento de uma tecnologia segura para aproveitar o gás hidrogênio como combustível em automóveis. Nos próximos anos, é bastante provável que novidades sejam anunciadas. Esteja atento às notícias sôbre isso.
Respostas e comentários
29. No sistema inicial, há 6 átomos do elemento representado em roxo – vamos adotar para ele o símbolo R – e 6 do representado em amarelo – vamos adotar para ele o símbolo A.
Assim:
A. Não pode representar a situação final, porque desapareceram átomos de R e apareceram átomos de A.
B. Não pode representar a situação final, porque desapareceram átomos de R e apareceram átomos de A.
C. Não pode representar a situação final, porque desapareceram átomos de R e de A e, além disso, apareceram átomos de um outro elemento (que está representado em outra cor).
D. Não pode representar a situação final, porque desapareceram átomos de A e apareceram átomos de R.
E. Pode representar a situação final, porque a quantidade dos átomos se mantém inalterada; os átomos apenas se recombinaram, de moléculas de e a em moléculas de érre á.
F. Não pode representar a situação final, porque desapareceram átomos de R e de A e, além disso, apareceram átomos de outro elemento.
30. a) Já está balanceada.
b) 2 ésse ô mais óh seta para direita 2 ésse ô
c) 2 agáóh seta para direita 2 agáóh mais óh
d) 2 cê ó mais óh seta para direita 2 cê ó
e) ene dois mais 3 agá dois seta para direita 2
31. Exemplos de respostas estão a seguir. A legenda é:
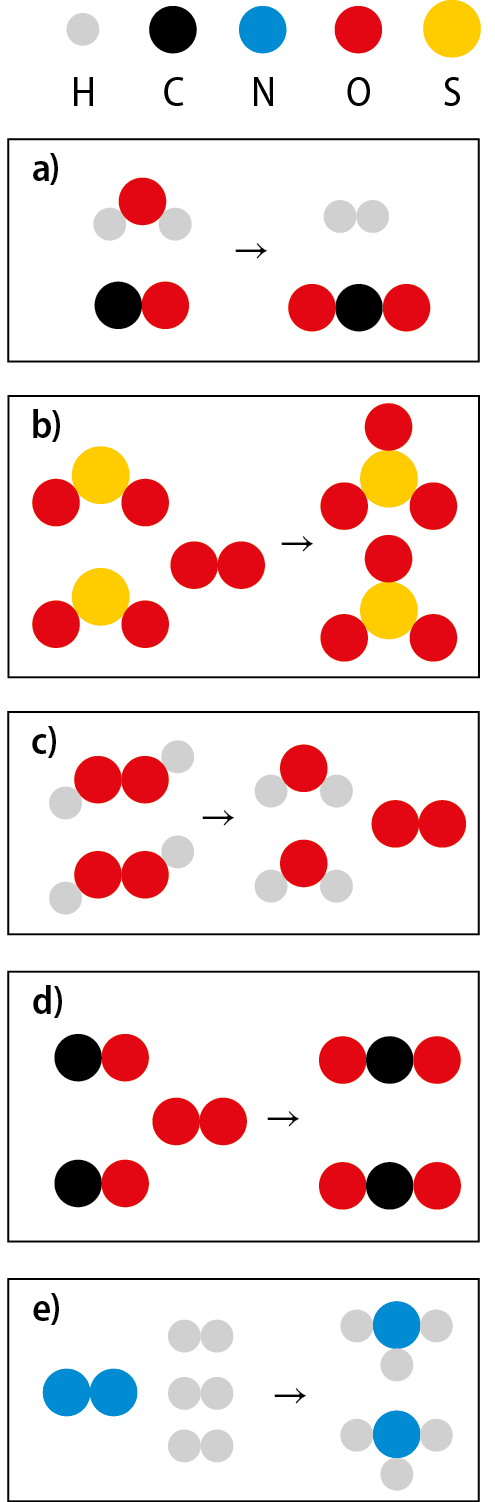
De ôlho na Bê êne cê cê!
A seção Seu aprendizado não termina aqui volta a oportunizar o desenvolvimento da competência específica 4, já mencionada neste capítulo.