
CAPÍTULO 2 Cargas elétricas e modelo atômico de Ruterfór

Respostas e comentários
Este capítulo e seus conteúdos conceituais
- Interação entre cargas elétricas
- Eletrização por atrito
- Condutores elétricos e isolantes elétricos
- Eletrização por contato
- Aterramento de um objeto
- Descargas elétricas
- Noções sôbre a época em que foram descobertos elétron, próton e nêutron
- Modelo atômico proposto por Ruterfór
- Número atômico
- Número de massa
- Conceituação moderna de elemento químico
- Isótopos
- Estrutura da tabela periódica: períodos e grupos
- Metais e não metais
- Elementos representativos, de transição e de transição interna
Podemos reconhecer, dentro do capítulo, dois grandes blocos de conteúdos conceituais, que, por sua vez, podem ser subdivididos em outros menores.
O primeiro deles aborda as cargas elétricas e suas interações. Suas subdivisões são três:
- Na primeira, mostra-se a eletrização por atrito e introduzem-se os conceitos de carga elétrica e de interação entre cargas. O livro não faz um tratamento quantitativo da fôrça elétrica (Lei de cúlomb, assunto tradicionalmente abordado no Ensino Médio).
- Na segunda, são apresentados os conceitos de isolante elétrico, de condutor elétrico e de eletrização por contato.
- Na terceira, o capítulo discute o que é o aterramento de um objeto e o que são as descargas elétricas (propiciando a compreensão da origem dos raios e também dos choques que uma pessoa pode levar quando está eletrizada e toca em objetos metálicos).
O segundo grande bloco aborda o modelo atômico de Ruterfór, apresenta a conceituação atual de elemento químico (vinculada ao conhecimento de número atômico), introduz a tabela periódica dos elementos e discute o conceito de isótopos. Esse segundo bloco explora aspectos introdutórios da natureza elétrica da matéria. Para maior clareza, podemos subdividi-lo em blocos menores:
- Noções sôbre a estrutura elétrica da matéria, incluindo o modelo de átomo constituído por prótons, nêutrons e elétrons.
- Retomada do conceito de elemento químico (já abordado, de fórma introdutória, no capítulo anterior), ampliando-o para o modo como é usado atualmente.
- Representação de um átomo na qual se utilizam símbolo, número atômico e número de massa.
- Apresentação da tabela periódica e terminologias a ela relacionadas.
- Discussão do conceito de isótopo, que permite reforçar o conceito de elemento químico.
Estimule os estudantes a responder em voz alta às perguntas da legenda da foto de abertura e aproveite-as para identificar as concepções prévias deles sôbre cargas elétricas.
Não se preocupe em formalizar conceitos ou corrigir erros neste momento. Ouça e registre os saberes manifestados pelos estudantes.
Cientificamente corretas ou não, as ideias pregressas servem de âncoras para novos conhecimentos, que, à medida que são construídos, podem provocar a reelaboração dos próprios saberes que serviram para sua ancoragem, modificando-os.
Nesse sentido, a identificação do que os estudantes pensam antes de iniciar o capítulo possibilita que você direcione a abordagem com maior eficiência, buscando aproveitar e reformular saberes.
Você pode retomar as respostas dadas após o item 7 do capítulo, convidando os estudantes a refletir sôbre elas e reformulá-las.
De ôlho na Bê êne cê cê!
As perguntas motivadoras da legenda da foto de abertura do capítulo incentivam a analisar, compreender e explicar características, fenômenos e processos relativos ao mundo natural, exercitando a curiosidade para fazer perguntas e buscar respostas com base nos conhecimentos das Ciências da Natureza. Assim, favorecem o desenvolvimento da competência específica 3.
Motivação

Objetivo

Observar uma situação de eletrização por atrito e evidenciar a atração entre corpos eletrizados com cargas elétricas de diferentes sinais.
Você vai precisar de:
- um balão de borracha
- ajuda de colegas
Versão adaptada acessível
Analisar uma situação de eletrização por atrito e evidenciar a atração entre corpos eletrizados com cargas elétricas de diferentes sinais.
Você vai precisar de:
• um balão de borracha
• ajuda de colegas
Orientação para acessibilidade
Caso haja estudantes cegos ou com baixa visão na turma, a atividade pode ser feita em grupos, em que os estudantes videntes descrevem o ocorrido e os orientam a tocar o cabelo do colega para perceber a alteração.
Procedimento
- Faça esse experimento em um dia sêco. Encha o balão e feche-o com um nó.
- Esfregue o balão vigorosamente no cabelo por cêrca de um minuto. O cabelo deve estar sêco e sem creme, gel ou outros produtos.
- Pare de esfregar o balão, mantenha-o encostado ao cabelo e posicione-se como na figura.
- Solte o balão e peça a seus colegas que observem o que ocorrerá. A seguir, é sua vez de observar e de outro colega fazer o mesmo que você fez. Tente explicar o que foi observado.

Desenvolvimento do tema
1. Eletricidade
O experimento anterior tem a ver com a eletricidade. Para muitas pessoas, a palavra eletricidade faz lembrar coisas como eletrodomésticos, computadores, conta de energia elétrica, pilhas e baterias, iluminação e motores elétricos.
A eletricidade, no entanto, é muito mais do que isso. Fenômenos (acontecimentos) de origem elétrica são presenciados há muito tempo pela humanidade.
Neste capítulo, vamos estudar alguns dos fundamentos da Eletricidade, uma importante área científica cujas aplicações estão bastante presentes na vida dos seres humanos. Aprenderemos algo sôbre as cargas elétricas e as interações atrativas ou repulsivas que ocorrem entre elas.
2. Cargas elétricas
Cargas elétricas são de dois tipos: positivas e negativas
Um experimento relacionado aos primórdios do estudo da eletricidade pode ser realizado com um bastão de vidro pendurado por um barbante.
Se atritarmos esse bastão em um pedaço de lã, notaremos que ambos se atraem mutuamente. Veja a figura A.
ATENÇÃO!
Por razão de segurança, para realizar qualquer experimento de Eletricidade, você deve ter a AUTORIZAÇÃO e a SUPERVISÃO de seu professor, mesmo que aparente ser algo inofensivo.
Respostas e comentários
Motivação
Para realização da atividade prática proposta, peça aos estudantes que se organizem em grupos de três e leiam atentamente o procedimento.
Esteja atento à correta realização, circulando entre os grupos durante a execução e auxiliando-os caso tenham alguma dificuldade.
Essa atividade abre caminho para os conceitos inicialmente apresentados no capítulo, especialmente dos itens 1 a 5, e para desenvolver competências da Bê êne cê cê (veja a seguir).
De ôlho na Bê êne cê cê!
O experimento do balão de borracha, proposto na seção Motivação e retomado no item 3, favorece o desenvolvimento: da competência geral 2, por objetivar exercitar a curiosidade intelectual e recorrer à abordagem própria das ciências, incluindo a investigação, a reflexão, a análise crítica, a imaginação e a criatividade, para investigar causas, elaborar e testar hipóteses, formular e resolver problemas com base nos conhecimentos das diferentes áreas; e da competência específica 2, ao inspirar a compreensão dos conceitos fundamentais e estruturas explicativas das Ciências da Natureza, bem como dominar processos, práticas e procedimentos da investigação científica, de modo a sentir segurança no debate de questões científicas, tecnológicas e do mundo do trabalho e continuar aprendendo.
Se atritarmos o bastão de vidro no tecido de lã, o deixarmos pendurado e aproximarmos dele outro bastão de vidro que tenha sido friccionado em outro pedaço de lã, notaremos que os bastões se repelem, conforme está esquematizado na figura B.

Fonte: Elaborada a partir de , R. êti áli. Physics for scientists and engineers: an interactive approach. segunda edição Toronto: Nelson Education, 2019. página 659.
Essas observações demonstram a ocorrência de fenômenos elétricos. Ao atritarmos os materiais vidro e lã, o bastão de vidro passa a ser portador de carga elétrica positiva, e o pedaço de lã, de carga elétrica negativa (veja a figura C). Os sinais de positivo e negativo atribuídos a essas cargas nos esquemas são uma convenção científica.
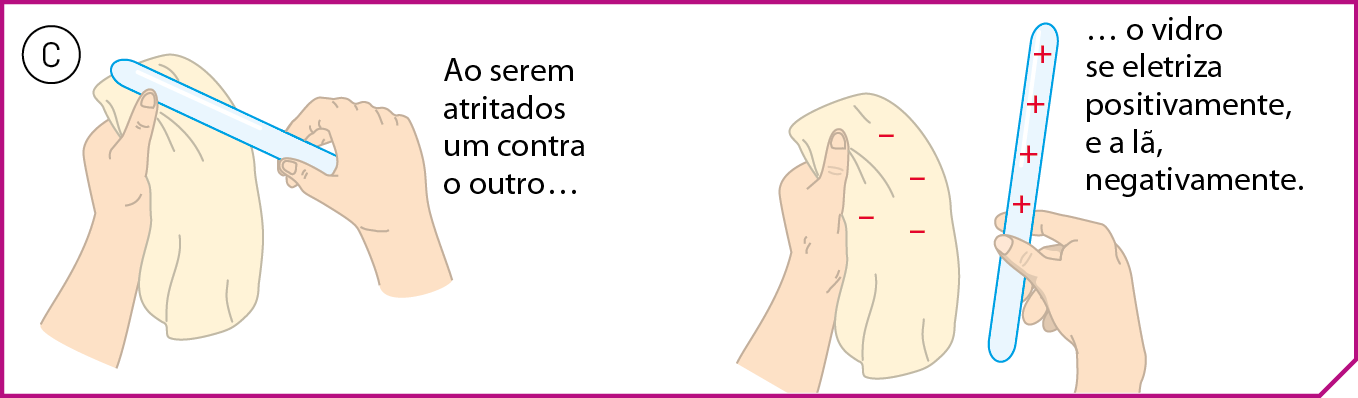
Fonte: Elaborada a partir de , R. êti áli. . . página 659.

Cargas elétricas interagem
Quando atritados em outros, muitos materiais ficam eletrizados, isto é, adquirem carga elétrica. Nesse processo, um dos materiais adquire carga elétrica positiva, e o outro, carga elétrica negativa.
Por meio de experimentos semelhantes aos descritos anteriormente com o vidro e a lã, os cientistas concluíram que cargas elétricas de sinais diferentes se atraem e que cargas elétricas de sinais iguais se repelem. Quando vidro e lã são friccionados, passam a ter cargas elétricas de sinais diferentes e, portanto, passam a se atrair. Já os dois bastões de vidro, quando adquirem cargas elétricas de mesmo sinal, passam a se repelir. (Veja as figuras D e E.)
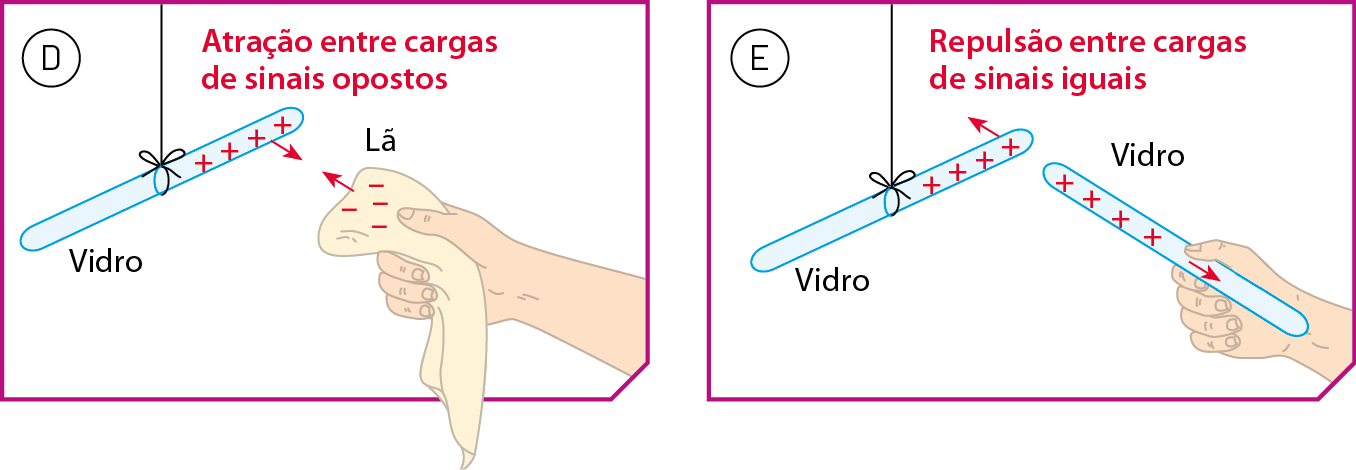
Fonte: iãng, H. D.; FREEDMAN, R. A. University Physics. décima quinta edição Harlow: Pearson, 2020. página 707.
Respostas e comentários
Itens 1 a 3
Nos itens 1 e 2, apresente os conceitos introdutórios referentes às cargas elétricas e sua atração ou repulsão, conforme o texto do livro do estudante. Analise as imagens juntamente com os estudantes, pois elas são importantes na preparação para o restante do capítulo.
No item 2, aproveitando o quadro Atenção!, discuta, desde já, a necessidade de cuidados referentes à eletricidade e retome-os ao trabalhar os temas aterramento de objetos (item 6) e para-raios (item 7).
No item 3, explique, usando a sequência representada pelas setas, que diferentes materiais apresentam diferentes tendências à eletrização por atrito. (Para conhecimento do docente, a sequência apresentada é denominada série triboelétrica.)
Para ampliar o trabalho de interpretação da série apresentada, proponha questões aos estudantes:
1. O que vai acontecer se um bastão de borracha rígida for atritado em um pedaço de seda?
2. O que vai acontecer se um bastão de vidro for atritado em um pedaço de seda?
3. O que vai acontecer se um bastão de borracha rígida for atritado em um pedaço de pano feito de algodão?
4. O que vai acontecer se um bastão de vidro for atritado em um pedaço de pano feito de algodão?
As respostas esperadas, com base nas setas indicadas na série que está no livro do estudante, são:
1. O bastão de borracha rígida se eletrizará com carga negativa e o pedaço de seda, com carga positiva.
2. O bastão de vidro se eletrizará com carga positiva e o pedaço de seda, com carga negativa.
3. O bastão de borracha rígida se eletrizará com carga negativa e o pano de algodão, com carga positiva.
4. O bastão de vidro se eletrizará com carga positiva e o pano de algodão, com carga negativa.
Esse tipo de atividade permite que os estudantes percebam o caráter preditivo dos conhecimentos científicos acerca de um tema, no caso, a eletrização por atrito.
No final do item 3, dê especial atenção à explicação do resultado do experimento da abertura. Ao revisitar o resultado obtido e auxiliar os estudantes a explicá-lo, aproveite os resultados da simulação sugerida no Use a internet do item 3 (comentada à frente).
A interação entre dois corpos portadores de cargas elétricas é um acontecimento mútuo, em que um deles atua sôbre o outro, exercendo uma fôrça sobre ele, e esse outro corpo atua simultaneamente sôbre o primeiro, também exercendo uma fôrça sôbre ele. Em outras palavras, sôbre cada um dos dois corpos atua uma fôrça que se deve à presença do outro.
Se os dois corpos apresentam cargas de sinais opostos, as fôrças tendem a fazê-los se aproximar (figura F). No entanto, se os dois corpos possuem cargas de mesmo sinal, as fôrças tendem a fazê-los se afastar (figura G).
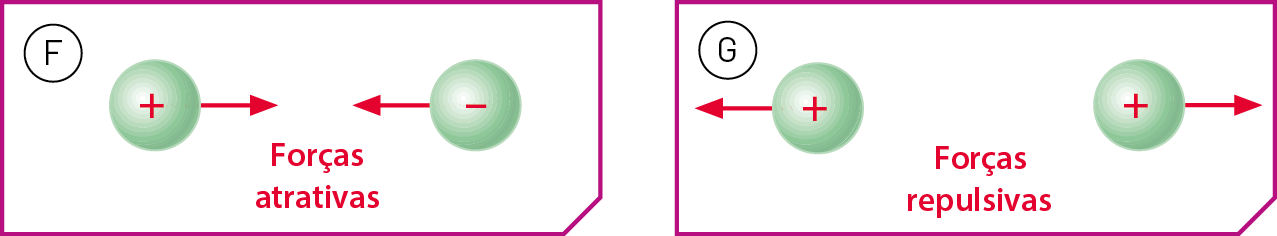
Fonte: , A. Physics. quinta edição Nova iórqueMcGraw-Hill, 2020. página 594.
3. Eletrização por atrito
Diferentes materiais têm diferentes tendências à eletrização
Quando vidro e lã são atritados, dizemos que ambos os materiais adquirem carga elétrica pelo processo de eletrização por atrito.
Com base em muitos experimentos similares, foi possível aos cientistas determinar a tendência dos materiais a adquirir carga elétrica positiva ou negativa, quando atritados uns com os outros. Essa tendência pode ser expressa por meio de uma sequência como a mostrada a seguir:

Com base nessa sequência, podemos afirmar, por exemplo, que a lã adquire carga negativa se atritada com um bastão de vidro (figura A), mas carga positiva se atritada com um bastão de borracha rígida (figura B).
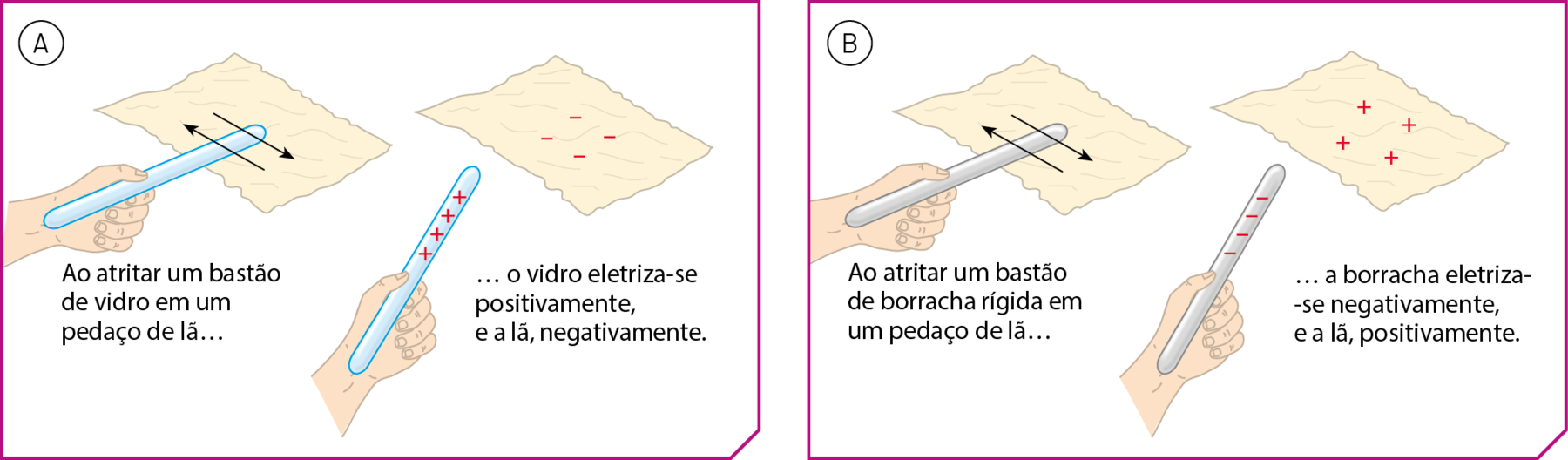
Fonte: iãng, H. D.; FREEDMAN, R. A. University Physics. décima quinta edição Harlow: Pearson, 2020. página 707.

Use a internet
Teste a eletrização por atrito entre um balão de borracha e uma roupa de lã no simulador disponível em: https://oeds.link/2tkHfA. Acesso em: 6 junho 2022.
Respostas e comentários
Use a internet
O simulador sugerido permite aos estudantes analisar diferentes fórmas de eletrização, visualizando as cargas. Deixe que explorem livremente e solicite, após a atividade, que descrevam o que descobriram.
Ao final, é interessante que você arremate a atividade verificando o entendimento dos pontos mais relevantes. Para isso, se possível, projete o simulador (ou peça aos estudantes que acompanhem, divididos em grupos, cada qual em um dispositivo conectado ao simulador, repetindo os passos executados por você). Inicie clicando na opção Mostrar cargas resultantes. Atrite o balão no casaco de lã e peça que expliquem por que o balão fica aderido a ele. Note que, conforme a indicação do simulador, o balão fica eletrizado negativamente, e a lã, positivamente.
A seguir, clique na opção Sem parede e arraste o balão para longe do casaco. Ao soltá-lo, ele será atraído em direção à lã, caracterizando a fôrça elétrica entre objetos eletrizados como uma interação que ocorre à distância, independentemente do contato.
Clique no ícone para reiniciar a simulação (botão redondo que contém uma seta circular) e repita os procedimentos executados. Neste caso, como você manteve a opção Mostrar todas as cargas acionada, será possível mostrar que a matéria eletricamente neutra contém cargas elétricas positivas e negativas em quantidades iguais e que a eletrização por atrito transfere cargas negativas de um objeto para outro.
Em seguida, aproxime o balão eletrizado da parede (caso ela não esteja visível, clique na opção Com parede) e verifique se os estudantes entenderam que a aderência do balão à parede se deve a uma reorganização das cargas elétricas da superfície da parede provocada pela interação com o balão eletrizado.
De ôlho na Bê êne cê cê!
Os boxes Use a internet dos itens 3, 7 e 9, ao sugerir links interativos complementares aos temas explorados, auxiliam no desenvolvimento da competência geral 5, estimulando a compreender e utilizar tecnologias digitais de informação e comunicação de fórma crítica, significativa e reflexiva para se comunicar, acessar e disseminar informações, produzir conhecimentos, resolver problemas e exercer protagonismo e autoria na vida pessoal e coletiva.
O experimento do balão de borracha
Já é possível interpretar o resultado do experimento do início do capítulo. Quando o balão de borracha é atritado no cabelo, ocorre eletrização por atrito.
Uma vez eletrizados, o balão e o cabelo passam a ser portadores de cargas elétricas de sinais opostos e, por isso, passam a se atrair.

4. Condutores elétricos e isolantes elétricos
Imagine duas esferas de metal um pouco afastadas entre si, uma delas eletrizada com carga negativa e a outra não eletrizada. Se um bastão de metal tocar as duas esferas simultaneamente, verifica-se que parte da carga elétrica é transferida para a outra esfera (figura A). Porém, se utilizássemos um bastão de madeira, a carga permaneceria na esfera eletrizada, e a outra não receberia nem um pouco dessa carga (figura B).
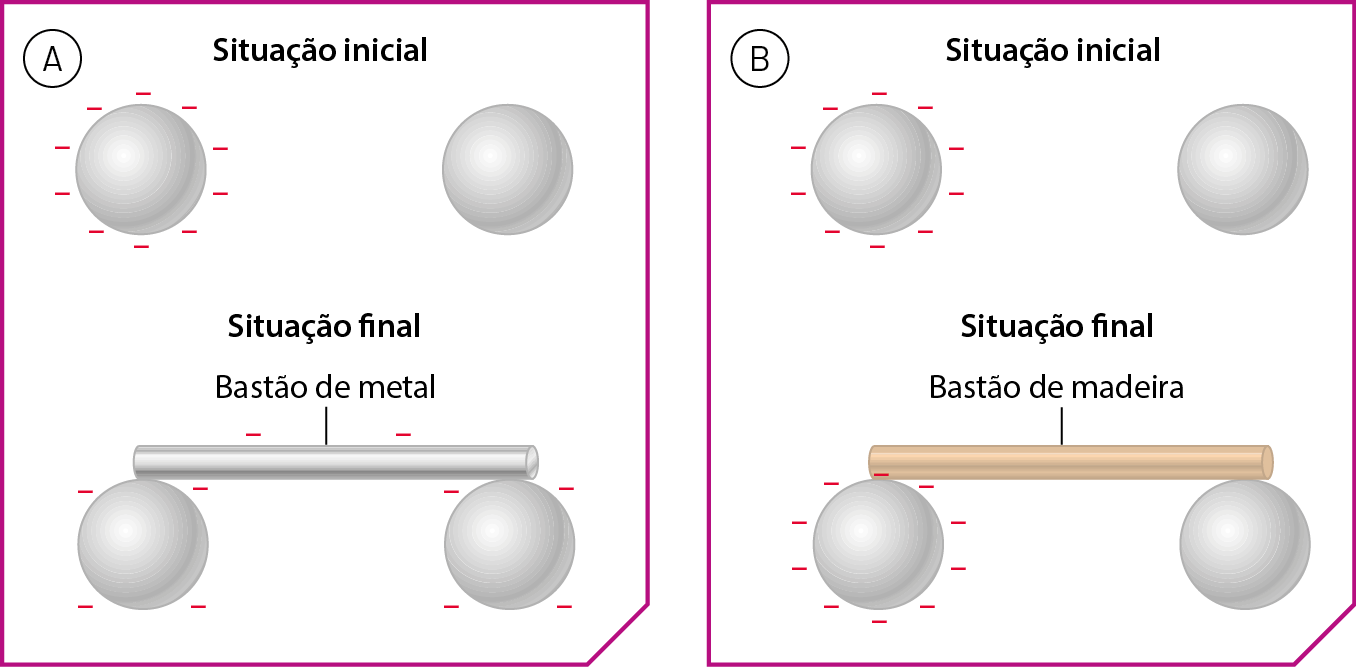
Fonte: Elaboradas a partir de iãng, D.; , S. Cutnell & Johnson Physics. décima primeira edição Hoboken: John Wiley, 2018. página 493.
Esse experimento evidencia que o metal é um material condutor elétrico e que a madeira é um material isolante elétrico.
De fato, os condutores elétricos mais conhecidos são os metais, tais como o cobre, o ferro, o alumínio, o ouro e a prata. Entre eles, o cobre, metal de aspecto marrom-avermelhado, é usado na fiação elétrica das casas e edifícios de apartamentos.
Entre os isolantes elétricos podemos citar, além da madeira, os plásticos em geral, o ar (a temperatura e pressão ambientes) e as borrachas.
A maioria dos materiais conhecidos se encaixa em um dêstes dois grupos: condutor elétrico ou isolante elétrico. Há, contudo, certos materiais que não se enquadram bem em nenhuma dessas duas categorias, mas, sim, em um grupo intermediário, conhecido como semicondutores. Dois exemplos são o silício e o germânio, empregados na indústria para elaborar alguns componentes usados em aparelhos eletrônicos.


ATENÇÃO!
A parte interna de equipamentos elétricos pode oferecer RISCO DE QUEIMADURAS, CHOQUE ELÉTRICO E MORTE, às vezes mesmo depois de desligados da tomada. Por isso, a abertura e o conserto dêsses equipamentos devem ser feitos por profissionais treinados para isso.
Respostas e comentários
Conteúdos procedimentais sugeridos
- Manipular materiais simples para realizar um experimento de eletrização por atrito.
- Montar um modelo de átomo que respeite as proporções entre raio do núcleo e raio da eletrosfera, escolhendo o objeto mais adequado para representar o núcleo, a fim de que o átomo representado caiba na sala de aula ou, pelo menos, no terreno da escola.
- Consultar a tabela periódica dos elementos de modo a obter informações sôbre nome, símbolo e número atômico dos elementos.
- De posse da tabela periódica, determinar, para certo átomo neutro, o número de prótons, o de elétrons e o de nêutrons.
Manipular materiais simples para realizar um experimento de eletrização por atrito é o que se pretende desenvolver com o experimento que abre o capítulo.
O segundo conteúdo procedimental listado para este capítulo pode ser realizado com a Sugestão de atividade, mais à frente.
Os demais podem ser desenvolvidos com as atividades do final do capítulo, das seções Use o que aprendeu e Explore diferentes linguagens.
5. Eletrização por contato
Quando um corpo eletrizado toca um corpo eletricamente neutro (isto é, sem carga elétrica), parte de sua carga é transferida para ele, que também passa a ficar eletrizado. Esse processo é a eletrização por contato.
Na figura A, um bastão de vidro positivamente eletrizado toca uma pequena esfera de metal, eletricamente neutra, suspensa por um fio. Nesse contato, a carga positiva se distribui entre o bastão e a esfera, de modo que ela também fica eletrizada positivamente. Com isso, a esfera passa a ser repelida pelo bastão, como indica a figura B.
Na figura C, um bastão de borracha negativamente eletrizado toca uma pequena esfera de metal, eletricamente neutra, suspensa por um fio. Parte da carga negativa é transferida do bastão para a esfera, eletrizando-a negativamente. Com isso, ela passa a ser repelida pelo bastão, como mostra a figura D.
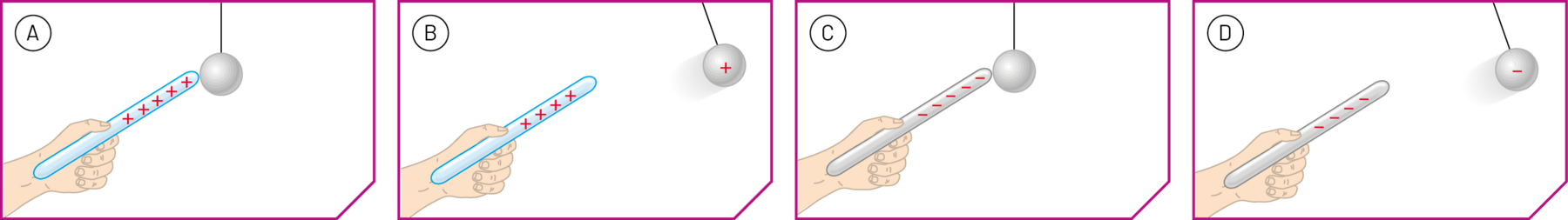
Fonte: Elaboradas a partir de Kraúskopf K. B.; Báiser, A. The physical universe. décima quinta edição Nova iórqueMcGraw-Hill, 2020. página 188-191.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• eletrização por atrito
• eletrização por contato
• condutor elétrico
• isolante elétrico
6. Aterramento de um objeto
Verifica-se que, quando um corpo eletrizado positiva ou negativamente é colocado em contato com o solo terrestre, diretamente ou por meio de um material condutor, ele torna-se eletricamente neutro.
Sabe-se que o solo é um condutor elétrico devido à presença de água com sais minerais dissolvidos. Quando um objeto eletrizado toma contato com o solo, transfere para ele sua carga elétrica. É como se, por meio da eletrização por contato, a carga do objeto fosse repartida com o planeta. Como o planeta é muito maior do que o objeto, toda a carga do objeto acaba sendo transferida para a Terra.
Quando um objeto é colocado em contato com o solo, podendo transferir para ele sua carga elétrica, dizemos que está eletricamente aterrado. O aterramento pode ser feito por meio de um fio metálico que, nesse caso, é denominado fio terra.

Fonte: iãng, H. D.; FREEDMAN, R. A. University Physics. décima quinta edição Harlow: Pearson, 2020. página 711.
Respostas e comentários
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- eletrização por atrito Fenômeno em que dois materiais, atritados um contra o outro, adquirem cargas elétricas de sinais opostos.
- eletrização por contato Fenômeno em que parte da carga de um objeto eletrizado é transferida para outro que o toque.
- condutor elétrico Material através do qual cargas elétricas podem se movimentar com facilidade.
- isolante elétrico Material que oferece grande resistência à movimentação de cargas elétricas através dele.
Itens 4 a 6
No item 4, utilize os esquemas do livro do estudante para elucidar a diferença entre um condutor elétrico e um isolante elétrico.
Retome, do 8º ano (capítulo 12), a discussão sôbre circuitos elétricos, aproveitando para relacioná-los ao que está sendo estudado. Os circuitos elétricos são elaborados com materiais que conduzem corrente elétrica, ou seja, que possibilitam a movimentação de cargas elétricas por eles.
No item 5, se julgar conveniente, volte ao simulador sugerido no Use a internet do item 3 e explore a opção com dois balões. Eletrize cada um deles com carga negativa por atrito com o casaco de lã e, a seguir, mostre a repulsão entre os dois (faça isso usando a opção Sem parede, para facilitar).
No item 6, utilize os esquemas do livro do estudante para explicar como funciona o aterramento elétrico (ele conduz as cargas elétricas para a terra) e retome, do 8º ano, a discussão sôbre a importância do correto aterramento elétrico de equipamentos para a segurança do usuário.
tê cê tê Ciência e Tecnologia
A temática de materiais condutores e semicondutores é de grande importância no campo tecnológico contemporâneo. Assim, o tê cê tê Ciência e Tecnologia (da macroárea de mesmo nome) é pertinente à imagem presente no item 4 e à sua legenda.
Atividades
Ao final do item 4, são indicados os exercícios 1 a 3 do Use o que aprendeu.
Ao final do item 5, pode-se propor aos estudantes o exercício 4 do Use o que aprendeu.
E, ao final do item 6, os estudantes já têm condições de fazer o exercício 5 do Use o que aprendeu.
7. Descargas elétricas no ar
Raios
O ar, quando está na pressão e na temperatura ambientes, é um isolante elétrico. Se um corpo eletrizado está separado pelo ar de um corpo não eletrizado, não haverá transferência de carga elétrica do primeiro para o segundo, porque o ar é isolante. Se, no entanto, um fio de cobre tocasse os dois corpos simultaneamente, então haveria transferência de carga, porque o metal é um condutor elétrico.
Um condutor elétrico (cobre, por exemplo) oferece baixa resistência à passagem de cargas elétricas. Já um material isolante elétrico (ar, por exemplo) oferece alta resistência à passagem de carga elétrica. Porém, quando corpos estão eletrizados com cargas muito elevadas ou quando estão muito próximos, a resistência que um material isolante elétrico oferece pode não ser suficiente para impedir a transferência de cargas elétricas de um corpo para outro. Essa transferência pode acontecer, acompanhada de luz e ruído, na fórma de uma faísca momentânea conhecida como descarga elétrica.
Um exemplo são os raios que ocorrem nas tempestades. As nuvens podem ficar altamente eletrizadas durante uma tempestade e, em decorrência disso, pode acontecer uma descarga elétrica que transfere carga da nuvem para o solo. Essa descarga elétrica produz uma luminosidade, que conhecemos como relâmpago, e um forte ruído, ao qual nos referimos como trovão.
ATENÇÃO!
NUNCA TOQUE NO FIO METÁLICO DO PARA-RAIOS SE ESTIVER CHOVENDO OU AMEAÇANDO CHUVA, pois, se um raio atingir o para-raios, isso poderá ser fatal.




Respostas e comentários
Item 7
Nesse item, dois aspectos precisam ser discutidos com os estudantes. O primeiro é que, quando dois materiais eletrizados têm cargas muito elevadas e/ou estão muito próximos, o material isolante elétrico que está entre eles pode não ser suficiente para impedir a transferência de cargas elétricas de um para o outro por meio de uma descarga elétrica, acompanhada de luz e ruído. Os raios durante tempestades exemplificam esse fenômeno.
Aproveite essa discussão para explicar o funcionamento do para-raios, conforme descrito no livro do estudante.
Um segundo aspecto que precisa ser discutido por você são os choques que podemos tomar em dias , ao aproximar os dedos de objetos metálicos. Ao falar sôbre o assunto, não deixe de explicar que isso é decorrência da eletrização da superfície do nosso corpo (ao ser atritada em roupas, tapetes ou cadeiras, por exemplo), que possibilita a transferência de cargas elétricas entre nossa pele e um objeto metálico. Saliente que o fenômeno é mais frequente nas épocas do ano em que o ar fica mais sêco. A presença de umidade atmosférica diminui a tendência de os materiais se eletrizarem por atrito.
Aprofundamento ao professor
Veja, na parte inicial dêste Manual do professor, na seção Aprofundamento ao professor, o texto “Por que os para-raios são pontudos?”.
tê cê tê Ciência e Tecnologia
O exemplo do para-raios, que está presente no cotidiano de muitos estudantes, é mais uma oportunidade de abordar o tê cê tê Ciência e Tecnologia e trazer ao dia a dia a relação entre descobertas científicas e suas aplicações na tecnologia.
Atividades
Ao final do item 7, o momento é oportuno para os estudantes fazerem os exercícios 6 a 8 do Use o que aprendeu e as atividades 1 a 7 do Explore diferentes linguagens.
Conteúdos atitudinais sugeridos
- Ser consciente da origem dos choques que podem acontecer, em épocas de ar sêco, ao se tocar em objetos metálicos, tais como maçanetas e carcaças de automóvel.
- Reconhecer a importância dos para-raios na prevenção de acidentes.
- Perceber que, na história da Ciência, teorias e modelos são aprimorados ou substituídos.
- Compreender que a Ciência é um construto humano.
Ao ensinar o tema eletricidade neste nível de escolaridade, é importante desenvolver no estudante atitudes de segurança relativas à eletricidade, e há vários momentos do capítulo que fornecem a oportunidade de enfatizar tais atitudes.
A abordagem dos cuidados com eletricidade teve início no 2º ano do Ensino Fundamental: “Discutir os cuidados necessários à prevenção de acidentes domésticos (objetos cortantes e inflamáveis, eletricidade, produtos de limpeza, medicamentos etcétera” (habilidade ê éfe zero dois cê ih zero três).
Essa abordagem prosseguiu no volume do 8º ano desta coleção (capítulo 12), com a discussão dos diversos riscos potencialmente associados ao uso da energia elétrica e de atitudes associadas à prevenção dêsses acidentes.
Aproveite o tema em estudo, neste capítulo do 9º ano, para retomar e destacar atitudes de segurança relativas à eletricidade. Há vários momentos dêste capítulo que oportunizam essa retomada.
Choques ao tocar em objetos de metal
Outro exemplo de situação em que pode haver descarga elétrica é quando nosso corpo está eletrizado e aproximamos a mão de algum objeto de metal. Nesse caso, quando a ponta do dedo está quase tocando o metal, a distância entre ambos é muito pequena e, antes de haver o toque, uma pequena descarga elétrica “salta” entre ambos, transferindo carga elétrica do dedo para o metal. Essa descarga provoca uma sensação dolorosa e desagradável no local. É, de fato, um pequeno choque elétrico.
Nosso corpo pode se eletrizar, por exemplo, por causa do atrito com o tecido de assentos de automóvel e de certas roupas, especialmente de material sintético, ou pelo raspar dos calçados em um carpete. E a descarga elétrica pode ocorrer, por exemplo, ao tocarmos em uma maçaneta de metal ou na lataria de um automóvel.
A probabilidade de levar esses pequenos choques ao tocar objetos de metal é maior em dias e menor em dias muito úmidos.
Nos dias muito úmidos, a água que está presente no ar sofre eletrização por contato na superfície de objetos eletricamente carregados. Por isso, a carga elétrica dêsses objetos pode passar gradualmente para a água atmosférica, até que o objeto eventualmente fique neutro. Portanto, a chance de o nosso corpo eletrizar-se e manter-se eletrizado é bem menor quando o ar está úmido, e a chance de levar choques em maçanetas e latarias de carro também.
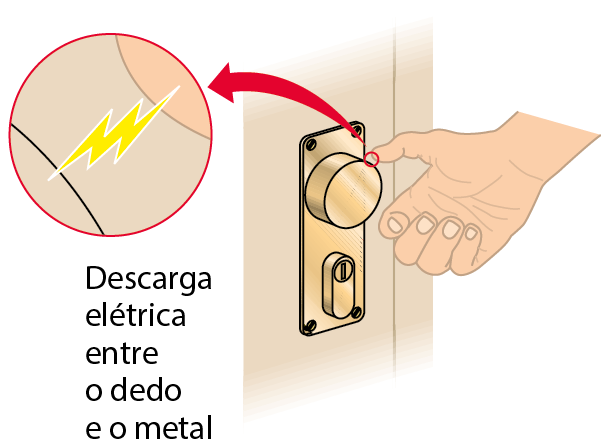
Fonte: Bloomfíild, L. A. How things work: the Physics of everyday life. sexta edição Hoboken: John Wiley, 2016. página 284.

Use a internet
Há endereços na internet que fornecem a umidade relativa do ar, como em: https://oeds.link/OFTK4E e https://oeds.link/fNoJr8. Acesso em: 16 agosto 2022.
Quando a umidade relativa está muito baixa (30% ou menor), aumenta a chance de levar pequenos choques elétricos, conforme explicado.
8. Modelo atômico de Ruterfór
Vimos, neste capítulo, que a matéria participa de fenômenos elétricos. Materiais como lã, plástico, vidro e seda podem ser eletrizados se forem atritados uns nos outros. Mas o modelo atômico de — isto é, a concepção científica elaborada por de como é o átomo —, que estudamos no capítulo anterior, não leva em conta aspectos elétricos da matéria.
Gases, de modo geral, não conduzem corrente elétrica quando à pressão ambiente. No entanto, na segunda metade do século dezenove, alguns cientistas demonstraram que, quando submetidos a baixas pressões, os gases podem se tornar condutores elétricos. Realizando elaborados experimentos com descargas elétricas em gases, o cientista inglês Joséf Djón Tonsson (1856-1940) concluiu em 1897, que existe uma partícula menor que o átomo, dotada de carga elétrica negativa. Essa partícula subatômica, isto é, menor que o átomo, passou a ser denominada elétron.
Após essa descoberta, ficou evidenciado que um átomo não é indivisível, diferentemente do que propõe o modelo de . Ainda no final do século dezenove, novos experimentos conduziram à descoberta de outra partícula subatômica, que tem massa .1836 vezes maior que a do elétron e é dotada de carga elétrica equivalente à dele, só que positiva. Para designar essa partícula é utilizado o nome próton.
Respostas e comentários
Itens 8 e 9
São muitos os eventos que conduziram ao modelo atômico apresentado no capítulo. Experimentos com descargas elétricas em gases a baixa pressão realizados por diversos pesquisadores no século dezenove possibilitaram as descobertas do elétron e do próton.
No início do século vinte, diversos pesquisadores – como o irlandês Joséf (1857‑1942), o japonês (1865‑1950), o inglês Djón Uilian (1881‑1955) e o neozelandês Ernest Rutherford (1871‑1937) – propuseram diferentes modelos atômicos buscando elucidar fenômenos experimentais que estavam sendo observados. Nenhum dêsses modelos era capaz de explicar, simultaneamente, todos os fenômenos observados. Para exemplificar, comentaremos aqui, ao docente, como foi desenvolvido o modelo de Ruterfór.
Em 1909, o alemão Râns gaiguer (1882‑1945) e o inglês Êrnest (1889‑1970), que trabalhavam na Universidade de Manchester (Inglaterra) sob orientação de Êrnest Ruterfór, realizaram, por sugestão dêste, uma série de experimentos para investigar a dispersão (o espalhamento) de partículas alfa ao incidirem sôbre folhas metálicas de diferentes espessuras, milhares de vezes mais finas que 1 milímetro. Eles usaram um elemento radioativo que emite partículas alfa a velocidades de até 30 mil quilômetros por segundo.
Entre outras, foi utilizada uma folha de ouro de espessura 0,00004 centímetro, correspondendo a cêrca de 300 a 350 átomos dêsse metal enfileirados. As partículas alfa, como já se sabia na época, são aproximadamente 50 vezes mais leves que os átomos de ouro e apresentam carga elétrica positiva. As partículas alfa atravessam papel ou tecidos bem finos. Assim, os experimentadores esperavam que praticamente todas as partículas alfa deveriam atravessar a folha de ouro em linha reta.
Porém, imaginavam também que algumas partículas poderiam ter pequenos desvios, por interagirem com as cargas elétricas existentes nos átomos de ouro. Para observar o destino das partículas (que não são visíveis), usaram uma superfície fluorescente. Cada vez que uma partícula alfa atingia essa superfície, uma cintilação era vista no local do impacto por fração de segundo. O resultado experimental evidenciou que algumas partículas alfa não atravessavam em linha reta, mas eram desviadas de sua trajetória, às vezes de modo bastante acentuado!
Os resultados do experimento de dispersão de partículas alfa foram analisados por Ruterfór. Ele utilizou recursos de Física e Matemática para interpretar os dados obtidos e, para explicá‑los, propôs, em 1911, um modelo atômico segundo o qual (1) o átomo apresenta muito mais espaço vazio que preenchido; (2) a maior parte da massa de um átomo encontra‑se em uma pequena região central (à qual chamamos núcleo), onde está concentrada a carga positiva do átomo; (3) na região ao redor do núcleo (que chamamos eletrosfera) encontram‑se os elétrons; e (4) o raio da eletrosfera é de dez a cem mil vezes maior que o raio do núcleo (relação que foi inferida da fração de partículas alfa desviadas).
O modelo de Ruterfór explicava o fato de a maioria das partículas alfa não se desviar supondo a existência de muitos espaços vazios nos átomos. Para explicar por que poucas partículas alfa eram tão desviadas a ponto de quase retornarem na mesma direção de que vieram, Ruterfór propôs que toda a carga positiva do átomo, e quase toda sua massa, estaria concentrada em um espaço pequeno (núcleo), de modo a repelir as partículas alfa (também positivas) que viessem em sua direção.
Ao longo da década de 1920, os estudos sôbre fenômenos radioativos e a estrutura dos átomos prosseguiram. Foi observado que, para um núcleo atômico com carga correspondente à de x prótons, sua massa correspondia à de aproximadamente duasx prótons. Muitas tentativas de explicação esbarravam em inconsistências teóricas e experimentais. A solução veio após a observação, em 1930, de um tipo de radiação que não tinha carga positiva (como as partículas alfa) nem negativa (como as partículas beta, outro tipo de partícula radioativa conhecida à época), mas que também não era radiação gama (uma emissão radioativa, esta constituída de ondas eletromagnéticas). Em 1932, o físico inglês Djeimes (1891‑1974) caracterizou essa radiação como sendo constituída de partículas subatômicas de massa muito próxima à do próton, porém eletricamente neutra. Essa partícula, que foi denominada nêutron, localiza‑se no núcleo dos átomos, juntamente com os prótons.
Ao trabalhar o item 9, atente ao desfecho da conceituação de elemento químico, iniciada no capítulo anterior. A conceituação moderna está associada ao conceito de número atômico.
Para o docente conhecer outros modelos atômicos do início do século vinte, sugerimos duas publicações: LOPES, C. V. M. Modelos atômicos no início do século vinte: da física clássica à introdução da teoria quântica. 2009. São Paulo: Pontifícia Universidade Católica de São Paulo, 2009. (Tese de Doutorado em História da Ciência.); , E. E. A.; , J. A. A História do desenvolvimento da teoria atômica: um percurso de Dalton a Bór. Amazônia – Revista de Educação em Ciências e Matemática. volume 11 (22), página 62‑77, janeiro‑junho 2015. Os textos sugeridos são disponibilizados na internet e podem ser encontrados buscando por título e nome dos autores.
Em 1911, o cientista neozelandês Êrnest Ruterfór (1871-1937) concluiu, com base em evidências experimentais, que:
- o átomo não é maciço; ele apresenta muito mais espaço vazio que preenchido;
- a maior parte da massa de um átomo se encontra em uma pequena região central (que chamamos núcleo), onde estão os prótons;
- na região ao redor do núcleo (que chamamos eletrosfera) movimentam-se os elétrons;
- o raio da eletrosfera é milhares de vezes maior que o raio do núcleo.
Essas ideias constituem o modelo atômico de Ruterfór.
Em 1932, o inglês Djeimes (1891-1974) concluiu que existe outra partícula subatômica de massa muito próxima à do próton, porém eletricamente neutra, ou seja, sem carga elétrica. Essa partícula é denominada nêutron. Os nêutrons localizam-se no núcleo do átomo, juntamente com os prótons.
Representação esquemática de um átomo
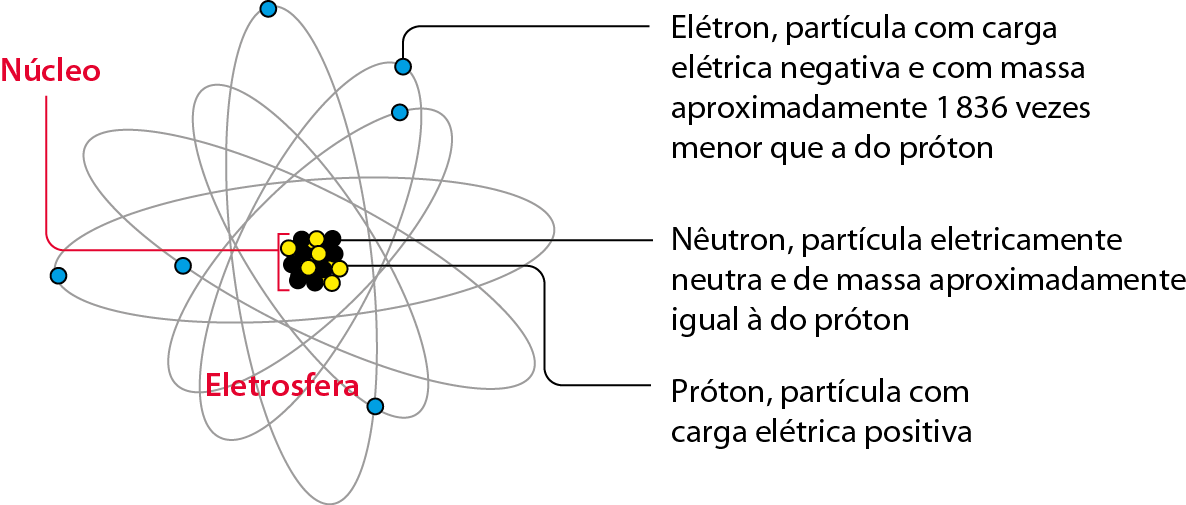
Fonte: , H. S. General, Organic, and Biological Chemistry. sétima edição Boston: Cengage, 2016. página 61.
Esquema em cores fantasiosas e fóra de proporção. O diâmetro da eletrosfera é milhares de vezes maior que o do núcleo. O núcleo está representado ampliado aproximadamente 590 bilhões de vezes, e a eletrosfera, cêrca de 180 milhões de vezes. Um átomo apresenta, portanto, muito mais espaço vazio que preenchido.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• elétron
• próton
• nêutron
• modelo atômico
EM DESTAQUE
A explicação da eletrização por atrito
Neste capítulo, foi apresentado o fenômeno da eletrização por atrito, no qual dois materiais adquirem cargas elétricas de sinais opostos quando atritados um contra o outro. Como explicar tal acontecimento? A explicação científica para a eletrização por atrito considera que, quando dois materiais são atritados, alguns elétrons são transferidos de um para outro.
Assim, por exemplo, quando um bastão de vidro é esfregado em um tecido de lã, alguns elétrons do vidro são transferidos para a lã. Antes da eletrização, ambos os materiais estavam eletricamente neutros, ou seja, tinham carga total igual a zero. Neles, o total de prótons (que são positivos) era igual ao de elétrons (que são negativos). Após a eletrização, um dos materiais ficará com mais elétrons do que prótons (a lã) e terá, portanto, carga elétrica total negativa. O outro terá menos elétrons do que prótons (o vidro) e apresentará carga elétrica total positiva.
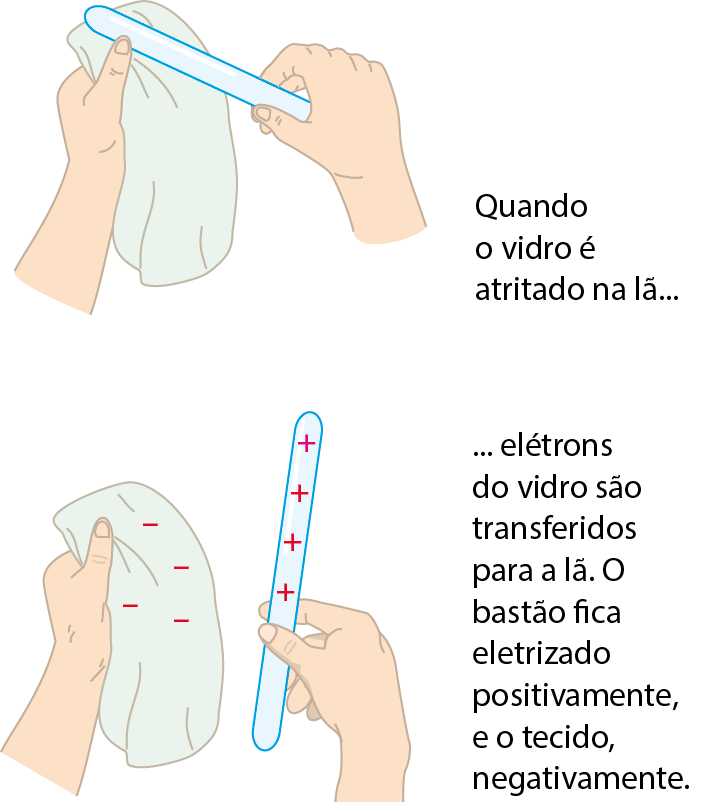
Elaborado com dados obtidos de: Seruêi, R. A.; Djiuet, J. W. Physics for scientists and engineers; with Modern Physics. décima edição Boston: Cengage, 2019.
Respostas e comentários
De ôlho na Bê êne cê cê!
O texto Em destaque do item 8 contribui para continuar desenvolvendo a competência geral 2 e a competência específica 3.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- elétron Partícula subatômica de carga negativa.
- próton Partícula subatômica de carga positiva e de massa uma.oitocentas e trinta e seis vezes maior que a do elétron.
- nêutron Partícula subatômica sem carga elétrica e com massa aproximadamente igual à do próton.
- modelo atômico Concepção científica de como é a estrutura do átomo.
9. Elemento químico e número atômico
O núcleo atômico dificilmente tem sua estrutura alterada por fatores externos. Os fenômenos relacionados às mudanças do núcleo são chamados fenômenos nucleares ou radioativos e são estudados pela Física Nuclear. Esses acontecimentos estão associados a processos que ocorrem em estrelas, em usinas nucleares e em explosões de armamentos nucleares.
Os químicos observaram que, durante as reações químicas, o núcleo dos átomos permanece inalterado e que, quando um átomo se une a outro, essa união acontece por meio de modificações na eletrosfera. Assim, os acontecimentos estudados pelos químicos estão relacionados a alterações na eletrosfera dos átomos, não no núcleo.
Os cientistas perceberam, nas primeiras décadas do século vinte, que o número de prótons determina as propriedades químicas de um átomo. Assim, entende-se atualmente que elemento químico é o conjunto de todos os átomos que possuem o mesmo número de prótons.
Número atômico e número de massa
O número de prótons no núcleo de um átomo é chamado número atômico e é representado por Z.
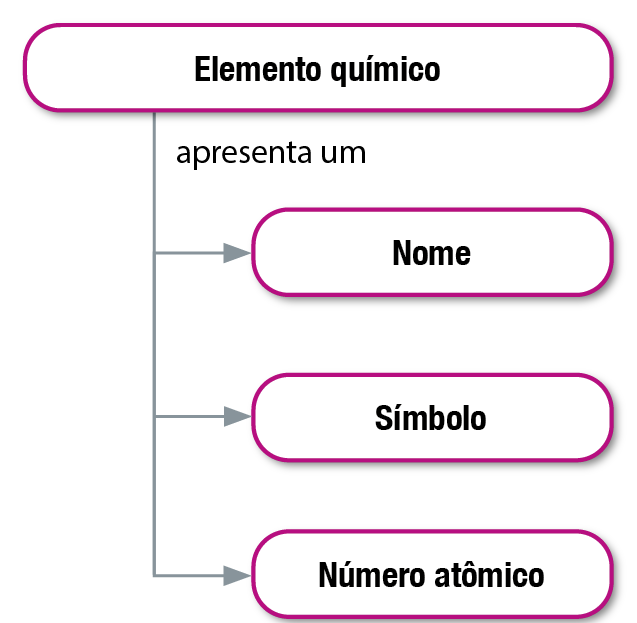
Cada elemento químico possui um nome, um símbolo e um número atômico, que lhe são característicos.
Já o número de massa de um átomo, representado por A, é definido como total de prótons (Z) e de nêutrons (N) em seu núcleo.


ATIVIDADE
Tema para pesquisa
O professor atribuirá, por sorteio, um elemento químico para cada estudante. Pesquise a origem do nome (isto é, o significado dêsse nome na língua de origem) e do símbolo do elemento que lhe for atribuído, e prepare-se para expor os resultados aos colegas em uma roda de conversa mediada pelo professor.
Representação para um átomo
Ao representar um átomo, os químicos convencionaram escrever o número atômico (Z) na parte inferior esquerda do símbolo e o número de massa (a) na parte superior esquerda. Vejamos alguns exemplos:
•
C. Sobrescrito à esquerda: 12; subscrito à esquerda: 6. representa um átomo do elemento químico carbono com 6 prótons, 6 nêutrons e, se estiver eletricamente neutro, 6 elétrons.•
N a. Sobrescrito à esquerda: 23; subscrito à esquerda: 11. representa um átomo do elemento químico sódio com 11 prótons, 12 nêutrons e, se estiver eletricamente neutro, 11 elétrons.•
C l. Sobrescrito à esquerda: 37; subscrito à esquerda: 17. representa um átomo do elemento químico cloro com 17 prótons, 20 nêutrons e, se estiver eletricamente neutro, 17 elétrons.Os prótons têm carga elétrica positiva, e os elétrons têm carga negativa. Se, em um átomo, o número de elétrons for igual ao de prótons, então a carga negativa (de todos os elétrons) anulará a carga positiva (de todos os prótons), e a carga total será nula (zero). Nesse caso, dizemos que o átomo é eletricamente neutro.

Respostas e comentários
História da Ciência
A pesquisa de eventos da história das Ciências da Natureza, como a que é proposta no Tema para pesquisa do item 9, permite aos estudantes perceber que o sucessivo aprimoramento do pensamento científico decorre da atuação colaborativa de muitos membros da comunidade. A atividade já adianta parte do que será solicitado no fechamento desta unidade.
De ôlho na Bê êne cê cê!
O boxe Tema para pesquisa oportuniza compreender as Ciências da Natureza como empreendimento humano, e o conhecimento científico como cultural e histórico, de modo a favorecer o desenvolvimento da competência específica 1.
Sugestão de atividade
Use a simulação a seguir para mostrar aos estudantes estruturas com diferentes ordens de grandeza de tamanho, favorecendo a aquisição da noção da dimensão dos átomos. Disponível em: https://oeds.link/GXyNPr. Acesso em: 22 julho 2022.
Use a barra de zoom para navegar por diferentes ordens de grandeza. Cada objeto é clicável, fornecendo tamanho e outras informações. A atividade permite retomar a habilidade de Matemática ê éfe zero seis ême ah um dois (“Fazer estimativas de quantidades e aproximar números para múltiplos da potência de 10 mais próxima.”).
Porém, se o número de elétrons for maior ou menor que o de prótons, então o átomo terá carga total não nula; ele será eletricamente carregado. Veremos, mais à frente, situações em que átomos não estão eletricamente neutros.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• número atômico
• elemento químico
• número de massa

Use a internet
Se você precisar de informações específicas sôbre os elementos, há na internet tabelas periódicas interativas, como em: https://oeds.link/sZ78M3. Acesso em: 13 abril 2022.
Dê uma busca por tabela periódica e você poderá encontrar outras.

atividade
Para fazer no seu caderno
Analise o algoritmo representado pelo seguinte fluxograma:

Qual será o resultado registrado no papel ao executar essas instruções?
A que período da tabela periódica pertencem os elementos químicos cujos símbolos serão escritos?
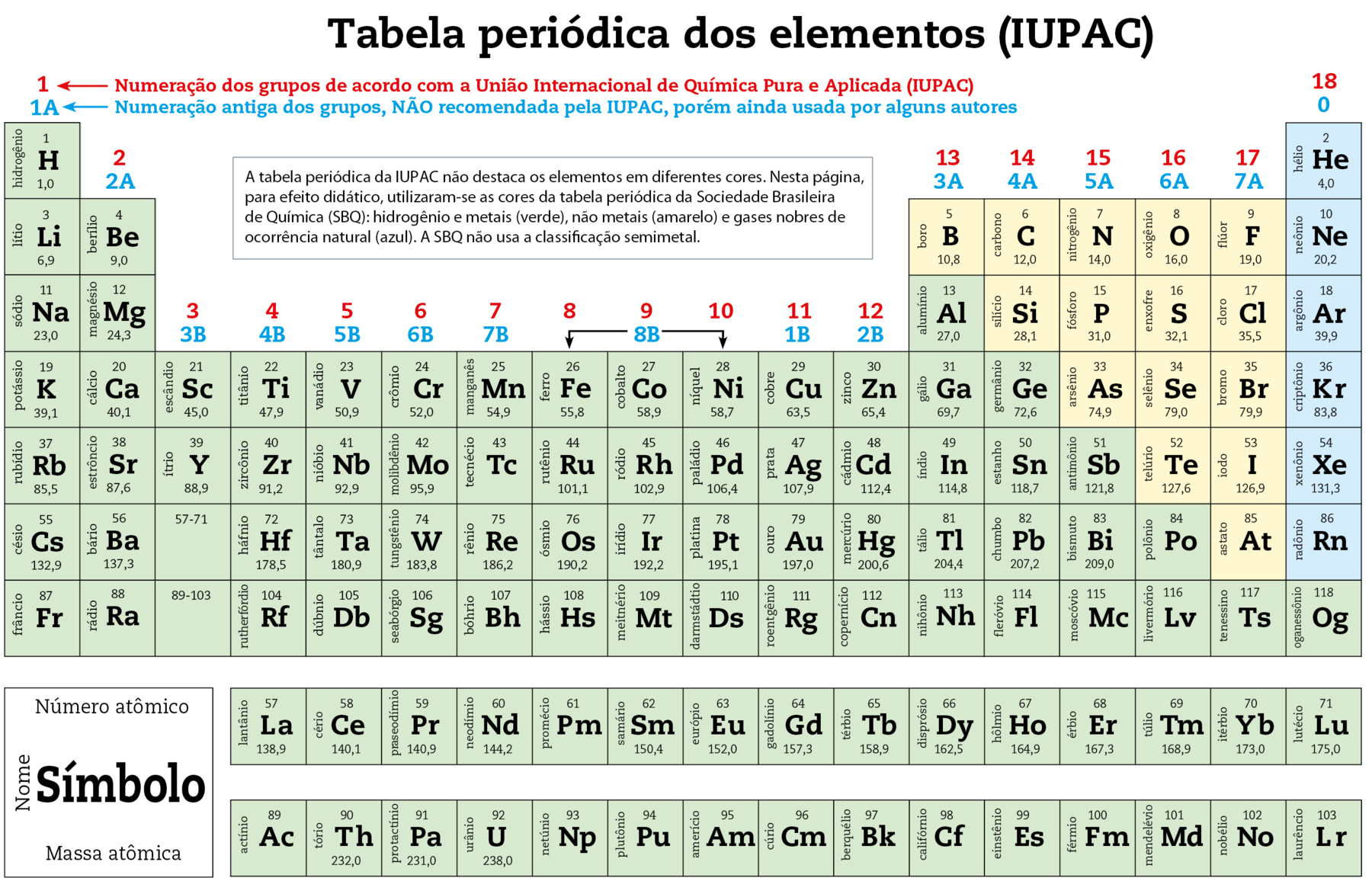
10. A tabela periódica
Períodos
A seguir, aparece a tabela periódica. Nela, os elementos estão relacionados, um em cada quadradinho, em ordem crescente de número atômico.
Existem sete linhas (sequências horizontais), cada uma denominada período. A tabela periódica atual apresenta sete períodos. Os elementos com números atômicos de 57 a 71, chamados lantanídios, e os de 89 a 103, chamados actinídios, aparecem à parte dos demais, abaixo da tabela. Os lantanídios pertencem ao sexto período e os actinídios ao sétimo. Note que, nesses períodos, há um quadradinho que indica a localização dêsses elementos.
Famílias ou grupos
Cada uma das dezoito colunas (sequências verticais) é denominada grupo ou família de elementos. Por determinação da União Internacional de Química Pura e Aplicada (iupáqui), os grupos são numerados atualmente de 1 a 18, mas ainda há quem utilize a representação anterior com letras e números (1A, 2A etcétera).
Elementos com propriedades semelhantes ficam num mesmo grupo. Alguns dos grupos, por sua importância para a Química, recebem nomes especiais:
- O grupo 1, ou 1A, é o grupo dos metais alcalinos.
- O grupo 2, ou 2A, é o grupo dos metais alcalinoterrosos.
- O grupo 16, ou 6A, é o grupo dos calcogênios.
- O grupo 17, ou 7A, é o grupo dos halogênios.
- O grupo 18, ou 0 (zero), é o grupo dos gases nobres.
Elementos representativos e de transição
Os elementos dos grupos 1, 2, 13, 14, 15, 16, 17 e 18 são denominados elementos representativos. Os dos grupos de 3 a 12 são chamados elementos de transição, sendo que os lantanídios e os actinídios são especificamente denominados elementos de transição interna.
Respostas e comentários
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- número atômico Número de prótons existente no núcleo de um átomo.
- elemento químico Conjunto de átomos com o mesmo número atômico.
- número de massa Valor que resulta da adição do número de prótons e do número de nêutrons de um átomo.
Atividades
Ao final do item 9, o momento é oportuno para que os estudantes façam os exercícios 9 a 12 do Use o que aprendeu e as atividades 8 a 13 do Explore diferentes linguagens.
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero três
“Identificar modelos que descrevem a estrutura da matéria (constituição do átomo e composição de moléculas simples) e reconhecer sua evolução histórica.”
O desenvolvimento dessa habilidade se iniciou no capítulo anterior, prossegue neste e continuará no seguinte.
Neste capítulo, os estudantes conheceram alguns fatos que revelam a natureza elétrica da matéria, o que abre caminho para a percepção de que um modelo atômico deve incluir essa natureza, como é o caso do modelo apresentado neste capítulo.
Uma outra característica dêsse modelo é a de que o átomo não é indivisível, mas sim constituído de partículas subatômicas.
Um ponto já comentando neste capítulo e que precisa ser enfatizado ao educador é que a proposição do modelo de Ruterfór (1911) é anterior à descoberta do nêutron (1932). Assim, originalmente, esse modelo considerava o átomo constituído de prótons (no núcleo) e elétrons (na eletrosfera).
Sugestão de atividade
Construir um modelo de átomo, respeitando a proporção entre o raio do núcleo e o da eletrosfera. O que seria mais sensato empregar para representar o núcleo, de modo a ter um átomo com dimensões que caibam na sala ou, pelo menos, no terreno da escola: bola de pingue-pongue, bola de gude, grão de feijão, grão de areia ou o quê? A que distância dêsse objeto que representa o núcleo estariam os elétrons mais afastados, respeitando-se a proporção entre o raio do núcleo e o raio da eletrosfera?
Esta atividade propicia o entendimento do motivo pelo qual as ilustrações esquemáticas do átomo, no modelo de Ruterfór (ou no de Bór, apresentado no próximo capítulo), que aparecem em livros, estão sempre fóra de proporção. É virtualmente impossível representar núcleo e eletrosfera, em escala, em uma folha de papel comum, de tal fórma que o núcleo esteja bem visível. Se o diâmetro da eletrosfera for 20 centímetros, o do núcleo será, no máximo, dez mil vezes menor, isto é, 0,02 milímetro!
Respostas e comentários
Outra atividade sugerida é construir o eletroscópio da questão 5 do Use o que aprendeu e realizar o experimento descrito naquela questão.
Item 10
O item apresenta a estrutura geral da tabela periódica. Esta, a nosso ver, deve ser considerada instrumento de consulta, a qualquer tempo, inclusive em avaliações. A tabela periódica apresentada no livro é a disponibilizada pela União Internacional de Química Pura e Aplicada (iupáqui). Considerando que a entidade não utiliza cores em sua tabela periódica e que todo e qualquer esquema classificatório esbarra em dificuldades e na possibilidade de questionamentos frente à imensa gama de propriedades dos elementos, optou‑se, na obra, por utilizar o esquema de cores da Sociedade Brasileira de Química (ésse bê quê), com o qual muitos docentes estão familiarizados no Brasil.
Noções de pensamento computacional
A representação apresentada no primeiro Para fazer no seu caderno do item 10 é um fluxograma, uma representação gráfica da sequência de etapas que constituem um algoritmo. Algoritmos e fluxogramas já foram objeto de atividades no volume anterior e também no capítulo 1 dêste volume. Habilidades de Matemática de anos anteriores também envolvem esses dois conceitos (por exemplo, ê éfe zero seis ême ah zero quatro, ê éfe zero seis ême ah dois três, ê éfe zero sete ême ah dois seis, ê éfe zero sete ême ah dois oito e ê éfe zero oito ême ah um seis).
Para a análise do fluxograma proposto, os estudantes devem perceber que, inicialmente, o valor da variável Z é 11. O primeiro elemento cujo símbolo será procurado na tabela periódica e escrito no papel é o sódio.
Ao chegar ao bloco de decisão (losango amarelo), como Z (ainda) não vale 18, será acrescido de uma unidade, passando a valer 12, o que conduzirá a procurar o símbolo do magnésio e a escrevê-lo no papel.
Um loop é um conjunto de instruções de um algoritmo que é executado repetidamente até que sejam alcançadas uma ou mais condições desejadas. O conjunto reproduzido a seguir é o loop que existe no algoritmo.

Esse loop será repetido até que Z seja aumentado para 18, o que, em seguida, conduzirá a procurar o símbolo do argônio e a escrevê-lo no papel. Imediatamente após isso, a resposta à pergunta que está no bloco de decisão (losango amarelo) será “SIM” e o conjunto de instruções do algoritmo chegará ao fim.
Assim, como resultado, serão registrados no papel, em 8 linhas consecutivas, os símbolos do sódio (êne á) ao argônio (á érre), ou seja, dos elementos que integram o terceiro período da tabela periódica.
O segundo Para fazer no seu caderno do item 10 propõe uma adaptação do fluxograma para expressar um novo algoritmo que, ao ser executado, resulte nos símbolos dos elementos lantanídios.
Consultando a tabela periódica, verifica-se que os lantanídios têm números atômicos de 57 (lantânio) a 71 (lutécio). A adaptação do fluxograma deve, portanto, ser feita de modo que a variável Z seja inicializada com o valor 57. Além disso, o loop deve ser interrompido quando, no teste do valor da variável Z, esta igualar 71. O fluxograma solicitado é:

Aproveite essa atividade para salientar aos estudantes uma das características do pensamento computacional: uma vez que se criou um algoritmo que resolve determinado problema, ele pode ser adaptado para a resolução de problemas similares.
Clique no play e acompanhe a reprodução do Áudio.
Transcrição do áudio
[LOCUTOR] Influência brasileira na descoberta do elemento químico lítio
[Efeito sonoro de passagem]
[Mafê] Joca, você já ouviu falar sobre o José Bonifácio, o “Patrono da Independência”? [Joca] Já, sim! Em uma das aulas de História, a professora comentou que ele participou das articulações políticas que levaram dom Pedro I a proclamar a Independência do Brasil. Ah, ela disse também que, além de conselheiro de dom Pedro I, ele foi tutor de dom Pedro II. [Mafê] Isso mesmo! Na minha turma, estávamos estudando o período regencial no Brasil, e o professor explicou que, em 1831, dom Pedro I encarregou José Bonifácio da educação de seu filho de 5 anos, Pedro de Alcântara, que se tornou o imperador do Brasil conhecido como dom Pedro II. [Joca] Eu me lembrava disso também. Mas por que você perguntou dele? Vamos estudar para a avaliação de História? [Mafê] [Rindo] Ainda não... É que estou pesquisando a biografia dele para um trabalho de Química, sobre elementos químicos. [Joca] De Química?! E qual seria a relação de José Bonifácio com elementos químicos? [Mafê] Pois é! Na aula de História, o professor comentou que, embora José Bonifácio tenha se destacado na política, grande parte de sua vida foi dedicada às Ciências. Ele nasceu em 1763, na Vila de Santos, a atual cidade de Santos, no litoral paulista, e aos 20 anos foi para Portugal. [Joca] Agora estou lembrando... a professora disse em uma das aulas que José Bonifácio estudou na Universidade de Coimbra. [Mafê] Isso mesmo! Naquela época, havia a preocupação de usar a ciência como um instrumento para transformar a sociedade. E essa ideia era também compartilhada por José Bonifácio. [Joca] Ah, então ele pensava em aplicar a ciência... [Mafê] Sim. Olha só... Segundo as fontes que pesquisei para o meu trabalho, José Bonifácio concluiu a universidade, tornou-se membro da Academia das Ciências de Lisboa e obteve uma bolsa para viajar pela Europa e aprimorar seus conhecimentos no estudo de minerais. Durante essa viagem, que duraria dez anos, ele descobriu quatro minerais, entre eles a petalita. Dezessete anos mais tarde, o químico sueco Johan August Arfwedson, analisando uma amostra de petalita, descobriu o lítio. [Joca] Uau! Então José Bonifácio participou da descoberta de um novo elemento químico! E eu nem sabia que ele havia sido cientista! [Mafê] Não é incrível? Foi uma surpresa para mim também. Essa pesquisa tem me estimulado a estudar mais, sobre Química e sobre a história do Brasil! [Joca] Sem dúvida há muito a aprender! Quer saber? Agora fiquei curioso sobre o lítio. Vou aproveitar para pesquisar sobre os usos e aplicações desse elemento químico. Depois a gente volta a conversar... Valeu, Mafê! [Mafê] Até mais, Joca! Ah, e não esquece que ainda temos que estudar para a avaliação de História, hein?!
Metais, não metais e semimetais
Os elementos conhecidos como metais formam substâncias simples que, de modo geral, conduzem bem a corrente elétrica e o calor. Essas substâncias são facilmente transformadas em lâminas e em fios e são sólidas nas condições ambientes, isto é, a 25 graus Célsius de temperatura e pressão atmosférica do nível do mar. A substância simples formada pelo mercúrio (agá gê), que é líquida nessas condições, é a única exceção entre os metais.
Os elementos denominados não metais (alguns os chamam ametais) formam substâncias simples que, ao contrário dos metais, não conduzem bem o calor nem a corrente elétrica (exceção importante é o carbono na fórma da substância simples grafite) e não são facilmente transformadas em lâminas ou em fios. Dos não metais, alguns formam substâncias simples gasosas nas condições ambientes (hidrogênio, nitrogênio, oxigênio, flúor e cloro), um fórma substância simples líquida (bromo), e os demais formam substâncias simples sólidas.
Alguns autores chamam de semimetais alguns elementos que apresentam propriedades “intermediárias” entre as dos metais e as dos não metais. São eles o boro (bê), o silício (ésse Í), o germânio (gê é), o arsênio (á ésse), o antimônio (Ésse bê), o telúrio (tê e) e o polônio (pê ó). Eles formam substâncias simples sólidas a 25 graus Célsius ao nível do mar. Dois semimetais de importância prática são o silício e o germânio, empregados em componentes eletrônicos. Existe, contudo, uma tendência crescente na literatura de não se empregar a terminologia semimetais. Há vários anos, por exemplo, a tabela periódica da Sociedade Brasileira de Química (ésse bê quê) classifica bê, ésse Í, á ésse e tê e como não metais e gê é, Ésse bê e pê ó como metais.
Exemplos de metais (cobre e alumínio)


Exemplos de não metais (enxofre e carbono)


Exemplo de semimetal (silício)


ATIVIDADE
Para fazer no seu caderno
Esta atividade também é sôbre pensamento computacional e envolve o algoritmo expresso pelo fluxograma da atividade Para fazer no seu caderno proposta anteriormente.
Esse algoritmo pode ser adaptado para que apresente, como resultado, os símbolos dos elementos denominados lantanídios.
Faça as adaptações necessárias no fluxograma, em seu caderno, e simule a execução do algoritmo para verificar se o resultado é o pretendido. Se não for, modifique-o até atingir o objetivo pretendido.
Respostas e comentários
De ôlho na Bê êne cê cê!
Os dois boxes Para fazer no seu caderno do item 10 possibilitam o desenvolvimento da competência geral 4, pois propõem utilizar conhecimentos das linguagens matemática e científica para se expressar e partilhar informações e ideias e produzir sentidos que levem ao entendimento mútuo.
Com essas atividades, pode também ser desenvolvida a competência específica 6, no tocante a utilizar tecnologias digitais de informação e comunicação para se comunicar, produzir conhecimentos e resolver problemas das Ciências da Natureza de fórma crítica, significativa e reflexiva.
Atividades
Ao final do item 10, proponha os exercícios 13 a 15 do Use o que aprendeu.
11. Isótopos
O hidrogênio é o elemento químico com Z = 1. Será que todos os átomos de hidrogênio que existem na natureza são exatamente iguais?
A resposta é não. A maioria dos átomos de hidrogênio pode ser representada por
H. Sobrescrito à esquerda: 1; subscrito à esquerda: 1.. Contudo, além deles, existem também outros, em menor quantidade, representados por
H. Sobrescrito à esquerda: 2; subscrito à esquerda: 1.e
H. Sobrescrito à esquerda: 3; subscrito à esquerda: 1..
Que semelhança e que diferença há entre eles?
Os três possuem em comum o número de prótons (Z) (e, considerando-os eletricamente neutros, também o número de elétrons). A diferença está no número de nêutrons.
Já que possuem o mesmo número atômico, são átomos do mesmo elemento químico: o hidrogênio. Dizemos que esses três átomos são isótopos.
Isótopos são dois ou mais átomos que possuem o mesmo número atômico (Z) e diferentes números de massa (A). Isótopos sempre pertencem ao mesmo elemento químico, pois possuem o mesmo Z, e são, portanto, representados por um mesmo símbolo. A maioria dos elementos químicos é constituída por dois ou mais isótopos presentes na natureza, geralmente, em diferentes quantidades.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• tabela periódica
• grupo
• período
• isótopos

Use a internet
Acesse uma tabela periódica interativa na qual, clicando no quadradinho do elemento, você terá uma lista de suas principais aplicações, onde é encontrado e o ano e local da descoberta: https://oeds.link/AkL2ob. Acesso em: 13 abril 2022.
EM DESTAQUE
Isótopos na água
Quando dizemos que os isótopos pertencem ao mesmo elemento químico (pois têm o mesmo Z), estamos dizendo que eles possuem propriedades químicas semelhantes.
Assim, por exemplo, os átomos de hidrogênio que existem numa molécula de água, agáóh, podem ser qualquer um de seus isótopos. O átomo de oxigênio também pode ser qualquer um de seus isótopos.
Isótopos do hidrogênio:
H. Sobrescrito à esquerda: 1; subscrito à esquerda: 1.,
H. Sobrescrito à esquerda: 2; subscrito à esquerda: 1.ou
H. Sobrescrito à esquerda: 3; subscrito à esquerda: 1.Isótopos do oxigênio:
O. Sobrescrito à esquerda: 16; subscrito à esquerda: 8.,
O. Sobrescrito à esquerda: 17; subscrito à esquerda: 8.ou
O. Sobrescrito à esquerda: 18; subscrito à esquerda: 8.Todos os isótopos de um certo elemento, por possuírem propriedades químicas semelhantes, podem tomar parte na composição das mesmas substâncias.
A abundância dos isótopos (a quantidade de cada um deles que existe na natureza) é normalmente diferente. Assim, por exemplo, de cada .10000 átomos de oxigênio, os químicos concluíram que .9976 são de
O. Sobrescrito à esquerda: 16; subscrito à esquerda: 8., 4 são de
O. Sobrescrito à esquerda: 17; subscrito à esquerda: 8.e 20 são de
O. Sobrescrito à esquerda: 18; subscrito à esquerda: 8..

Elaborado com dados obtidos de: HAYNES, W. M. (edição). CRC handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016.
Respostas e comentários
Item 11
A maioria dos elementos químicos encontrados na natureza ocorre como dois ou mais isótopos, átomos de mesmo número atômico e diferentes números de nêutrons (e, consequentemente, diferentes números de massa). Por exemplo, os isótopos naturais do magnésio são
Mg. Sobrescrito à esquerda: 24; subscrito à esquerda: 12.,
Mg. Sobrescrito à esquerda: 25; subscrito à esquerda: 12.e
Mg. Sobrescrito à esquerda: 26; subscrito à esquerda: 12., e os do bromo são
Br. Sobrescrito à esquerda: 79; subscrito à esquerda: 35.e
Br. Sobrescrito à esquerda: 81; subscrito à esquerda: 35..
A palavra isótopo vem do grego “lugar igual”, em referência ao fato de os isótopos ocuparem posição coincidente na tabela periódica (mesmo elemento).
Cada isótopo tem determinada abundância natural. Por exemplo, os isótopos naturais do neônio (e suas abundâncias) são
N e. Sobrescrito à esquerda: 20; subscrito à esquerda: 10.(90,48%),
N e. Sobrescrito à esquerda: 21; subscrito à esquerda: 10.(0,27%) e
N e. Sobrescrito à esquerda: 22; subscrito à esquerda: 10.(9,25%). Note que a adição das abundâncias de todos os isótopos naturais de um elemento resulta em 100%.
Dos elementos químicos que têm ocorrência natural, vinte (bê ê, éfe, êne á, a éle, pê, , , cê ó, á ésse, ípsilon, , érre agá, ih, cê ésse, pê érre, tê bê, agá ó, tê ême, á ú e bê í) são encontrados como um único tipo de átomo; todos os outros apresentam dois ou mais isótopos naturais.
O ponto central dêsse item é a percepção de que isótopos pertencem a um mesmo elemento químico e, por isso, são designados por mesmo nome e mesmo símbolo.
A seu critério, você pode mencionar que o único caso de isótopos que têm símbolos e nomes alternativos é o do elemento hidrogênio:
•
H. Sobrescrito à esquerda: 1; subscrito à esquerda: 1., prótio ou hidrogênio leve;•
H. Sobrescrito à esquerda: 2; subscrito à esquerda: 1. ou D. Sobrescrito à esquerda: 2; subscrito à esquerda: 1., deutério ou hidrogênio pesado;•
H. Sobrescrito à esquerda: 3; subscrito à esquerda: 1. ou T. Sobrescrito à esquerda: 3; subscrito à esquerda: 1., trítio ou tritério.Saliente aos estudantes que o hidrogênio leve (cuja abundância isotópica é 99,99%) é o único átomo que não apresenta nêutrons.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- tabela periódica Arranjo no qual os elementos químicos estão dispostos em ordem crescente de número atômico e de acôrdo com a repetição regular de suas propriedades.
- grupo Coluna (vertical) da tabela periódica. Também chamado de família.
- período Linha (horizontal) da tabela periódica.
- isótopos Átomos de mesmo número atômico e diferentes números de massa.
Organização de ideias
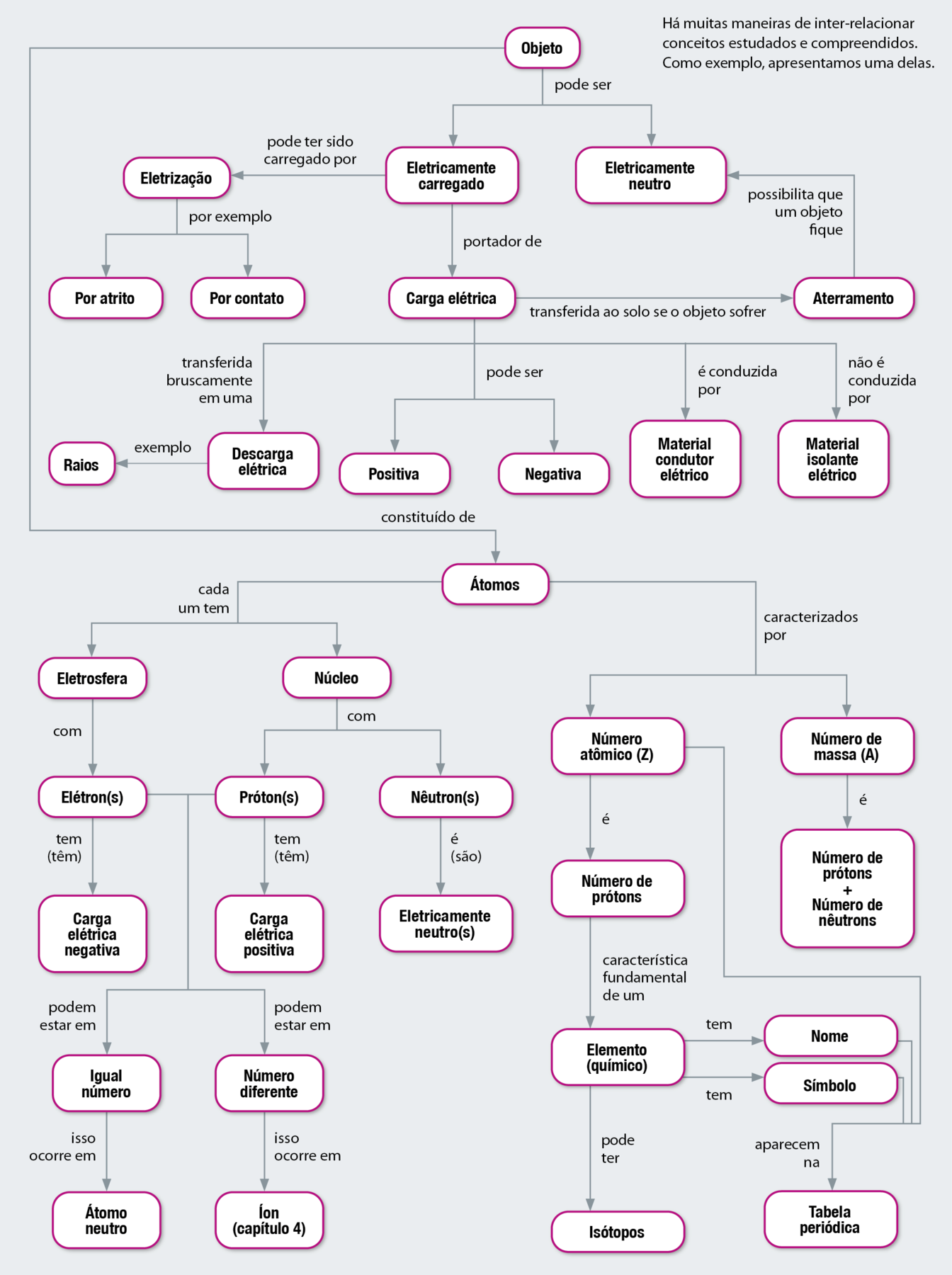
MAPA CONCEITUAL
Respostas e comentários
Sugestão de atividade
Você pode propor aos estudantes que elaborem um pequeno texto sôbre o seguinte: O modelo atômico de Dalton afirma que todos os átomos são indivisíveis e que átomos de um mesmo elemento têm a mesma massa. Proponha duas críticas a esse modelo, embasando‑as em argumentos científicos.
Espera‑se que os estudantes comentem, no texto, que os átomos são constituídos de partículas subatômicas (elétrons, prótons e nêutrons) e, por isso, não são indivisíveis. Além disso, a existência de isótopos evidencia que os átomos de um mesmo elemento não são necessariamente idênticos. No caso, diferem no número de nêutrons e, consequentemente, na massa.
Interdisciplinaridade
Uma atividade diferente e motivadora pode ser denominada Fazendo arte com a tabela periódica.
Nela, a critério do docente de Arte, podem ser exploradas diferentes fórmas de expressão plástica, bi ou tridimensional, em que a tabela periódica e/ou os símbolos dos elementos sejam usados como parte da composição visual da produção. A ideia que aqui se sugere não é a construção de uma tabela artística, mas a “desconstrução” da tabela periódica como parte de um trabalho de criação artística que, espera-se, seja um meio não verbal de estabelecer afeição a esse importante construto científico.
De ôlho na Bê êne cê cê!
A atividade interdisciplinar com Arte, proposta anteriormente, vai ao encontro do desenvolvimento da competência geral 3, posto que constitui estímulo para valorizar e fruir as diversas manifestações artísticas e culturais e também participar de práticas diversificadas da produção artístico-cultural.
Também oportuniza o desenvolvimento da competência geral 4, na medida em que propõe utilizar conhecimentos da linguagem artística para se expressar e partilhar informações, experiências, ideias e sentimentos em diferentes contextos.
A atividade sôbre produção artística envolvendo a tabela periódica pode abranger diversas técnicas e ir ao encontro das seguintes habilidades de Arte: ê éfe seis nove á érre zero seis (“Desenvolver processos de criação em artes visuais, com base em temas ou interêssis artísticos, de modo individual, coletivo e colaborativo, fazendo uso de materiais, instrumentos e recursos convencionais, alternativos e digitais”); ê éfe seis nove á érre zero sete (“Dialogar com princípios conceituais, proposições temáticas, repertórios imagéticos e processos de criação nas suas produções visuais”); ê éfe seis nove á érre três um (“Relacionar as práticas artísticas às diferentes dimensões da vida social, cultural, política, histórica, econômica, estética e ética”).

Atividades
Use o que aprendeu
1. Após atritar vigorosamente um balão de borracha nos cabelos e afastá-lo alguns centímetros, uma pessoa observou o que está na foto. Qual é a explicação científica para os cabelos serem atraídos pelo balão?

- Algumas marcas de biscoitos salgados são comercializadas em pacotes com poucas unidades, em embalagens de plástico. Ao abrir algumas dessas embalagens, é comum pequenos pedaços do plástico rasgado grudarem na mão da pessoa. Proponha uma explicação para esse acontecimento.
- Duas esferas de plástico de diâmetro 1 centímetro foram penduradas a 3 centímetros de distância entre elas, usando um fio isolante, como mostra o desenho.

Separadamente, cada uma delas foi atritada em um pedaço de tecido de lã.
- As cargas elétricas adquiridas pelas esferas têm sinais iguais ou diferentes?
- Faça um desenho que esboce a situação do experimento logo após as esferas serem atritadas na lã.
- Como se chama o processo que fez com que elas adquirissem carga elétrica?
Versão adaptada acessível
- As cargas elétricas adquiridas pelas esferas têm sinais iguais ou diferentes?
- Represente a situação do experimento logo após as esferas serem atritadas na lã.
- Como se chama o processo que fez com que elas adquirissem carga elétrica?
Orientação para acessibilidade
Caso haja estudantes cegos ou com baixa visão na turma, oriente-os a realizar esta atividade em duplas com um colega vidente.
4. Um bastão de vidro foi eletrizado por atrito com um pedaço de tecido de seda. Uma pequena esfera plástica A foi eletrizada por contato com esse bastão.
Um bastão de borracha rígida foi eletrizado por atrito com outro pedaço de tecido de seda. Uma pequena esfera plástica B foi eletrizada por contato com esse bastão.
Consulte as informações necessárias no capítulo e responda: a fôrça entre as esferas A e B é de atração ou de repulsão? Por quê?
5. Em um experimento escolar, um grupo de estudantes construiu o seguinte dispositivo, denominado eletroscópio.
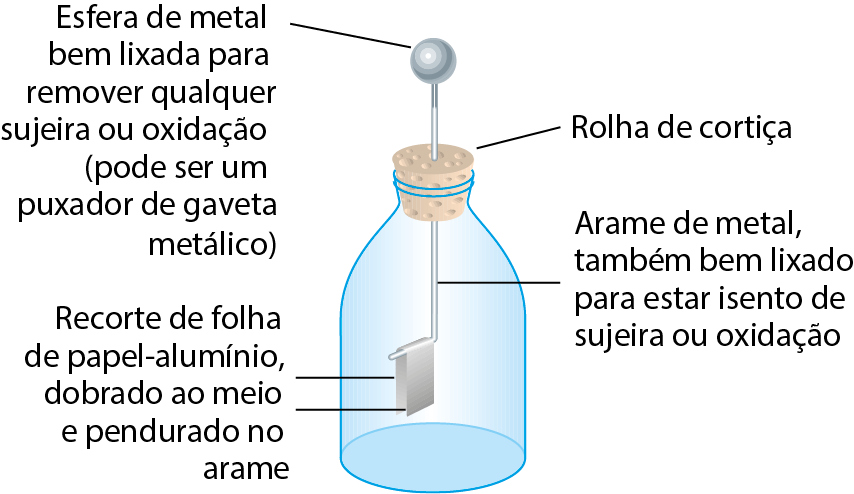
Um bastão de vidro foi eletrizado por atrito com um pedaço de lã. A seguir, o bastão foi encostado na parte de cima do eletroscópio, o que fez com que as metades do pedaço de papel-alumínio se afastassem, como mostrado na ilustração.

- Os metais são condutores elétricos ou isolantes elétricos?
- Tendo em mente sua resposta à pergunta anterior, explique por que as metades da folha de papel-alumínio se afastaram.
- Se um fio terra for ligado à parte metálica do eletroscópio, o que acontecerá com as metades da folha de papel-alumínio? Por quê?
6. Durante a reforma de um prédio, o grosso fio de metal que liga um para-raios ao solo foi cortado. Explique por que isso tornará esse dispositivo ineficiente na proteção contra os raios.
Respostas e comentários
Respostas do Use o que aprendeu
1. Ao serem atritados, o balão e os cabelos adquiriram cargas elétricas de sinais opostos (eletrização por atrito). Assim, os dois objetos passam a se atrair mutuamente.
2. Enquanto a pessoa está abrindo a embalagem, a pele e o plástico eletrizam-se por atrito, adquirindo cargas de sinais opostos. Por isso, o plástico passa a ser atraído pela mão (e a atraí-la, também).
3. a) As cargas elétricas adquiridas pelas esferas têm sinais iguais.
b)
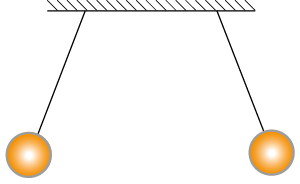
c) As esferas adquiriram carga elétrica pelo processo de eletrização por atrito.
4. O texto do capítulo informa que, ao atritarmos vidro e seda, o vidro adquire carga positiva e a seda, carga negativa. Assim, a esfera A, eletrizada por contato com o vidro, fica positivamente carregada. O texto também informa que, ao atritarmos borracha rígida e seda, a borracha adquire carga negativa e a seda, carga positiva. A esfera B, eletrizada por contato com a borracha, fica negativamente carregada. Portanto, a fôrça entre A (positiva) e B (negativa) é de atração.
5. a) Os metais são condutores elétricos.
b) O bastão de vidro está eletrizado (positivamente) por causa do atrito com a lã. Ao tocar com ele no metal do eletroscópio, parte dessa carga é transferida para o metal e espalha-se por ele, pois trata-se de um material condutor elétrico. Os dois lados do pedaço de papel-alumínio passam a ter carga elétrica de mesmo sinal e, por isso, passam a se repelir.
c) Os dois lados do papel-alumínio voltam à posição inicial porque o fio terra faz o metal ficar neutro.
6. O fio citado permite que as cargas sejam transferidas para o solo, caso o para-raios seja atingido por uma descarga. Se o fio estiver cortado, essa transferência não acontecerá e o dispositivo será ineficiente.
- Quando um técnico que faz manutenção de computadores vai tocar em algum componente interno do aparelho (que está desligado e desconectado da tomada), ele primeiro encosta firmemente as mãos na carcaça metálica do aparelho para, só então, tocar no componente eletrônico. Caso contrário, há o risco de danificar tal componente.
- O que poderia danificar o componente?
- Por que o procedimento adotado pelo técnico evita o dano?
ATENÇÃO!
A parte interna de equipamentos elétricos pode oferecer RISCO DE QUEIMADURAS, CHOQUE ELÉTRICO E MORTE, às vezes mesmo depois de desligados da tomada. Por isso, a abertura e o conserto dêsses equipamentos devem ser feitos por profissionais treinados para isso.
8. (Extraído do vestibular da púqui-São Paulo – Pontifícia Universidade Católica de São Paulo.) Leia com atenção a tira do gato gárfild e analise as afirmativas que se seguem.

- gárfild, ao esfregar suas patas no carpete de lã, adquire carga elétrica. Esse processo é conhecido como eletrização por atrito.
- gárfild, ao esfregar suas patas no carpete de lã, adquire carga elétrica. Esse processo é conhecido como eletrização por indução.
- O estalo e a eventual faísca que gárfild pode provocar, ao encostar em outros corpos, são devidos à movimentação da carga acumulada no corpo do gato, que é transferida de seu corpo para os outros corpos.
Estão certas:
- um, dois e três
- um e dois
- um e três
- dois e três
- apenas um
A tabela periódica existe para consulta.Utilize-a sempre que julgar necessário.
- Tudo ao nosso redor é formado por átomos de elementos químicos.
- Quais são as partículas que formam um átomo?
- Como se conceitua, atualmente, elemento químico?
10. Os médicos utilizam átomos de
C o. Sobrescrito à esquerda: 57; subscrito à esquerda: 27. no diagnóstico de problemas no metabolismo da vitamina .a. Pesquise qual é o nome do elemento químico de símbolo cê ó.
b. Explique o significado do número 27 que aparece em
C o. Sobrescrito à esquerda: 57; subscrito à esquerda: 27..c. Explique o significado do número 57 que aparece em
C o. Sobrescrito à esquerda: 57; subscrito à esquerda: 27..- Um átomo muito importante para a saúde humana apresenta núcleo com 11 prótons e 12 nêutrons.
- Qual é seu número atômico?
- Qual é seu número de massa?
- Após consultar a tabela periódica, represente o átomo em questão, escrevendo seu símbolo acompanhado do número atômico e do número de massa.
12. Em 1986, um acidente nuclear muito grave aconteceu na usina nuclear de xernobíl, na Ucrânia. Tal acidente liberou vários átomos perigosos na atmosfera, entre os quais
Sr. Sobrescrito à esquerda: 90; subscrito à esquerda: 38., I. Sobrescrito à esquerda: 131; subscrito à esquerda: 53. e C s. Sobrescrito à esquerda: 137; subscrito à esquerda: 55.. Quantos prótons e quantos nêutrons possui cada um dêsses átomos?13. Copie as frases em seu caderno e complete-as para que fiquem corretas.
Na tabela periódica, os elementos estão colocados em ordem crescente de ◼. As linhas (horizontais) são denominadas ◼, e as colunas (verticais) são chamadas de ◼ ou ◼.
- Consultando a tabela periódica, localize o grupo a que pertencem os elementos químicos que têm os seguintes símbolos:
- agá ê, êne ê, á érre
- éfe, cê éle, Bê érre
- éle í, êne á, cá
- cê, ésse êne, pê bê
- ême gê, cê á , bê á
- óh, ésse, ésse ê
- êne, pê, á ésse
- bê, a éle, gê á
- Consultando a tabela periódica, escreva em seu caderno o nome dos elementos envolvidos na questão anterior.
Respostas e comentários
7. a) Uma descarga elétrica proveniente da mão, caso ela esteja eletrizada.
b) Porque, ao tocar no metal da carcaça metálica, a carga elétrica presente na mão se transferirá para ele.
8. Alternativa C.
um Certa. A situação é de eletrização por atrito.
dois Errada. A eletrização descrita ocorre por atrito.
três Certa. A descarga elétrica transfere carga entre os dois corpos.
9. a) Prótons, nêutrons e elétrons. (Exceção seja feita ao isótopo
H. Sobrescrito à esquerda: 1; subscrito à esquerda: 1., que não apresenta nenhum nêutron.)
b) Conjunto de todos os átomos que apresentam o mesmo número atômico (número de prótons no núcleo).
10. a) Consultando a tabela periódica, determina-se o nome: cobalto.
b) É o número atômico do cobalto, que indica quantos prótons há no núcleo de cada átomo dêsse elemento.
c) É o número de massa do átomo de
C o. Sobrescrito à esquerda: 57; subscrito à esquerda: 27.; indica a soma do número de prótons com o de nêutron.
11. a) Seu número atômico é 11, pois tem 11 prótons.
b) Seu número de massa é 23, que corresponde à soma do número de prótons (11) e de nêutrons (12).
c) O elemento é o sódio (êne á) e o átomo em questão é representado assim:
N a. Sobrescrito à esquerda: 23; subscrito à esquerda: 11..
12. O átomo
S r. Sobrescrito à esquerda: 90; subscrito à esquerda: 38.apresenta 38 prótons, pois seu número atômico é 38. O número de nêutrons é 52, que pode ser determinado subtraindo o número de prótons (38) do número de massa (90). Analogamente, determinamos que o
I. Sobrescrito à esquerda: 131; subscrito à esquerda: 53.tem 53 prótons e 78 nêutrons e que o
C s. Sobrescrito à esquerda: 137; subscrito à esquerda: 55.tem 55 prótons e 82 nêutrons.
13. Na tabela periódica, os elementos estão colocados em ordem crescente de número atômico. As linhas (horizontais) são denominadas períodos, e as colunas (verticais) são chamadas de grupos (ou famílias).
14. a) Grupo 18.
b) Grupo 17.
c) Grupo 1.
d) Grupo 14.
e) Grupo 2.
f) Grupo 16.
g) Grupo 15.
h) Grupo 13.
15. a) Hélio, neônio, argônio.
b) Flúor, cloro, bromo.
c) Lítio, sódio, potássio.
d) Carbono, estanho, chumbo.
e) Magnésio, cálcio, bário.
f) Oxigênio, enxofre, selênio.
g) Nitrogênio, fósforo, arsênio.
h) Boro, alumínio, gálio.
De ôlho na Bê êne cê cê!
Na seção Use o que aprendeu, encontra-se oportunidade de trabalhar novamente a competência específica 3, na atividade 1, e a competência específica 2, na atividade 7.

Atividade
Explore diferentes linguagens
A critério do professor, estas atividades poderão ser feitas em grupos.
FOTOGRAFIA
As três atividades a seguir referem-se à fotografia, tirada durante a transferência de combustível de um caminhão-tanque para o tanque de um avião. Antes de iniciar a transferência e durante todo o processo, a parte metálica do avião é ligada ao solo por meio de um fio, indicado pela seta vermelha.

- Como se chama o procedimento de ligar um objeto ao solo com um fio condutor?
- Que nome se dá ao fio usado para tal fim?
- Por que é necessário esse contato da parte metálica do avião com o solo durante a transferência do combustível?
CHARGE
Observe a charge e, a seguir, realize as atividades 4 a 7.

- Explique a razão de os cabelos do personagem terem se arrepiado.
- Com base na resposta que você apresentou para a atividade 4, o que você acha que aconteceu com a blusa de lã?
- O homem da charge escureceu a sala, aproximou a blusa de uma maçaneta de metal e viu uma pequena faísca saltar entre esses objetos. Explique por que isso ocorreu.
- Por que, em um dia chuvoso, provavelmente não aconteceria o que está retratado na charge?
TIRINHA E TABELA PERIÓDICA
As atividades 8 a 10 se referem à tirinha.

- No terceiro quadrinho, o estudante se refere a um conceito químico. Explique o significado dêsse conceito e que relação tem com os elementos químicos.
- Consultando a tabela periódica, deduza a combinação atual do cadeado do estudante.
- Também com base na tabela periódica, deduza a combinação do cadeado dele no ano anterior.
Respostas e comentários
Respostas do Explore diferentes linguagens
1. Aterramento.
2. Fio terra.
3. Porque, se ela estiver eletrizada, poderá haver uma descarga elétrica para algum objeto ou pessoa que dela se aproxime, e a faísca poderá incendiar o vapor do combustível.
4. O atrito da blusa de lã com os cabelos (limpos e secos) faz com que a blusa e os cabelos se eletrizem por atrito. Como os fios de cabelo passam a estar eletrizados com cargas de mesmo sinal, eles se repelem mutuamente.
5. Considerando que a eletrização dos cabelos se deu por atrito, então a blusa de lã ficou eletrizada com carga de sinal oposto ao da carga elétrica dos cabelos.
6. Quando a blusa eletrizada chega bem perto da maçaneta, ocorre uma pequena descarga elétrica (faísca) entre a lã e o metal, transferindo carga para o metal.
7. A carga adquirida pelos cabelos (e também pela blusa) é transferida para a água atmosférica (eletrização por contato). Isso diminui a chance de os cabelos permanecerem eletrizados.
8. O estudante se refere ao conceito de número atômico, que corresponde ao número de prótons no núcleo de um átomo. Cada elemento químico é caracterizado pelo número de prótons no núcleo de seus átomos, ou seja, cada elemento químico tem seu próprio número atômico.
9. cê (Z = 6); pê (Z = 15); (Z = 25).
A combinação é 61525.
10. (Z = 36); êne (Z = 7); tê Í (Z = 22).
A combinação era 36722.
TIRINHA E TABELA
Observe a tirinha e a tabela seguinte para realizar as atividades 11 a 13.

|
Símbolo do elemento |
Número atômico |
Porcentagem em massa no corpo humano |
Porcentagem em massa na crosta terrestre |
|---|---|---|---|
|
H |
1 |
10 |
0,9 |
|
C |
6 |
23 |
0,08 |
|
N |
7 |
2,6 |
0,03 |
|
O |
8 |
61 |
49,3 |
|
Na |
11 |
0,14 |
2,7 |
|
Mg |
12 |
0,027 |
1,9 |
|
Al |
13 |
— |
7,6 |
|
Si |
14 |
— |
25,8 |
|
P |
15 |
1,1 |
0,12 |
|
S |
16 |
0,2 |
0,06 |
|
Cl |
17 |
0,12 |
0,2 |
|
K |
19 |
0,2 |
2,4 |
|
Ca |
20 |
1,4 |
3,4 |
|
Fe |
26 |
0,0060 |
4,7 |
Fonte: Emislee, J. Nature's building blocks: an A-Z guide to the elements. New edition. Oxford: Oxford University Press, 2011. página 8; Bettelrim, F. A. êti áli. Introduction to General, Organic, and Biochemistry. décima segunda edição Boston: Cengage, 2020. página 32.
- O político entendeu corretamente a pergunta que lhe foi dirigida? Justifique, explicando a que o perguntador se referiu ao realizar seu questionamento e a que o político se referiu ao responder.
- No último quadrinho, o elaborador da tirinha empregou um critério para ordenar a lista. Que critério é esse?
- Se fôssemos citar mais um item na lista, qual seria ele? Por quê?
Seu aprendizado não termina aqui
Dependendo do local em que você mora, em certas épocas do ano, podem ser frequentes pequenos “choques elétricos” ao tocar em objetos metálicos, tais como maçanetas, chaves e carcaça de automóveis.
Quando esse fenômeno acontecer, procure avaliar as circunstâncias envolvidas (roupa, piso, calçado, umidade do ar etcétera) e, usando o que aprendeu neste capítulo, tente encontrar uma explicação para o ocorrido.
Respostas e comentários
11. Ao fazer o questionamento, o perguntador se referiu às necessidades do cidadão, àquilo que tem importância fundamental para a qualidade de vida de cada indivíduo. O político falou de elementos químicos presentes no corpo humano. Portanto, ele não entendeu a pergunta (ou não quis responder ao questionamento).
12. Ordem decrescente de abundância no corpo humano (considerando porcentagem em massa).
13. Magnésio, pois é o próximo em ordem decrescente de abundância no corpo humano.
De ôlho na Bê êne cê cê!
As atividades 11 a 13 da seção Explore diferentes linguagens oferecem novamente a oportunidade para desenvolvimento da competência geral 4, já citada anteriormente neste capítulo.
Há também, neste conjunto de atividades, a possibilidade de desenvolver a competência específica 4, que envolve avaliar aplicações e implicações políticas e culturais da ciência e de suas tecnologias para propor alternativas aos desafios do mundo contemporâneo.
A seção Seu aprendizado não termina aqui, ao estimular os estudantes a explicar fenômenos elétricos ocorridos no cotidiano, possibilita, mais uma vez neste capítulo, o desenvolvimento da competência específica 2.