
CAPÍTULO 3 Ondas eletromagnéticas e modelo atômico de Bór

Respostas e comentários
Este capítulo e seus conteúdos conceituais
- Noções sôbre a diferença entre ondas mecânicas e ondas eletromagnéticas
- Noções da presença de ondas eletromagnéticas em nosso cotidiano
- Espectros atômicos
- Modelo atômico de Bór
- Fatos cotidianos explicáveis pelo modelo de Bór
- Distribuição eletrônica nas camadas para elementos representativos
- Distribuição eletrônica e tabela periódica
Este capítulo oferece, inicialmente, uma noção sôbre ondas eletromagnéticas e sua importância. Esse trabalho inicial é essencial para que, a seguir, possa ser apresentado o modelo atômico de Bór.
Na sequência, o capítulo discute o papel da absorção e da emissão de ondas eletromagnéticas nas transições eletrônicas e apresenta exemplos de fenômenos que podem ser explicados pelo modelo de Bór. Finalmente, aborda distribuição eletrônica (de átomos neutros) nas camadas e sua relação com a tabela periódica.
Foto de abertura
Reserve um tempo da aula para que os estudantes respondam às questões propostas na legenda. Esse momento permitirá que você obtenha dados quanto aos conhecimentos prévios da turma sôbre o tema. Ao final do capítulo, volte às respostas e convide-os a reformulá-las, se necessário, de acôrdo com o que aprenderam.
A passagem de corrente elétrica faz com que elétrons dos átomos do gás sejam promovidos para níveis de maior energia. No retôrno ao estado fundamental, há emissão de luz. Nos pontos em que alguém toca a esfera, o vidro é conectado eletricamente ao solo (aterramento), pois o corpo humano é razoavelmente condutor de eletricidade. Assim, as descargas elétricas se dirigem preferencialmente aos locais da esfera tocados pela pessoa.
Emissão de luz pelo retôrno de elétrons excitados ocorre também, por exemplo, em luminosos de neônio, lâmpadas fluorescentes, vaga-lumes, fogos de artifício e teclas fosforescentes de interruptores.
De ôlho na Bê êne cê cê!
A foto de abertura do capítulo e sua legenda favorecem o desenvolvimento da competência geral 2, pois as perguntas propostas incentivam os estudantes a exercitar a curiosidade intelectual e recorrer à abordagem própria das ciências, incluindo a investigação, a reflexão, a análise crítica, a imaginação e a criatividade, para investigar causas e elaborar hipóteses com base nos conhecimentos das diferentes áreas.
Motivação
A critério do professor, esta atividade poderá ser realizada em grupos.

Objetivo

Averiguar se descargas elétricas interferem na recepção do sinal das emissoras de rádio ei ém.
Você vai precisar de:
- um rádio ei ém com antena
- uma pilha de 1,5 vôlti
- fita adesiva
- uma sala que possa ser totalmente escurecida
- dois pedaços de fio elétrico fino com as extremidades desencapadas (PEÇA A UM ADULTO que as desencape)
Procedimento
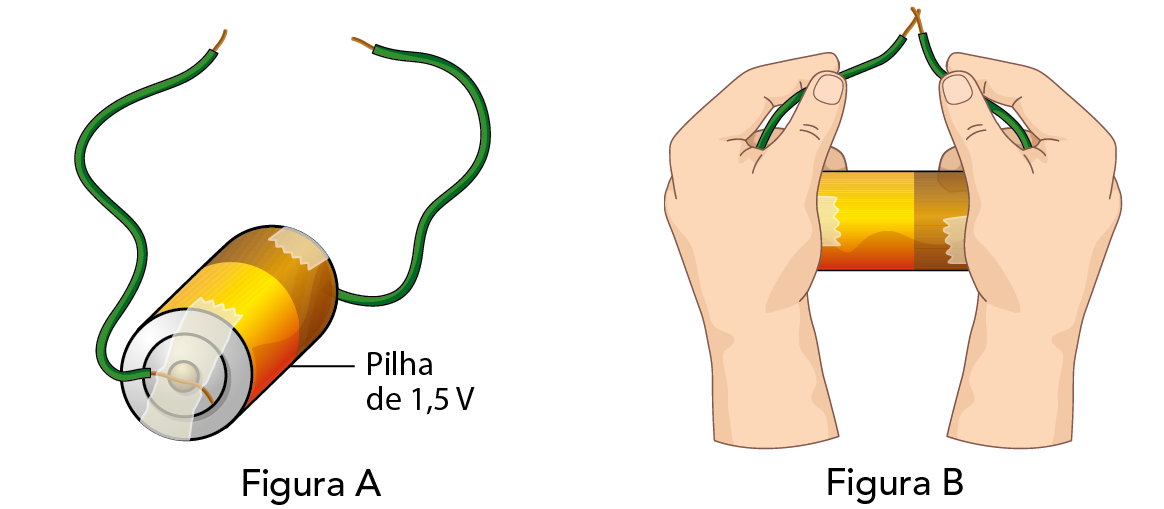
- Grude, com fita adesiva, uma das extremidades de um fio no polo positivo da pilha e uma das extremidades do outro fio no polo negativo, como mostra a figura A.
- Segure os fios pela parte encapada. Escureça a sala. Raspe repetidas vezes as extremidades soltas dos dois fios, como na figura B. Nessa etapa do experimento você deve ter constatado que, ao raspá-las, ocorreu um leve faiscamento. Clareie a sala.
- Ligue o rádio e sintonize uma emissora ei ém.
- Segure a pilha próximo à antena e volte a raspar repetidas vezes as extremidades dos fios. O que acontece com a qualidade da recepção da emissora quando as extremidades são raspadas? Como explicar o observado?
- Ao final, remova os fios para que suas extremidades não permaneçam encostadas, o que descarregaria a pilha.
Desenvolvimento do tema
1. Ondas
Ondas em uma corda
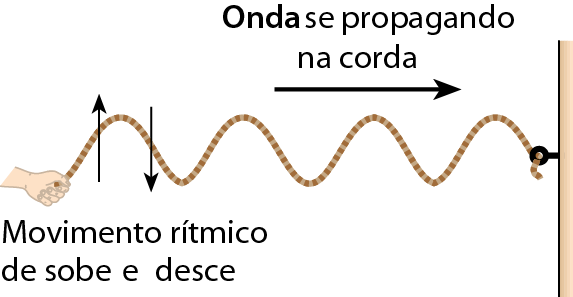
Considere uma corda esticada, com uma de suas extremidades presa a uma parede e a outra segurada por uma pessoa. Se a pessoa realizar um movimento rítmico de sobe e desce com a mão, fará com que uma onda se propague na corda esticada, como mostra o esquema.
O conceito de onda
Ondas são perturbações regulares que se propagam, mas não transportam matéria. As ondas apenas transportam energia. A Ondulatória é a parte da Física que estuda as ondas e os fenômenos relacionados a elas.
Fonte: , V. J.; , D. J. Inquiry into Physics. oitava edição Boston: Cengage, 2018. página 215.
Respostas e comentários
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero cinco
“Investigar os principais mecanismos envolvidos na transmissão e recepção de imagem e som que revolucionaram os sistemas de comunicação humana.”
Com a atividade da seção Motivação, inicia-se o desenvolvimento da habilidade ê éfe zero nove cê ih zero cinco, que prossegue neste capítulo e que se concluirá na atividade de encerramento da unidade B.
A atividade experimental proposta nessa seção Motivação pretende iniciar a seguinte problematização: como o faiscamento elétrico que ocorre entre as duas pontas desencapadas dos fios, quando o circuito é fechado, pode interferir na recepção do sinal ei ém?
Ao chegar no terceiro parágrafo do subitem Rádio ei ém do item 3, caso os estudantes não tenham conseguido explicar isso antes, eles descobrirão que um faiscamento elétrico cria ondas eletromagnéticas que interferem na recepção das ondas de rádio ei ém. Isso propicia a percepção de que ondas eletromagnéticas (1) não são visíveis e (2) podem ser produzidas em fenômenos de natureza elétrica.
Item 1
Apresente aos estudantes o conceito de onda, conforme está no livro do estudante. Esse conceito será importante não apenas para o desenvolvimento dêste capítulo, mas também do capítulo 5, sôbre ondas sonoras.
Ondas apresentam efeitos detectáveis
Considere duas rolhas de cortiça, A e B, flutuando na superfície parada da água, a certa distância uma da outra. Utilizando o dedo para fazer com que a rolha A realize um movimento de sobe e desce, a água, inicialmente parada, também começará a oscilar. Aparece uma onda na superfície da água. E a outra rolha, B, que estava inicialmente parada, também passa a oscilar num movimento de sobe e desce. A onda transporta energia de uma rolha até a outra, colocando-a em movimento.
Se a água fosse invisível, não veríamos a onda que se propaga em sua superfície. Mas, se uma rolha flutuante começasse a oscilar, estaríamos observando uma evidência da propagação da onda.
Esse ponto é muito importante para você entender o que será estudado neste capítulo: mesmo que uma onda não seja vista, os seus efeitos podem ser detectados, isto é, podem ser percebidos de algum modo. Nesse exemplo, uma simples rolha funciona como um detector de ondas.

Fonte: bóu, L. êti áli. Smithsonian supersimple Physicsthe ultimate bite-size study guide Londres: Dorling Kindersley, 2021. página 113.
Frequência de uma onda
Uma das características importantes de qualquer onda é sua frequência, ou seja, o número de oscilações por unidade de tempo. A unidade mais comum usada internacionalmente para expressar a frequência de uma onda é o hertz, simbolizado por agá zê, que pode ser interpretado como uma oscilação por segundo.
Assim, por exemplo, dizer que a corda de um violino, colocada em vibração pelo músico, emite uma onda sonora de frequência 440 agá zê (lê-se 440 hertz) significa dizer que essa onda sonora produzida pelo instrumento realiza quatrocentas e quarenta oscilações a cada segundo.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• onda
• frequência
• hertz (agá zê)
2. Ondas: mecânicas versus eletromagnéticas
Ondas em cordas, ondas na superfície da água e ondas sonoras são exemplos de ondas mecânicas. Esse tipo de onda precisa de um meio material para se propagar e, portanto, não se propaga no vácuo (ausência de matéria).
Já a luz é classificada no grupo das ondas (ou radiações) eletromagnéticas, aquelas que não necessitam de um meio material para propagar-se, ou seja, aquelas que conseguem se propagar no vácuo.
Respostas e comentários
Conteúdos procedimentais sugeridos
- Realizar uma demonstração relacionada às ondas eletromagnéticas.
- Consultar corretamente a tabela periódica, visando à obtenção do número atômico de um elemento.
- Associar a posição de um elemento representativo na tabela periódica (período e grupo) à sua distribuição eletrônica em camadas e vice-versa.
Realizar uma demonstração relacionada às ondas eletromagnéticas é um conteúdo que pode ser desenvolvido com o experimento que abre o capítulo (comentário sôbre ele feito anteriormente).
Os demais conteúdos procedimentais elencados para este capítulo podem ser desenvolvidos com as atividades finais do capítulo.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- onda Uma perturbação que se propaga, transferindo energia de um ponto para outro, mas não matéria.
- frequência Número de oscilações realizadas por unidade de tempo.
- hertz (agá zê) Unidade para expressar frequência, que podemos interpretar como “oscilação por segundo”.
Outros exemplos de ondas eletromagnéticas são o infravermelho, o ultravioleta, as ondas de rádio e de tevê, as micro-ondas, os raios X e os raios gama.
Todas as ondas eletromagnéticas possuem a mesma velocidade de propagação no vácuo: 300 mil quilômetros por segundo. Nos materiais, essa velocidade é menor, embora nos gases seja praticamente a mesma. As diversas ondas eletromagnéticas diferem quanto à frequência e, em decorrência dela, nos seus efeitos, na sua utilidade prática e no tipo de dispositivo necessário para detectá-las.
O esquema a seguir mostra o chamado espectro eletromagnético e os nomes atribuídos às várias ondas eletromagnéticas, dependendo de sua frequência.

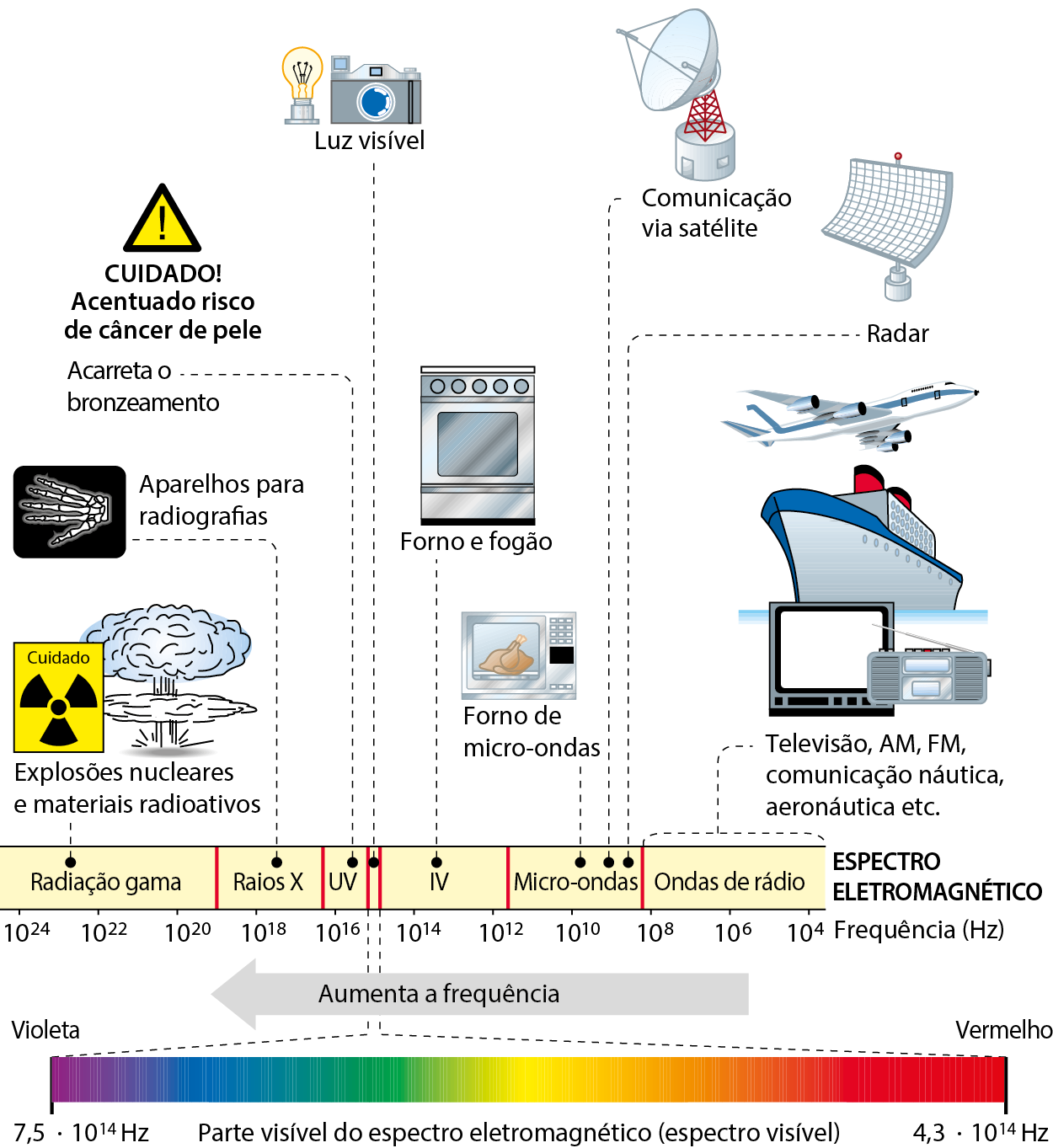
Representação esquemática fóra de proporção do espectro eletromagnético, mostrando os diferentes nomes dados às ondas eletromagnéticas dependendo da frequência (u vê indica ultravioleta, e í vê, infravermelho). Lembre-se de que significa .10000, significa ..1000000, e assim por diante.
Fonte: Figura elaborada a partir de uólquer, J. Halliday & Resnick Fundamentals of Physics. décima edição reeditada e estendida. Hoboken: John Wiley, 2018. página 973.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• onda mecânica
• onda eletromagnética

3. Características e aplicações das ondas eletromagnéticas
Rádio ei ém
As emissoras de rádio ei ém transmitem sua programação por meio de ondas eletromagnéticas de frequências entre 535 quilorrértz e .1605 quilorrértz (1 cá agá zê = 1 quilohertz = rértiz). Cada emissora tem sua frequência específica dentro dessa faixa, e quando você sintoniza a emissora está selecionando a frequência dela.

Respostas e comentários
Aprofundamento ao professor
Veja, na parte inicial dêste Manual do professor, na seção Aprofundamento ao professor, o texto “Como se mede a velocidade com que uma estrela se afasta da Terra?”.
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- onda mecânica Onda que se propaga apenas em um meio material.
- onda eletromagnética Onda que pode se propagar em um meio material ou no vácuo.
Item 2
Auxilie os estudantes na leitura do esquema do espectro eletromagnético.
Retome (do 6º ano), que o espectro da luz visível (isto é, a porção visível do espectro eletromagnético) pode ser obtido pela decomposição da luz solar branca ao passar por um prisma de vidro.
Saliente que o espectro visível é constituído de ondas com diferentes frequências e que correspondem às inúmeras diferentes tonalidades de cores presentes no arco-íris.
De ôlho na Bê êne cê cê!
Os itens 2 e 3 auxiliam os estudantes a compreender conceitos fundamentais e estruturas explicativas das Ciências da Natureza, de modo a sentir segurança no debate de questões científicas, tecnológicas e do mundo do trabalho e continuar aprendendo, trabalhando, assim, o que é enunciado na competência específica 2.
Esses itens também vão ao encontro do preconizado na competência específica 4, pois auxiliam em avaliar aplicações da ciência e de suas tecnologias para propor alternativas aos desafios do mundo contemporâneo, incluindo aqueles relativos ao mundo do trabalho.
tê cê tê Ciência e Tecnologia
O Tema Contemporâneo Transversal Ciência e Tecnologia, inserido na macroárea homônima, aparece recorrentemente em trechos dêste capítulo: na representação esquemática do espectro eletromagnético, do item 2; no item 3; no texto Em destaque intitulado “Refletores parabólicos”; e nos subitens Fogos de artifício, Luminosos e lâmpadas de gás e Teclas e ponteiros fosforescentes, do item 5. Este tê cê tê é pertinente ao capítulo no que tange às aplicações tecnológicas presentes no cotidiano que decorrem de conhecimentos científicos referentes ao espectro eletromagnético.
Transmissões em ei ém estão muito sujeitas a interferências de algumas outras fontes de radiações eletromagnéticas, como os fios de alta-tensão e os raios (relâmpagos).
No experimento da abertura do capítulo, ao raspar as pontas dos fios você produziu uma simulação de descarga elétrica, um raio em pequeníssima escala. E, como você provavelmente percebeu, isso já é o suficiente para causar ruídos na recepção do sinal da emissora ei ém.
Rádio éfe ême e tevê
Transmissões em éfe ême são realizadas por meio de ondas eletromagnéticas na faixa de frequências de 88 mégarrértis a 108 mégarrértis (1 ême agá zê = 1 megahertz = rértiz).
Ao contrário do ei ém, o sinal éfe ême sofre pouca ou nenhuma interferência de raios ou de fios de alta-tensão, mas tem um alcance bem menor.
As emissoras de tevê também transmitem imagem e som por meio de ondas eletromagnéticas. Cada canal de tevê tem sua própria frequência.
Os canais 2 a 6 de vê agá éfe (do inglês very high frequency) correspondem à faixa de 54 mégarrértis a 88 mégarrértis, e os canais 7 a 13, à faixa de 174 mégarrértis a 216 mégarrértis. A transmissão éfe ême é feita num intervalo de frequências entre os canais 6 e 7 de tevê. A transmissão dos canais 14 a 69 de U agá éfe (ultra high frequency) corresponde à faixa de 407 mégarrértis a 806 mégarrértis.

Telefone celular
A região coberta pela telefonia celular é dividida em áreas, chamadas células. Cada célula possui uma estação com antena, ligada à central de telefonia. Um aparelho celular comunica-se com essa estação por meio de duas ondas eletromagnéticas: uma que é enviada do aparelho para a estação, e outra, da estação para o aparelho.
Cada estação permite que um número limitado de aparelhos esteja em uso simultâneo. Por isso, em células com muitos usuários é frequente haver congestionamento do sistema.

Micro-ondas
As ondas eletromagnéticas com frequências na faixa aproximada de rértiz (1 gê agá zê = 1 gigahertz) a rértiz correspondem às micro-ondas.
Nos fornos de micro-ondas existe um transmissor que emite micro‑ondas de frequência apropriada dentro do compartimento em que o alimento é colocado. Tais ondas transferem energia para as moléculas de água do alimento. A água se aquece e, por consequência, aquece também os demais constituintes do alimento. Materiais como o vidro, a cerâmica e o plástico não são aquecidos diretamente pelo aparelho.

Respostas e comentários
Aprofundamento ao professor
Veja, na parte inicial dêste Manual do professor, na seção Aprofundamento ao professor, os textos “Como funciona o gê pê ésse?” e “Como funciona o radar policial?”.
Item 3
Para trabalhar esse item, proponha uma sala de aula invertida. Após o estudo, estudantes serão sorteados (ou escolhidos) para apresentar aos demais o que entenderam.
Inicie pedindo aos estudantes que leiam todo o conteúdo e elaborem resumos esquemáticos. Estes serão transcritos por eles na lousa e utilizados para ilustrar a explicação aos demais. Durante a leitura, circule na sala para esclarecer eventuais dúvidas.
Quando todos terminarem, sorteie (ou escolha) um estudante para abordar cada subitem do item 3. Como ele consiste de 9 subitens, 9 estudantes serão convocados para realizar a exposição. Lembre-os de transcrever na lousa o resumo feito e utilizá-lo durante a explicação.
Enquanto os estudantes estiverem apresentando, faça pausas periódicas para questionar os demais sôbre algum ponto. Complemente com o que for necessário, a fim de que todo o conteúdo tenha sido trabalhado.
Responda a eventuais perguntas e finalize o trabalho recapitulando os pontos essenciais discutidos.
Não se esqueça de revisitar o resultado do experimento da seção Motivação do início dêste capítulo. Ele envolve um procedimento no qual um pequeno faiscamento elétrico cria ondas eletromagnéticas que interferem na recepção das ondas de rádio ei ém. O resultado ajuda a compreender que ondas eletromagnéticas (1) não são visíveis e (2) podem ser produzidas em fenômenos elétricos.
No terceiro parágrafo do subitem Rádio ei ém, os estudantes encontram a explicação do resultado do experimento e podem comparar com a que haviam proposto. Convide-os a revisitar suas opiniões iniciais e a reformulá-las.
As micro-ondas são empregadas em transmissões via satélite (tevê, telefonia, rádio etcétera). Os aparelhos de localização por gê pê ésse recebem sinais de satélites em órbita por meio de micro-ondas. Esse tipo de onda eletromagnética também é usado nos radares, aparelhos que emitem micro-ondas e captam o retôrno dessas ondas após serem refletidas por objetos. Radares permitem avaliar a posição e/ou a velocidade de objetos como aviões, mísseis e automóveis.


EM DESTAQUE
Refletores parabólicos
Quando um feixe de ondas eletromagnéticas paralelas atinge um refletor parabólico côncavo, essas ondas são refletidas e passam todas por um mesmo ponto, denominado ponto focal do refletor.
Por causa disso, essas estruturas são muito úteis na recepção de sinais fracos emitidos de locais distantes, tais como ondas de rádio provenientes de satélites de comunicação ou ondas de luz provenientes de uma estrela. As ondas, após a reflexão, são concentradas em um único ponto e, por isso, o sinal é amplificado.
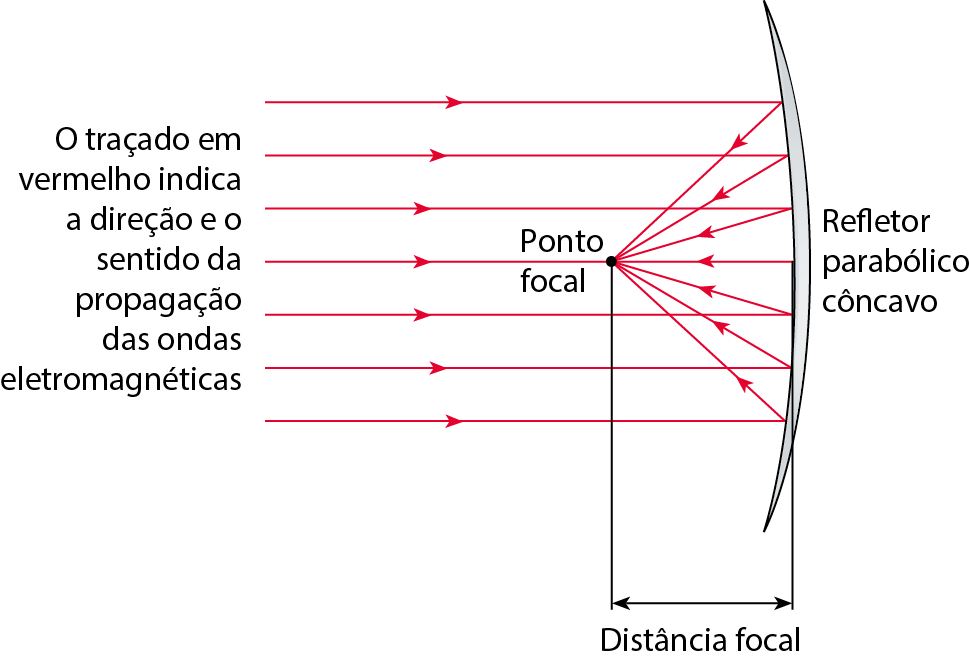
Fonte: , V. J.; , D. J. Inquiry into Physics. oitava edição Boston: Cengage, 2018. página 341.

Elaborado com dados obtidos de: iãng, D.; , S. Cutnell & Johnson Physics. décima primeira edição Hoboken: John Wiley, 2018.
Respostas e comentários
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero cinco
“Investigar os principais mecanismos envolvidos na transmissão e recepção de imagem e som que revolucionaram os sistemas de comunicação humana.”
Estudando até o item 3, os estudantes já adquiriram conhecimentos referentes às ondas eletromagnéticas utilizadas em comunicação, sabem que elas podem se propagar no vácuo e percebem que a frequência é um aspecto que as diferencia e caracteriza.
O desfecho do desenvolvimento dessa habilidade ocorrerá na atividade de encerramento da unidade B, quando os estudantes pesquisarão o processo de emissão e de recepção de ondas e o representarão esquematicamente. Naquela atividade, outras duas habilidades da Bê êne cê cê envolvendo ondas eletromagnéticas também terão o ápice do seu desenvolvimento.
Interdisciplinaridade e visita guiada
Um atividade que pode ser realizada a esta altura é fazer uma visita guiada a uma emissora de rádio ou de tevê, que pode ser realizada interdisciplinarmente com Língua Portuguesa, Arte e História.
Essa atividade pode prosseguir com a busca e seleção de informações relevantes sôbre os diversos meios eletrônicos de comunicação, suas características e sua importância para a sociedade.
A expansão da atividade para englobar Língua Inglesa permite explorar também temas como anglicismo (palavras e expressões provenientes da língua inglesa), influência cultural e massificação.
Estruture a atividade conforme recomendado no item Visitas guiadas, da parte inicial dêste Manual do professor, considerando as três grandes etapas do procedimento lá explicadas.
Em função de uma visita prévia e também das parcerias estabelecidas com docentes de outros componentes, prepare a lista de objetivos da visita e discuta-a com os estudantes. Perguntas que podem ser propostas: Qual é a formação dos diversos profissionais que trabalham na emissora? Qual é a relevância dos conhecimentos de Língua Portuguesa e de Língua Inglesa para a atuação dos jornalistas e outros profissionais na empresa? Como diferentes aspectos da Arte se expressam nas atividades da emissora? Que tecnologias estão envolvidas na produção e na transmissão? Como essas tecnologias funcionam? Que áreas científicas se relacionam a essas tecnologias e às demais atividades realizadas no local? Qual é a relevância social da atuação dessa emissora?
Caso não seja possível visitar uma emissora de rádio ou tevê, adapte a atividade para realizar uma visitação à redação de uma empresa jornalística que atue pela internet, de um jornal ou de uma revista. Nestes últimos dois casos, como existe também a parte impressa, você pode preferir realizar a visita durante a abordagem do capítulo 6 (com o estudo das cores primárias).
Após a visita e a coleta de dados, combine com os estudantes como as equipes deverão entregar os resultados. Estabeleça uma data e explique o formato desejado. (Pôster? Cartaz digital? Relatório escrito? Produção de um vídeo ou áudio para podcast? Postagem no blog? Apresentação em sala usando Tê dê i cês?) Explique com clareza que aspectos são esperados, como os estudantes serão avaliados e esclareça as dúvidas.
Uma opção interessante para desenvolver esse tipo de atividade é incumbir cada equipe de um subconjunto da proposta total e solicitar que a entrega dos resultados inclua uma apresentação ao restante da turma com a utilização de recursos digitais (de acôrdo com a conveniência e a disponibilidade). Essa proposta é especialmente útil se o local que foi visitado for muito rico em opções que despertam o interêsse dos estudantes. Nesse caso, a apresentação em público possibilita que os estudantes se inteirem a respeito das temáticas que ficaram a cargo de outras equipes, propiciando a todos uma visão ampla dos desdobramentos decorrentes da visita guiada.
É oportuno auxiliar os estudantes em aspectos como a assertividade na exposição, a clareza e a objetividade de materiais audiovisuais produzidos para a apresentação e o equilíbrio entre os usos da linguagem culta e da linguagem coloquial ao falar em público.
Luz visível
A retina humana é capaz de perceber as ondas eletromagnéticas de frequências desde aproximadamente rértiz até cêrca de rértiz. Dentro dessa faixa, chamada espectro visível, estão todas as cores do arco-íris, que, embora muitas pessoas digam serem sete, na verdade são infinitas, já que há inúmeros tons de vermelho, de alaranjado, de amarelo etcétera
Os tons de vermelho aparecem na extremidade de frequência mais baixa do espectro visível, e o violeta aparece na extremidade de frequência mais alta.
Infravermelho
Infravermelho significa “abaixo do vermelho”. Esse nome indica que a frequência dessas ondas, não percebidas pelo ôlho humano, é inferior à frequência da luz vermelha.
O infravermelho é o responsável, por exemplo, por boa parte do transporte de calor de uma fogueira até as pessoas ao seu redor, da chama de um forno até o alimento que está assando e de um ferro de passar roupa em funcionamento até quem o está utilizando.

ATIVIDADE
Para discussão em grupo
O dispositivo conhecido como “termômetro digital sem contato” determina a temperatura corporal quando posicionado a poucos centímetros da pele. O aparelho tem um receptor que, apontado para a testa, capta a radiação infravermelha emitida pelo organismo e, a partir dela, afere a temperatura.
Com base nestas informações, que contra-argumento pode ser apresentado para refutar a fake news: “Os termômetros digitais são perigosos! Quando direcionados à testa, emitem raios que atingem a glândula pineal e causam danos a ela”.
Ultravioleta
Ultravioleta quer dizer “acima do violeta”. Tal nome indica que a frequência dessas ondas eletromagnéticas, que também não são percebidas pelo olho humano, é superior à frequência da luz violeta.
O Sol envia para a Terra, juntamente com a luz visível, ondas eletromagnéticas de outras frequências, como o infravermelho e o ultravioleta. Mais da metade das ondas ultravioleta provenientes do Sol que chegam à Terra é absorvida pelo gás ozônio presente numa camada da atmosfera situada a cêrca de 20 quilômetros a 30 quilômetros de altitude, conhecida como camada de ozônio.
Essa absorção é fundamental, pois o ultravioleta oferece consideráveis riscos a muitos organismos. No ser humano, por exemplo, a exposição prolongada ao ultravioleta pode provocar, entre outros problemas, o câncer de pele e a catarata, distúrbio que deixa a lente do ôlho (anteriormente denominada cristalino) esbranquiçada.

Respostas e comentários
Visão crítica SOBRE fake news
O boxe Para discussão em grupo apresenta uma proposta para estimular os estudantes a desenvolver a capacidade de compreender uma situação e, com base no que estudaram, produzir análises críticas, criativas e propositivas.
Nesse caso, ao avaliar as informações dadas, eles devem compreender que, conforme informado, o “aparelho tem um receptor que, apontado para a testa, capta a radiação infravermelha emitida pelo organismo e, a partir dela, afere a temperatura”. Consequentemente, espera-se que o contra-argumento usado na refutação seja que o aparelho capta ondas eletromagnéticas emitidas pelo organismo, mas não as emite. Assim, não oferece o risco mencionado.
A situação proposta também permite ressaltar a importância de conferir a procedência e a veracidade de informações recebidas e/ou acessadas antes de repassá-las.
De ôlho na Bê êne cê cê!
O Para discussão em grupo propõe uma atividade que convida a construir argumentos com base em dados, evidências e informações confiáveis e negociar e defender ideias e pontos de vista que promovam o respeito a si próprio e ao outro (competência específica 5).
No item 3, o subitem Ultravioleta favorece o desenvolvimento da competência específica 7, no que se refere a conhecer, apreciar e cuidar de si, do seu corpo e bem-estar, recorrendo aos conhecimentos das Ciências da Natureza e às suas tecnologias.
Raios X
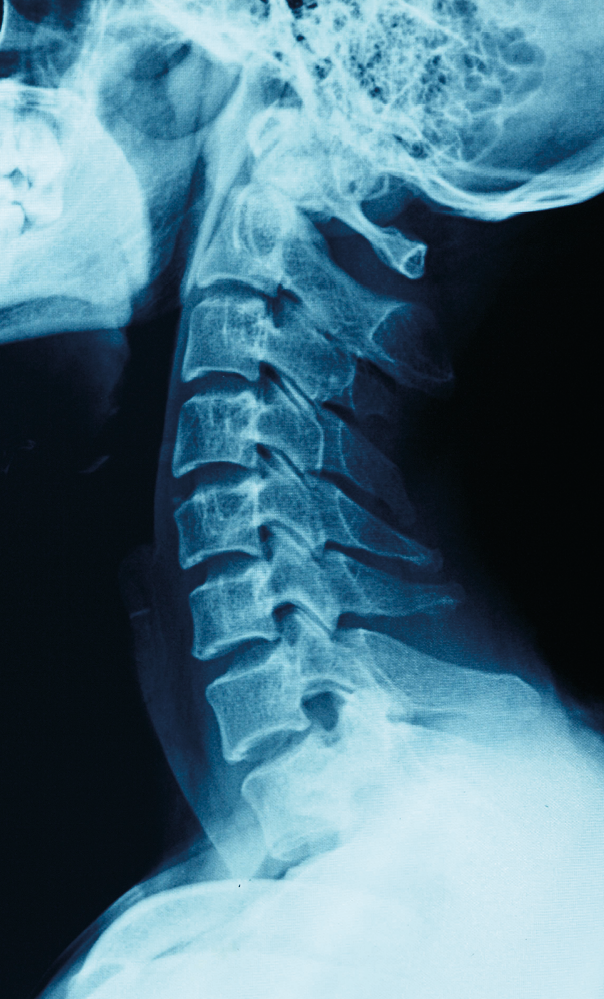
Os raios X foram descobertos em 1895 pelo físico alemão (1845-1923) ao trabalhar com um aparelho que produzia descargas elétricas em gases a baixa pressão.
O próprio descobridor verificou que os diferentes tecidos do corpo humano são atravessados de modo desigual pelos raios X. Isso conduziu a uma aplicação prática em Medicina: as radiografias.
Radiografia é uma imagem produzida em um filme fotográfico por raios X que atravessaram o corpo humano. Os ossos absorvem os raios X muito melhor que outros órgãos, o que faz com que apareçam como regiões claras no filme após este ser revelado. Os músculos, ao contrário, permitem boa passagem dos raios X, e estes, chegando ao filme, produzem as regiões mais escuras vistas após a revelação.
A radiografia é importante para determinados diagnósticos médicos. Contudo, a exposição repetida aos raios X oferece riscos à saúde, como o aumento da probabilidade de câncer. Por isso, os técnicos de radiografia usam aventais de chumbo e protegem-se atrás de uma parede dêsse metal, que bloqueia a passagem de raios X.
Clique no play e acompanhe a reprodução do Áudio.
Transcrição do áudio
[LOCUTOR] O acidente radiológico em Goiânia
[Locutor] Em setembro de 1987, Goiânia foi palco de um acidente com material radioativo que provocou a contaminação de mais de mil pessoas e gerou sérias consequências econômicas, sociais e ambientais, tornando-se um dos maiores desastres desse tipo do mundo. [Locutor] A tragédia começou em 1985, quando o Instituto Goiano de Radioterapia foi desativado e abandonado. Um aparelho usado para o tratamento de câncer que empregava o césio-137 como fonte de radiação foi deixado no local onde funcionava o Instituto. [Locutor] Em 13 de setembro de 1987, dois coletores de material reciclável encontraram o aparelho e o levaram para casa, antes de vender suas peças ao ferro-velho. Ao desmontarem o equipamento, a cápsula de chumbo que continha o material radioativo foi rompida, liberando cloreto de césio-137, um pó branco com brilho azulado. O componente brilhante despertou a curiosidade de vizinhos, amigos e parentes e se espalhou por vários locais, propagando a contaminação pela população da região. [Locutor] Nenhuma das pessoas expostas ao material radioativo conhecia os riscos que ele oferecia. Entre outros efeitos biológicos, a radiação é capaz de causar a quebra de ligações químicas em moléculas biológicas, como a do DNA, podendo assim provocar mutações no material genético e a morte celular. [Locutor] Os efeitos podem ser imediatos ou tardios e dependem da dose de radiação absorvida pelo organismo, do tempo de exposição ao material, do tipo de célula ou tecido exposto e da reação de cada organismo. Doses baixas de radiação apresentam possibilidades de efeitos tardios, como o desenvolvimento de algum tipo de câncer. [Locutor] Aqui cabe um parêntese: como a radiação, que pode ter efeitos tão nocivos ao organismo, é empregada no tratamento de câncer? A radioterapia baseia-se no fato de que algumas células tumorais apresentam maior sensibilidade à radiação do que as células saudáveis. Assim, com a incidência de níveis controlados de radiação sobre o tumor, o tratamento radioterápico busca a morte das células tumorais e a preservação das células saudáveis. [Locutor] Entre 30 de setembro e 20 de outubro de 1987, a Comissão Nacional de Energia Nuclear constatou que cerca de 250 pessoas estavam contaminadas pela irradiação do césio-137. Nesse grupo, 129 tinham rastros da substância dentro e fora do organismo. Foram hospitalizadas, naquela ocasião, 49 pessoas, das quais 20 necessitaram de cuidados médicos intensivos. Quatro vítimas morreram no período de quatro semanas. [Locutor] Além das pessoas que tiveram contato direto com a substância, foram expostos à radiação os profissionais da saúde que trataram das vítimas, bombeiros, policiais militares e outros profissionais que trabalharam na segurança, na descontaminação e na remoção dos resíduos contaminados. [Locutor] O material contaminado, que incluía roupas, objetos e até mesmo pedaços de construções e o solo, foi selado em tambores e caixas que foram então lacrados em contêineres. Esses contêineres foram levados para um depósito de lixo radioativo provisório e, por fim, para um depósito definitivo, construído dentro de um parque na cidade de Abadia de Goiás, a 20 quilômetros de distância de Goiânia. O depósito continua sendo monitorado, porque o material ainda emite radiação, e, segundo estudos científicos, essa emissão cessará apenas em meados do ano de 2187. [Locutor] A importância da segurança no uso, manuseio, manutenção e descarte de materiais radioativos, para a segurança e preservação de seres vivos e do meio ambiente, foi sem dúvida um dos grandes aprendizados após o acidente.
Raios gama
Os raios gama possuem frequência superior aos raios X e são ainda mais penetrantes e perigosos. Eles são produzidos por alguns materiais radioativos.
Nas explosões nucleares são emitidas enormes doses de raios gama. Nas usinas nucleares, processos envolvendo o núcleo dos átomos também produzem esses raios. Nesse caso, a radiação é retida por blindagens especialmente construídas para isso.
Os raios gama são usados, de modo controlado, sob indicação e supervisão médica, em uma técnica chamada radioterapia. Ela permite tratar pacientes com câncer em determinados estágios da doença. Nessa técnica, os raios gama são dirigidos para o local do tumor e matam células cancerosas.




ATIVIDADE
Tema para pesquisa
Você conhece a área do conhecimento chamada Física Médica? Pesquise a atuação dos profissionais dessa área, bem como quais universidades brasileiras oferecem esse curso.
Respostas e comentários
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero seis
“Classificar as radiações eletromagnéticas por suas frequências, fontes e aplicações, discutindo e avaliando as implicações de seu uso em contrôle remoto, telefone celular, raio X, forno de micro-ondas, fotocélulas etcétera”
Neste capítulo, os estudantes conheceram os tipos de radiações (ondas) eletromagnéticas, suas principais aplicações e alguns de seus riscos.
Também tornaram-se aptos a interpretar um esquema como o do item 2 (em que as faixas de frequência dos diferentes tipos dessas ondas são apresentadas), sabendo que a frequência é uma característica distintiva dos diferentes tipos de radiações eletromagnéticas.
Na atividade de encerramento da unidade B, o desenvolvimento dessa habilidade se completará, com os estudantes participando ativamente na obtenção de informações sôbre outros riscos das ondas eletromagnéticas, na análise dessas informações e no compartilhamento delas por meio do blog de Ciências de cada equipe.
• ê éfe zero nove cê ih zero sete
“Discutir o papel do avanço tecnológico na aplicação das radiações na medicina diagnóstica (raio X, ultrassom, ressonância nuclear magnética) e no tratamento de doenças (radioterapia, cirurgia ótica a laser, infravermelho, ultravioleta etcétera).”
A esta altura, os estudantes já adquiriram os pré-requisitos conceituais referentes a ondas eletromagnéticas para que possam prosseguir com o desenvolvimento dessa habilidade na atividade de encerramento da unidade B.
Falta aprenderem o que é ultrassom (uma onda mecânica de frequência superior à do som), conceito que será apresentado no capítulo 5, antes, portanto, de chegar à atividade mencionada.
Atividades
Ao final do item 3, proponha aos estudantes os exercícios 1 a 6 da seção Use o que aprendeu.
tê cê tê Economia
Pertencente à macroárea Economia, o tê cê tê Trabalho alinha-se à proposta do boxe Tema para pesquisa, visto que os estudantes têm oportunidade de tomar contato com uma área de atuação profissional intimamente relacionada aos conteúdos abordados neste capítulo.
De ôlho na Bê êne cê cê!
O desenvolvimento da competência geral 6 é favorecido pelo boxe Tema para pesquisa, pois sua proposta abarca valorizar a diversidade de saberes e vivências culturais e apropriar-se de conhecimentos e experiências que possibilitem ao estudante entender as relações próprias do mundo do trabalho e fazer escolhas alinhadas ao seu projeto de vida, com liberdade, autonomia, consciência crítica e responsabilidade.
4. Modelo atômico de Bór
Espectros atômicos
Se a luz solar ou a de uma lâmpada de filamento incandescente (aquelas que, no passado, foram largamente empregadas em residências) atravessar um prisma, ela será decomposta em várias cores, que são popularmente conhecidas como arco-íris. Cientificamente, o que se obtém é chamado de espectro da luz visível.
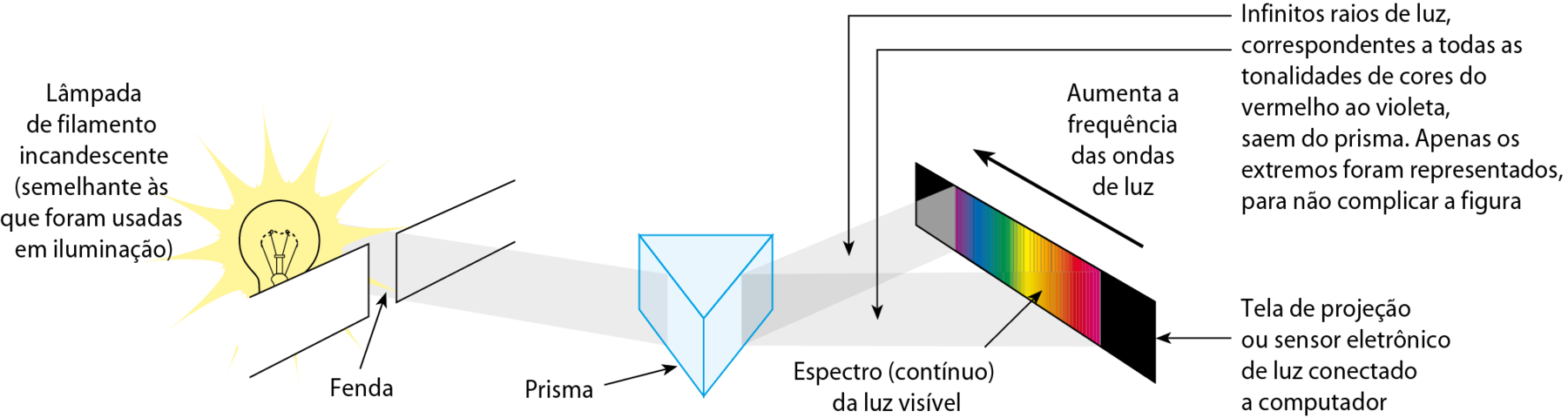
Fonte: iãng, H. D.; FREEDMAN, R. A. University Physics. décima quinta edição Harlow: Pearson, 2020. página .1116.
Se esse experimento for repetido utilizando a luz proveniente de uma lâmpada de gás (similar às lâmpadas fluorescentes, mas sem a pintura branca no vidro que a envolve), não obteremos o espectro completo. Apenas algumas linhas estarão presentes, correspondendo somente a algumas frequências das ondas de luz visível. Essas linhas formam o espectro de linhas ou espectro atômico.
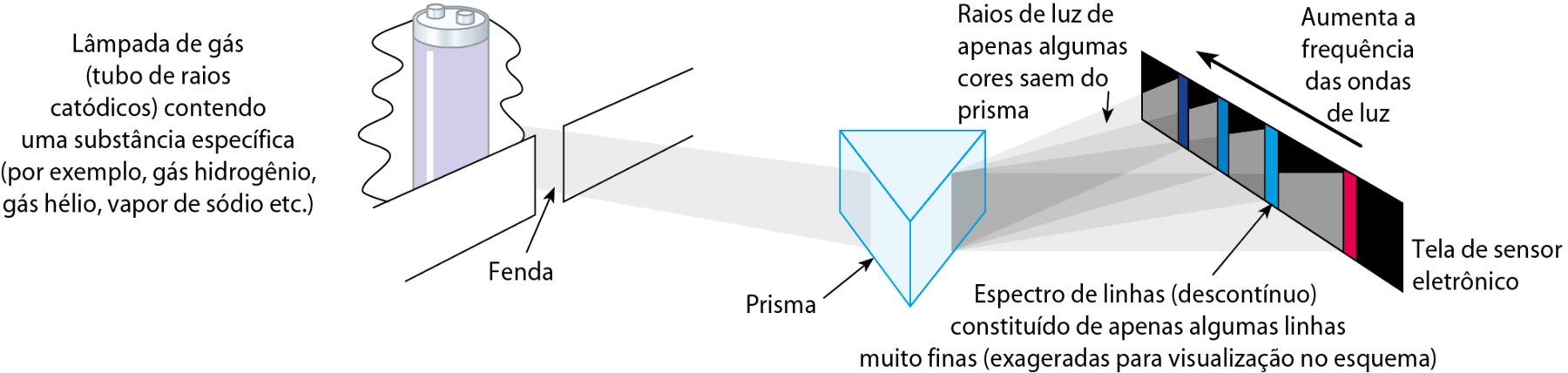
Fonte: róbinsson, J. K.; , J. E.; , R. C. Chemistry. oitava edição Hoboken: Pearson, 2020. página 170.
Alguns exemplos de espectros atômicos são representados na figura a seguir.
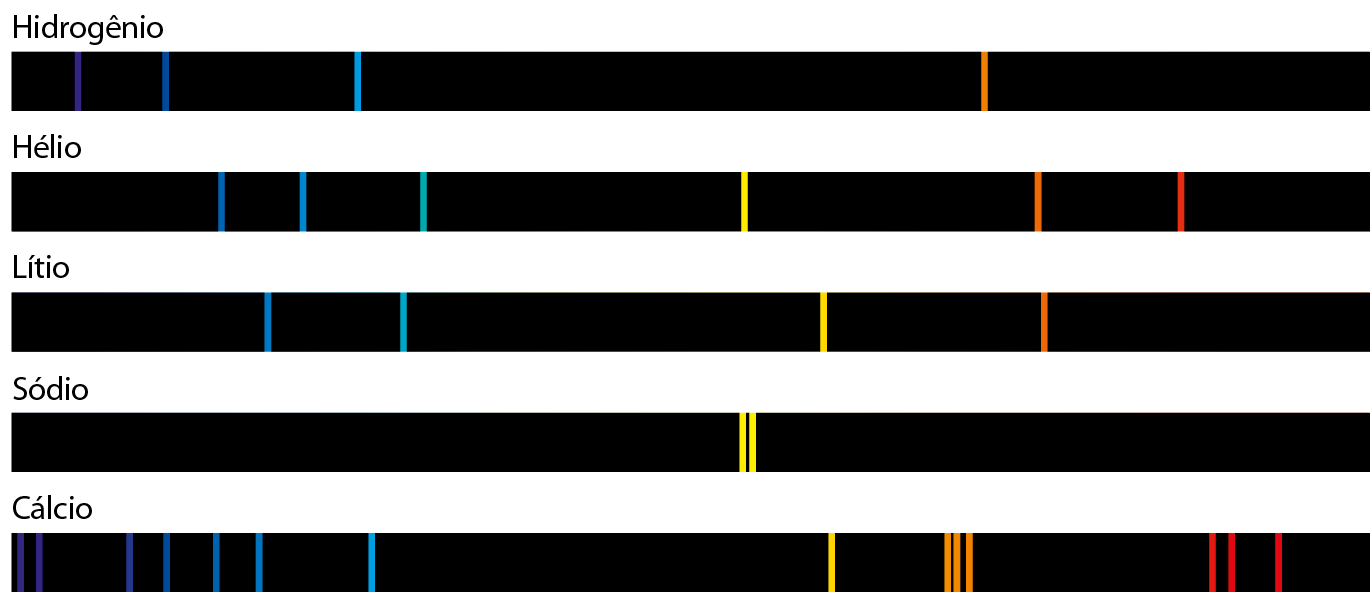
Fonte: , J. Chemistry. quinta edição Nova iórqueMcGraw-Hill, 2020. página 243.
Respostas e comentários
Itens 4 e 5
O modelo de Bór representa uma tentativa de incluir a interação da matéria com as ondas eletromagnéticas.
Ele possibilitou explicar qualitativamente fatos como os espectros atômicos, a cor dos letreiros luminosos de neônio (ou de outros gases), a coloração típica dos elementos no teste da chama, a cor dos fogos de artifício e a luminosidade emitida por interruptores fosforescentes (e até por vaga‑lumes e outras fórmas de bio e quimioluminescência).
Ao docente, cabe ressaltar que o modelo de Bór permitiu realizar previsões quantitativas das frequências das linhas espectrais de átomos e íons hidrogenoides (aqueles átomos ou íons com um só elétron, como , agá ê+, éle i2+, bê ê3+ etcétera). Embora a literatura universitária introdutória de Química Geral empregue qualitativamente o modelo para explicar diversos fenômenos envolvendo átomos multieletrônicos (aqueles com dois ou mais elétrons), as previsões quantitativas do modelo, nesses casos, não concordam com os valores experimentais. Explicações abrangentes dos espectros atômicos só se tornaram possíveis com o modelo atômico propiciado pela Mecânica Quântica.
De ôlho na Bê êne cê cê!
O item 4 e os subitens O teste da chama e Explicação da luz emitida no teste da chama, do item 5, retomam a oportunidade para o desenvolvimento da competência geral 2 e da competência específica 2 neste capítulo.
O estudo de modelos atômicos possibilita aos estudantes a percepção das Ciências da Natureza como empreendimento humano, e o conhecimento científico como provisório, cultural e histórico, o que se alinha com o desenvolvimento da competência específica 1.
Postulados do modelo atômico de Bór
O modelo atômico de Bór, uma proposta para explicar o espectro de linhas de elementos químicos, foi desenvolvido pelo dinamarquês Bór (1885-1962), em 1913. Para elaboração de seu modelo atômico, o cientista propôs alguns postulados (afirmações consideradas verdadeiras sem demonstração, pontos de partida para um raciocínio). Entre esses postulados estão os seguintes:
- Os elétrons nos átomos movimentam-se ao redor do núcleo em trajetórias circulares (chamadas de camadas, ou níveis, e designadas por K, L, M, N etcétera; a camada mais próxima do núcleo é designada pela letra K, e assim sucessivamente).
- Cada um dêsses níveis tem um valor determinado de energia. (Por isso, são também denominados níveis de energia.)
- Não é permitido a um elétron permanecer entre dois níveis.
- Um elétron pode passar de um nível para outro de maior energia, desde que absorva energia externa (ultravioleta, luz visível, infravermelho etcétera). Quando isso acontece, dizemos que o elétron foi excitado ou que ocorreu uma transição eletrônica para um nível de maior energia (veja o esquema A).
- Um elétron excitado pode sofrer transição eletrônica de retôrno ao nível inicial. Nesse caso, há liberação de energia, por exemplo, como luz visível ou ultravioleta (esquema B).
Uma novidade dêsse modelo é que a energia dos elétrons é quantizada, ou seja, apresenta apenas determinados valores.
Utilizando o modelo de Bór, podem-se explicar os espectros atômicos (esquema C). Os elétrons são excitados pela energia elétrica, na lâmpada de gás. Em seguida, ao retornarem aos níveis de menor energia, liberam energia na fórma de luz. Como a cor da luz emitida depende da diferença de energia entre os níveis envolvidos na transição e como essa diferença varia de elemento para elemento, a luz apresentará cor característica para cada elemento.

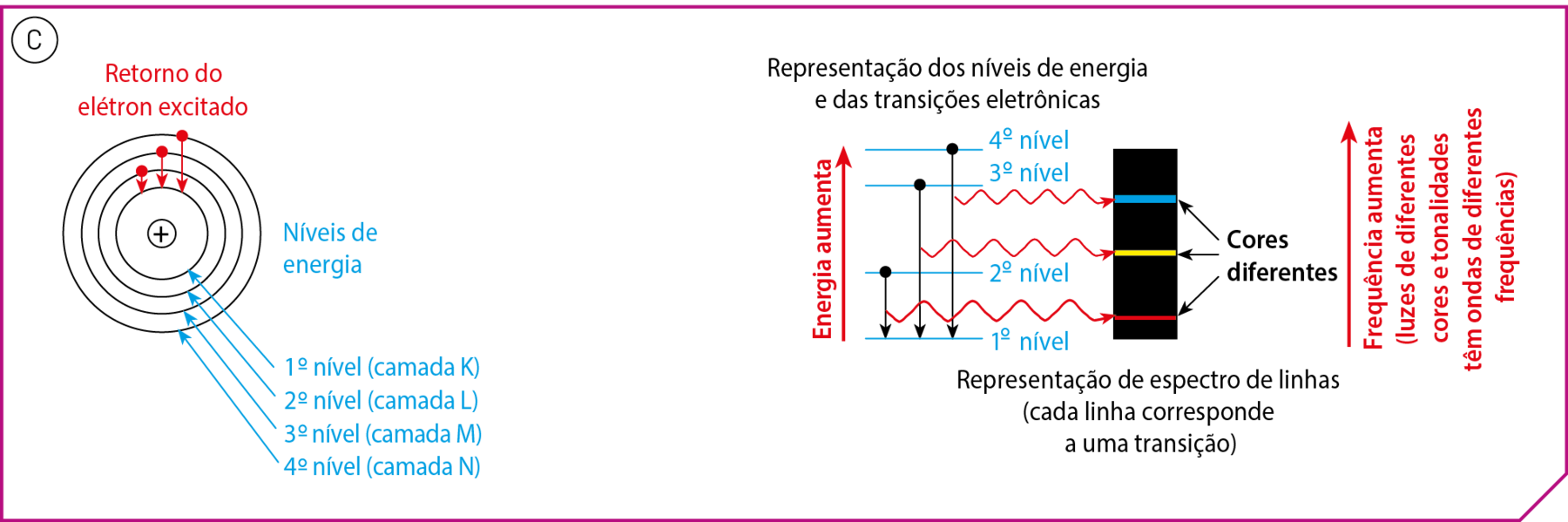
Fontes: Esquemas A, B e C elaborados a partir de uólquer, J. Halliday & Resnick Fundamentals of Physics. décima edição reeditada e estendida. Hoboken: John Wiley, 2018. página .1207; Silberberg; M. S.; AMATEIS; P. G. Chemistry: the molecular nature of matter and change. oitava edição Nova iórqueMcGraw-Hill. 2018. página 305.
Respostas e comentários
De ôlho na Bê êne cê cê!
No item 5, os subitens Fogos de artifício, Luminosos e lâmpadas de gás e Teclas e ponteiros fosforescentes oferecem a oportunidade de trabalhar a competência específica 3, posto que tratam de temas que possibilitam compreender e explicar características, fenômenos e processos relativos ao mundo natural e tecnológico com base nos conhecimentos das Ciências da Natureza.
• ê éfe zero nove cê ih zero três
“Identificar modelos que descrevem a estrutura da matéria (constituição do átomo e composição de moléculas simples) e reconhecer sua evolução histórica.”
O desenvolvimento dessa habilidade se iniciou no capítulo 1, prosseguiu no capítulo 2 e continua neste, com os estudantes conhecendo o modelo de Bór.
O modelo, como já mencionado, possibilita explicar fatos como os espectros atômicos, a cor dos luminosos de neônio, a coloração emitida no teste da chama, a cor dos fogos de artifício e a luminosidade emitida por interruptores fosforescentes.
Assim, o caráter preditivo das teorias científicas novamente se faz presente, possibilitando aos estudantes “associar explicações e/ou modelos à evolução histórica dos conhecimentos científicos envolvidos” e “aprimorar seus saberes e incorporar, gradualmente, e de modo significativo, o conhecimento científico” (Bê êne cê cê, 2018, página 323).
Sugestão de atividade
A esta altura do capítulo, recomendamos os dois experimentos discutidos a seguir.
O teste da chama
O teste da chama é feito com um filamento de níquel-cromo seguro por uma pinça de madeira. A ponta dêsse filamento deve ser mergulhada em éle () concentrado e depois impregnada com sal de lítio, cálcio, cobre, bário, sódio etcétera
Quando essa extremidade é levada à chama clara de um bico de Bansen, ocorre a volatilização do cloreto do metal, que, por causa da excitação dos elétrons pela energia proveniente da chama, produz uma chama luminosa de coloração característica, que depende do metal presente.
Por questões de SEGURANÇA (a prática envolve ácido concentrado e chama), recomendamos que seja uma demonstração realizada pelo professor. O resultado do experimento permite estabelecer relação com a cor dos fogos de artifício, dos letreiros luminosos, das lâmpadas de vapor de sódio etcétera
O artigo de , e SANTIN FILHO, relacionado em Sugestão de leitura complementar para professores, na parte inicial dêste Manual do professor, propõe uma interessante variante do teste da chama. No caso de optar por ela, é necessário que você a realize de modo demonstrativo e esteja muito atento às recomendações de segurança propostas no artigo.
5. Algumas aplicações do modelo de Bór
O teste da chama
O procedimento que comentaremos a seguir é conhecido como teste da chama. Ele teve importância histórica como um dos métodos empregados na detecção de certos elementos metálicos em amostras de minerais. Devido aos riscos potenciais envolvidos, NÃO deve ser realizado pelos estudantes!
Na ponta (curvada em fórma de pequeno círculo) de um fio feito de níquel e crômio (metais que não interferem no resultado do experimento), coloca-se uma pequena amostra de cloreto de sódio (êne áCl) e leva-se à chama de um bico de Bansen, segurando-o com um pregador de madeira ou fixado a um bastão de vidro para não queimar os dedos. Isso está mostrado na foto A.
A observação que se faz é que a chama, inicialmente azul bem clara, quase transparente, adquire uma intensa coloração amarela. Repetindo-se esse procedimento, porém utilizando brometo de sódio (êne áBr) ou iodeto de sódio (êne áI), também se observa que a chama adquire coloração amarela.
Como esse fio, levado à chama sem a presença do composto, não produz coloração na chama, isso parece indicar que o sódio deve ser o responsável pela coloração.
De fato, ao repetir esse procedimento com compostos de alguns outros elementos metálicos, percebe-se que cada um deles produz uma cor característica ao ser submetido à chama. Algumas dessas cores estão relacionadas na tabela que traz as cores emitidas pelos átomos de alguns elementos no teste da chama.
A cor no teste da chama é uma característica do elemento metálico presente no composto analisado.

|
Elemento |
Cor |
|---|---|
|
Sódio |
Amarelo |
|
Potássio |
Violeta |
|
Cálcio |
Vermelho-tijolo |
|
Estrôncio |
Vermelho-carmim |
|
Bário |
Verde-amarelado |
|
Cobre |
Verde-azulado |
Fontes: , D. D.; , S. D. General Chemistry. décima primeira edição Boston: Cengage, 2017. página 216; , N. J. Principles of Chemistry: a molecular approach. quarta edição Harlow: Pearson, 2021. página 367.
Explicação da luz emitida no teste da chama
Quando os átomos de um elemento são colocados na chama, o calor excita alguns elétrons, isto é, faz com que passem para níveis de maior energia. Ao voltarem aos níveis iniciais, liberam energia na fórma de luz de várias cores, que são características dos átomos de cada elemento; são as cores que aparecem no espectro atômico do elemento. A mistura dessas cores, emitidas simultaneamente por diversos átomos, resulta na cor vista no teste da chama.

Respostas e comentários
Fluorescência com materiais simples
No artigo de e , indicado em Sugestão de leitura complementar para professores, as autoras descrevem um procedimento com materiais relativamente simples (água tônica, espinafre, casca de ovo marrom e luz negra), que permite observar a fluorescência.
Uma outra opção é mostrar uma reação química que produz fluorescência em um corante especial, o que ocorre nos bastões luminosos usados em algumas festas. Esses bastões são relativamente fáceis de encontrar em lojas de artigos para festa e podem ser levados à sala de aula para uma demonstração. São tubinhos plásticos que, quando dobrados, passam a emitir brilho colorido, que persiste por vários minutos e pode ser observado em ambientes não muito iluminados. Nesses bastões, uma vez ativados, ocorre um exemplo de quimioluminescência, emissão de luz decorrente de uma reação química.
Para conhecimento do docente, vamos comentar como funcionam esses bastões.
Uma formulação comum nesses produtos é a seguinte: o tubinho plástico contém uma mistura líquida de um éster difenílico cloro-substituído derivado do ácido oxálico (—) – éster conhecido pela sigla TCpê ó, do inglês bis(2,4,6-trichlorophenyl) oxalate – e um corante fluorescente apropriado, genericamente denominado fluoróforo (isto é, que produz fluorescência sob condições apropriadas).
Dentro do tubinho plástico também existe uma ampola fechada de vidro bem fino, contendo solução de peróxido de hidrogênio.
Quando o tubinho plástico é dobrado, a ampola de vidro se quebra, os reagentes entram em contato e, por conseguinte, a reação se inicia.
O éster reage com o peróxido de hidrogênio, produzindo duas substâncias, uma das quais reage imediatamente com o fluoróforo, transferindo energia para ele, o que causa a excitação de alguns de seus elétrons.
O retôrno dos elétrons excitados ao estado fundamental emite luz, cuja cor depende do fluoróforo que foi utilizado na fabricação.
Embora bonitos e interessantes, o uso dêsses bastões em larga escala constitui uma diversão bastante questionável do ponto de vista ambiental, pois se trata de uma utilização efêmera e pouco relevante dos plásticos.
Também é importante ressaltar a toxicidade do líquido, pois o peróxido de hidrogênio é oxidante e uma das substâncias produzidas (um fenol) é irritante da pele e um possível agente cancerígeno.
Não é recomendável, em hipótese alguma, abrir esses bastões nem ter contato direto com o líquido que está dentro deles.

Fogos de artifício
Quando os fabricantes desejam produzir fogos de artifício coloridos, eles misturam à pólvora compostos de certos elementos químicos apropriados.
Para obter a cor amarela, por exemplo, adicionam sódio. Para conseguir o vermelho-carmim, colocam estrôncio. Quando querem o verde-azulado, usam cobre. Desejando o verde, empregam bário.
A cor que um elemento dá aos fogos de artifício é a mesma que ele tem no teste da chama. No momento em que a pólvora explode, a energia liberada na explosão excita os elétrons dêsses átomos. Quando retornam aos níveis de menor energia, liberam luz colorida: exatamente a cor que seria vista no teste da chama.
ATENÇÃO!
NUNCA caia na tentação de manipular fogos de artifício. Acidentes sérios, com queimaduras e até morte, atestam o risco que é manuseá-los.


Luminosos e lâmpadas de gás
Os luminosos de neônio e as lâmpadas de vapor de sódio ou mercúrio são dispositivos de funcionamento similar. Neles, há uma substância em fase gasosa (gás neônio, vapor de sódio e vapor de mercúrio, respectivamente), cujos elétrons são excitados pela energia elétrica. Quando esses elétrons retornam a níveis de menor energia, há a emissão de luz.
Nos luminosos de gás neônio, a luz emitida é vermelha, e, nas lâmpadas de vapor de sódio, é amarela.
Nas lâmpadas de vapor de mercúrio, também conhecidas como lâmpadas fluorescentes, há liberação de quantidade apreciável de ultravioleta, que não é visível. A pintura que reveste tais lâmpadas contém uma substância especial (denominada fluorescente), que absorve o ultravioleta e reemite luz branca, visível.




Teclas e ponteiros fosforescentes
Alguns materiais, quando absorvem ultravioleta ou outras variedades de ondas eletromagnéticas, emitem luz visível. Esse fenômeno é chamado genericamente de luminescência.
Quando a emissão ocorre imediatamente após a absorção, o fenômeno é chamado de fluorescência. Se, por outro lado, a emissão demorar alguns segundos ou até mesmo algumas horas, é denominado fosforescência. As teclas de interruptores e os ponteiros de relógio que brilham no escuro são feitos de materiais fosforescentes. Alguns elétrons são excitados quando esses materiais estão iluminados e, gradualmente, retornam à situação inicial, emitindo luminosidade. Por isso, quando apagamos as luzes, permanecem visíveis durante algum tempo.

Respostas e comentários
Mecânica Quântica
O modelo atômico de Bór (1913) foi elaborado antes da Mecânica Quântica, sendo uma das inúmeras contribuições científicas que conduziram ao início dêsse ramo da Física. A título de informação ao docente, vamos comentar sucintamente algo a respeito dessa área.
Nas três primeiras décadas do século vinte, a Física passou por uma revolução na maneira de encarar fenômenos do mundo atômico‑molecular. Muitos novos conceitos foram propostos, diversos experimentos e considerações teóricas foram desenvolvidos e um dos frutos dessa nova maneira de entender a Física foi o surgimento da Mecânica Quântica.
Grande número de cientistas contribuiu para esse esfôrço, entre eles o físico francês luí de (1892‑1987), os físicos alemães vérner (1901‑1976) e mács bórni (1882‑1970), os físicos austríacos (1887‑1961) e vôlfigan (1900‑1958) e o físico britânico Pôl (1902‑1984).
Na época, havia evidências de que a luz, antes considerada apenas onda, podia exibir comportamento corpuscular (comportamento “de matéria”) em certos experimentos. Desenvolveu‑se, então, outra hipótese: a de que a matéria poderia apresentar comportamento de onda, o que se confirmou quando foi observado que um feixe de elétrons podia exibir o fenômeno chamado difração, considerado anteriormente como exclusivo das ondas.
Outra modificação radical ocorreu com o conceito de incerteza. Até então, a ideia de incerteza, na ciência, estava relacionada à precisão de instrumentos de medida. Por exemplo, se você está medindo o comprimento de um parafuso, uma fita métrica fornece baixa precisão, uma régua escolar fornece maior precisão e um paquímetro propicia precisão ainda maior.
Na escala dos átomos, porém, a incerteza é inerente aos fenômenos quânticos.
Ao tentar medir a posição de um elétron, por exemplo, o próprio ato de medir interfere no resultado. Para localizar o elétron, seria preciso interagir com ele; contudo, essa interação altera sua energia e sua velocidade.
Essa característica é expressa pelo chamado princípio da incerteza: não podemos ter certeza absoluta, simultaneamente, da posição e da velocidade de uma partícula.
Novos modelos atômicos foram desenvolvidos reunindo a quantização, o comportamento ondulatório da matéria e a incerteza. Em geral, são modelos matemáticos complexos, cuja apresentação está além do escopo dêste Manual do professor. Um exemplo dêsses modelos é a descrição do comportamento dos elétrons no átomo e de outras entidades em nível submicroscópico, por meio de expressões matemáticas denominadas equações de onda.
No modelo atômico mecânico‑quântico, o comportamento de cada elétron é descrito por uma fórmula matemática, a função de onda (associada à equação de onda), a partir da qual podem ser calculadas propriedades como sua energia (que tem valores quantizados) e a probabilidade de encontrá‑lo em certa região.
Não é possível falar em órbitas dos elétrons em tôrno do núcleo, com posições ou trajetórias definidas. Devido à incerteza e ao comportamento ondulatório do elétron, o modelo mecânico‑quântico descreve orbitais, funções matemáticas que descrevem a probabilidade de encontrar um elétron com determinada energia a certa distância do núcleo.
Hoje, programas de computador fornecem ilustrações da região de alta probabilidade de encontrar determinado elétron ou conjunto de elétrons e também representações de como essa probabilidade varia no espaço, geralmente usando diferentes cores e tonalidades nessa indicação.
Fonte: róbinsson, J. K.; , J. E.; , R. C. Chemistry. oitava edição Hoboken: Pearson, 2020. página 49.
6. Distribuição eletrônica nas camadas
Distribuição eletrônica do hidrogênio ao argônio
Cada uma das camadas eletrônicas pode comportar um diferente número máximo de elétrons. Por exemplo, a primeira das camadas comporta no máximo 2 elétrons, a segunda, no máximo 8, e a terceira, no máximo 18.
Existe uma tendência de os elétrons ocuparem camadas de energia mais baixa. Quando os elétrons estão na situação de menor energia possível, dizemos que o átomo está em seu estado fundamental.
Usando técnicas experimentais adequadas, os cientistas determinaram a distribuição eletrônica em camadas para os átomos dos elementos químicos, ou seja, quantos elétrons há em cada um dos níveis da eletrosfera dos átomos (eletricamente neutros e no estado fundamental). A seguir, veja a distribuição eletrônica dos átomos de hidrogênio (Z = 1) até argônio (Z = 18).
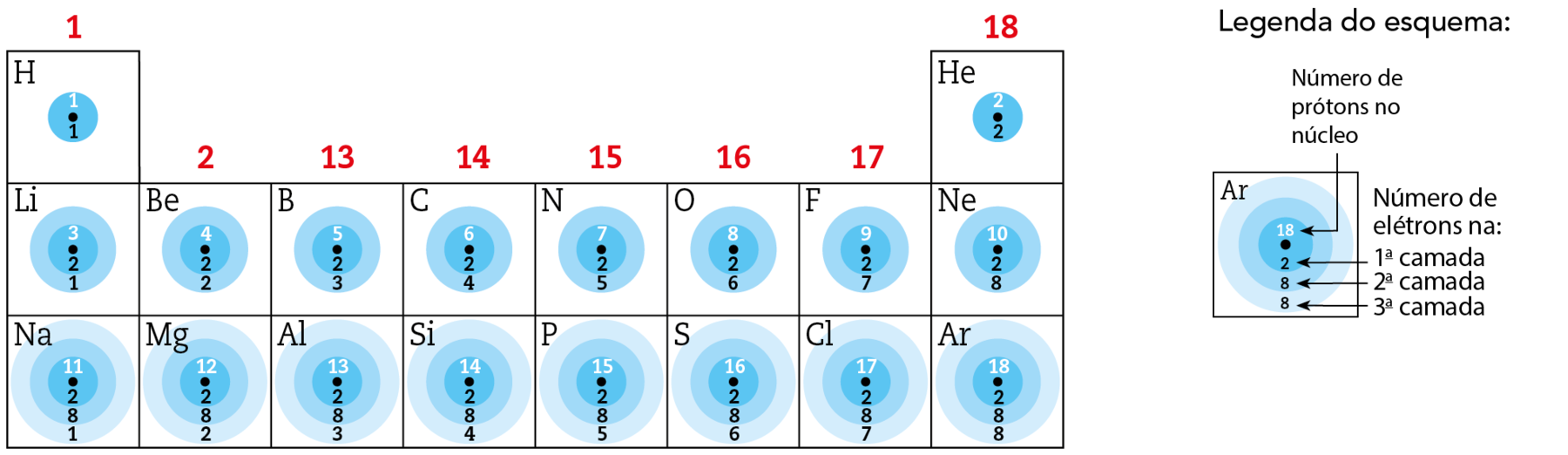
Fonte: bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova iórquePearson, 2022. página 313.
O átomo de hidrogênio (Z = 1) apresenta 1 próton e 1 elétron. Esse elétron situa-se na primeira camada. No caso do hélio (Z = 2), há dois prótons no núcleo e 2 elétrons na primeira camada. (Os nêutrons presentes situam-se sempre no núcleo, junto com os prótons.)
O átomo de lítio (Z = 3) tem 3 prótons no núcleo e 3 elétrons na eletrosfera, dos quais dois ocupam a primeira camada, preenchendo-a, e o terceiro ocupa a segunda camada. À medida que percorremos a tabela periódica, a cada aumento de uma unidade no número atômico, tem-se aumento de 1 próton no núcleo e de 1 elétron na eletrosfera. Esse elétron adicional tende a ocupar a camada de menor energia que ainda tenha capacidade para comportá-lo. Quando uma camada está preenchida, o elétron adicional ocupa uma nova camada.
Esse raciocínio se aplica bem aos primeiros elementos, até o argônio. A partir daí, observa-se que alguns elétrons ocupam uma camada mais externa, mesmo que a anterior não esteja totalmente preenchida. Isso é explicado por um modelo mais avançado, o modelo de subníveis, que pode ser estudado no Ensino Médio e na Universidade.
Distribuições eletrônicas:
: K–1
₂agá ê: K–2
₃éle i: K–2 L–1
₄bê ê: K–2 L–2
bit: K–2 L–3
centésimo: K–2 L–4
: K–2 L–5
: K–2 L–6
éfe: K–2 L–7
₁₀êne ê: K–2 L–8
₁₁êne á: K–2 L–8 M–1
: K–2 L–8 M–2
etcétera
Respostas e comentários
Pseudociência
Recentemente, o vocabulário da Mecânica Quântica passou a ser usado por pessoas que nada sabem sôbre o tema e, sem formação alguma em Medicina ou Psicologia, dão conselhos que pretensamente melhoram a vida das pessoas. Expressões como “cura pela quântica”, “programação quântica” e “coach quântico” são usadas para iludir pessoas e obter lucro, em uma atividade que se constitui em pseudociência. Os discursos às vezes são convincentes e sedutores para quem não tem conhecimento científico.
Essas práticas podem colocar em risco a saúde física e mental dos “clientes”, além de eventualmente se configurarem como exercício ilegal da Medicina ou da Psicologia.
Se questionado pelos estudantes sôbre essas práticas “quânticas”, esteja atento ao fato de que não se trata de proibir ou cercear o direito à liberdade de expressão, um dos princípios estruturantes do conceito de democracia, garantido no país pela Constituição Federal, em seu Artigo 5º, incisos quatro e nove. Trata-se da necessidade de desenvolver educação midiática na população, visando à percepção de ofertas flagrantemente enganosas, que usam ideias científicas fóra de seu contexto de validade. Todo cidadão deve desenvolver discernimento acerca de ofertas dêsse tipo, a fim de não ser lesado.
Distribuição eletrônica dos elementos representativos
O esquema a seguir apresenta a distribuição eletrônica de diversos elementos representativos (grupos 1, 2 e de 13 a 18).
Analise o esquema com atenção. As informações nele contidas serão bastante úteis para evidenciar que existe uma relação entre a distribuição eletrônica de um elemento e sua posição na tabela periódica, ou seja, seu período (linha, horizontal) e seu grupo (coluna, vertical).


Fonte: bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova iórquePearson, 2022. página 313.
7. Distribuição eletrônica e tabela periódica
Número de camadas eletrônicas e período do elemento
Analisando os dados do esquema anterior, é possível perceber que os elementos do primeiro período (agá e agá ê) apresentam átomos com uma camada eletrônica, elementos do segundo período (éle i, bêê, bê, cê, êne, óh, éfe e êne ê) apresentam átomos com duas camadas e assim sucessivamente até os elementos do sétimo período, cujos átomos têm sete camadas.
Concluímos, portanto, que elementos de um mesmo período apresentam átomos com igual número de camadas eletrônicas. Além disso, o número de camadas eletrônicas com elétrons é igual ao número do período do elemento na tabela periódica.
Respostas e comentários
Subitem Distribuição eletrônica dos elementos representativos
Auxilie os estudantes na leitura do trecho da tabela periódica ilustrado no livro do estudante.
Peça a eles que observem quantas camadas eletrônicas têm os átomos dos elementos químicos do 1º período. Eles deverão responder que há somente uma camada. Continue com o mesmo tipo de questionamento até o 7º período.
Quando finalizar, pergunte à turma o que se pode concluir sôbre a relação entre o número de camadas eletrônicas e o período no qual um elemento químico está representado na tabela periódica.
A resposta é que o número do período é igual ao número de camadas eletrônicas.
Em seguida, peça aos estudantes que observem quantos elétrons existem na última camada eletrônica nos átomos dos elementos químicos dos grupos 1 e 2.
Eles deverão concluir que, nos elementos do grupo 1, há um elétron, e nos do grupo 2, dois elétrons.
Continue com o mesmo tipo de questionamento entre os grupos 13 e 18.
Nesses casos, os estudantes deverão inferir que o algarismo da unidade do grupo é o mesmo que o número de elétrons da última camada. Exceto o hélio, que está no grupo 18, mas só tem 2 elétrons.
Atividades
Ao final do item 7, proponha os exercícios 7 a 11 do Use o que aprendeu.
Camada de valência e grupo do elemento
Pelos dados do esquema reproduzido anteriormente, também é possível perceber que os átomos de elementos de um mesmo grupo (família) apresentam em comum o número de elétrons na última camada.
Os átomos de elementos do grupo 1 apresentam 1 elétron na última camada. A diferença entre a eletrosfera de seus átomos está no número de camadas. O átomo de agá (primeiro período) tem uma camada, o de éle i (segundo período) duas camadas, o de êne á (terceiro período) três camadas etcétera
Os átomos de elementos do grupo 2 têm 2 elétrons na última camada, os do grupo 13 têm 3 elétrons na última camada, os do grupo 14 têm 4 elétrons e assim por diante.
A camada mais externa do átomo de um elemento químico é aquela envolvida diretamente no estabelecimento de união com . Ela é denominada camada de valência e os elétrons dessa camada são chamados de elétrons de valência.
Elementos de um mesmo grupo (mesma família) da tabela periódica têm o mesmo número de elétrons na camada de valência.
Exceção a isso é o elemento hélio (zê = 2). Seus átomos apresentam 2 elétrons na camada de valência, mas ele não é colocado no grupo 2. Suas propriedades não se assemelham às dos elementos daquele grupo, mas sim às dos gases nobres (êne ê, á érre, , xis ê, ). Por isso, o hélio é considerado gás nobre e é incluído no grupo 18 da tabela periódica.
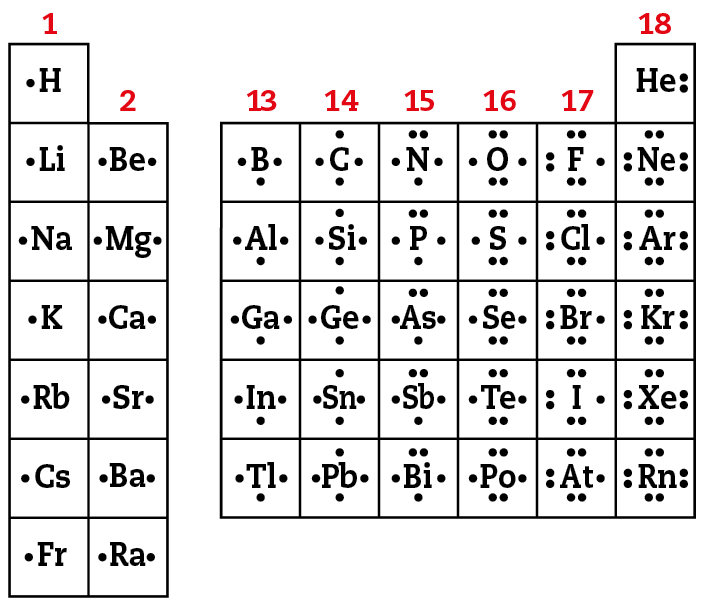
Fonte: Xâng, R.; , K. A. Chemistry. edição Nova iórque: McGraw-Hill, 2019. página 368.
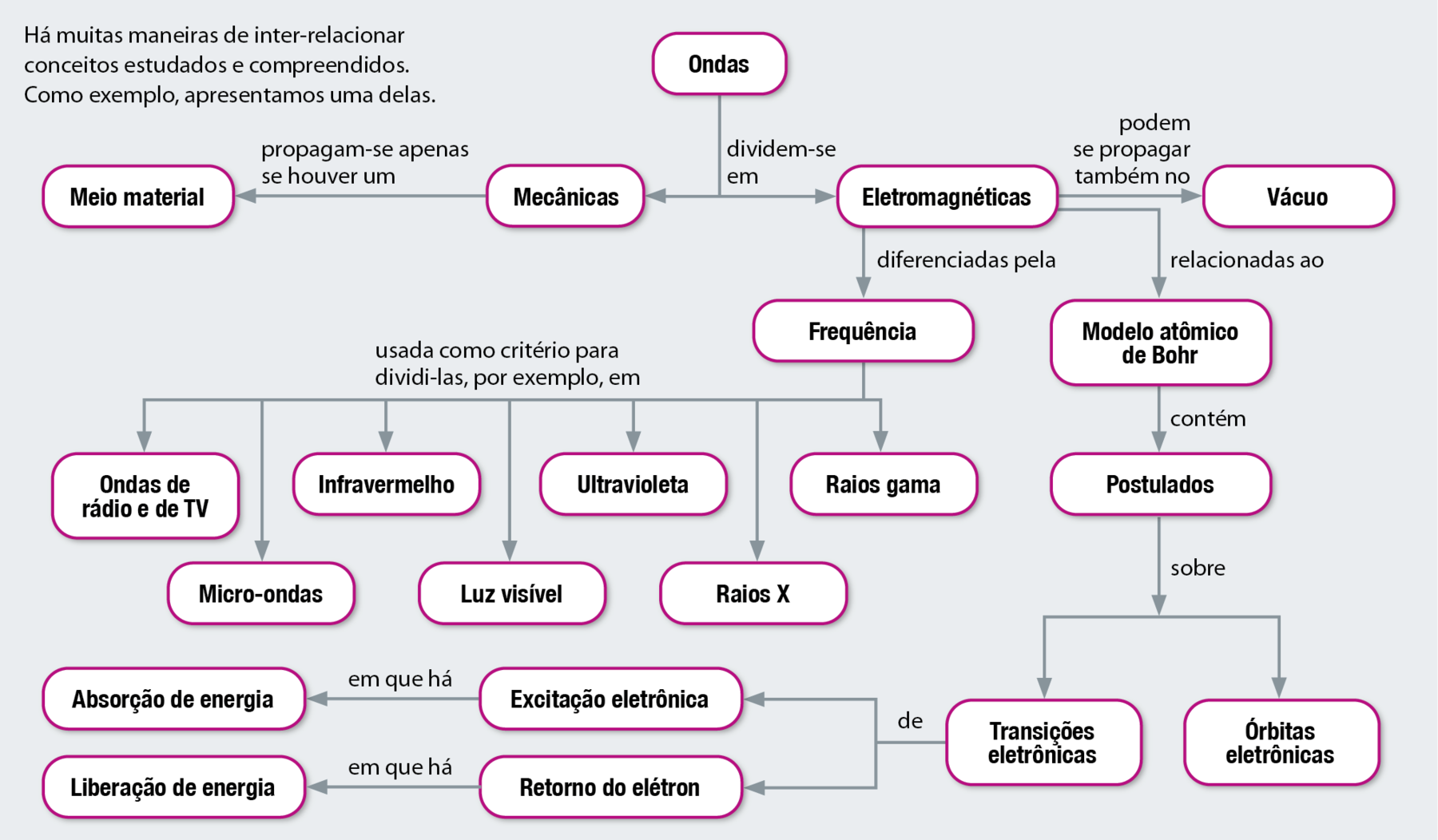
Organização de ideias
MAPA CONCEITUAL
Respostas e comentários
De ôlho na Bê êne cê cê!
A seção Use o que aprendeu dêste capítulo possibilita que algumas competências gerais e específicas sejam desenvolvidas por meio da resolução de atividades.
A atividade 6 favorece a competência geral 1, porque requer utilizar os conhecimentos historicamente construídos sôbre o mundo físico para entender e explicar a realidade e continuar aprendendo.
A atividade 2 oportuniza o desenvolvimento da competência geral 2, porque estimula os estudantes a exercitar a curiosidade intelectual e recorrer à abordagem própria das ciências, incluindo a investigação, a reflexão, a análise crítica, a imaginação e a criatividade.
As atividades 1, 3 e 6 alinham-se ao desenvolvimento da competência específica 1, na medida em que favorecem compreender as Ciências da Natureza como empreendimento humano, e o conhecimento científico como cultural e histórico.
As atividades 1 e 3 são propícias ao trabalho da competência específica 4, pois, nelas, os estudantes deverão avaliar aplicações e implicações culturais da ciência e de suas tecnologias para propor alternativas aos desafios do mundo contemporâneo, incluindo aqueles relativos ao mundo do trabalho.

Atividades
Use o que aprendeu
- Faça uma lista das utilidades das ondas eletromagnéticas em seu dia a dia. Confronte-a com a de seus colegas e, a seguir, responda: a humanidade teria a mesma qualidade de vida se não utilizasse as tecnologias associadas às ondas eletromagnéticas? Justifique sua opinião.
- Na sua opinião, qual dos tipos de onda eletromagnética é o mais útil para você em seu dia a dia? Por quê?
- Os raios X não são úteis apenas em Medicina. Pesquise e responda qual é a utilidade dos raios X:
- na segurança de aeroportos;
- na indústria.
- Em algumas cidades brasileiras existem sensores no pavimento das ruas, espaçados a intervalos predeterminados, que, pressionados sucessivamente pelas rodas de um veículo, permitem avaliar a velocidade dele e, se estiver acima do permitido, fotografá-lo. Algumas pessoas chamam esse dispositivo de “radar”.
Explique por que essa denominação não está correta.
- Boa parte dos satélites usados em comunicação são geoestacionários, ou seja, orbitam ao redor da Terra completando uma volta a cada 24 horas, o que faz com que estejam em órbita sempre sôbre uma mesma região. Explique por que é conveniente que um satélite usado em comunicações seja geoestacionário.
- Pesquise em que época viveu e qual foi sua contribuição para a humanidade. Como o trabalho de outros cientistas possibilitou essa contribuição? Elabore um pequeno texto explicando que o conhecimento científico é uma produção coletiva. Use argumentos válidos que façam parte de seus conhecimentos e/ou que você tenha pesquisado em fontes confiáveis de informação.
- O rubídio é um metal alcalino que se encontra no quinto período da tabela periódica. Sem consultar a tabela, é possível dizer quantas camadas eletrônicas apresenta um átomo dêsse elemento e quantos elétrons há em sua camada de valência? Justifique sua resposta.
- O chumbo é o elemento do sexto período, grupo 14. Sem consultar a tabela periódica, é possível prever quantos elétrons há na camada de valência de um átomo de chumbo? Explique.
- Dois dos elementos químicos representativos muito importantes para a saúde óssea têm as seguintes características: um deles apresenta átomos com quatro camadas eletrônicas e dois elétrons na última delas; os átomos do outro têm três camadas eletrônicas e cinco elétrons na última camada.
- Você consegue prever o período e o grupo dêsses elementos na tabela periódica, sem consultar o esquema de distribuições eletrônicas apresentado no texto? Justifique.
- Agora, consulte a tabela periódica e diga que elementos são esses.
- Os átomos de um elemento químico presente em quantidade apreciável no corpo humano apresentam 8 prótons e 8 elétrons (além de nêutrons, é claro).
- Qual é a distribuição eletrônica nas camadas dos átomos dêsse elemento?
- A que grupo da tabela periódica ele deve pertencer?
- Os átomos de outro elemento químico presente em quantidade apreciável no corpo humano têm 6 prótons e 6 elétrons (e também nêutrons).
- Qual é a distribuição eletrônica nas camadas dos átomos dêsse elemento?
- A que grupo da tabela periódica ele deve pertencer?
Seu aprendizado não termina aqui
O efeito das ondas eletromagnéticas de diferentes frequências sobre a saúde humana é o tema de muitos estudos científicos. De vez em quando, surgem novas descobertas. Fique atento às notícias sobre esse assunto, pois ele certamente é de seu interesse.
Respostas e comentários
Respostas do Use o que aprendeu
1. Resposta pessoal. Espera-se que, como decorrência da atividade, os estudantes percebam como somos dependentes do confôrto trazido pelas tecnologias associadas à produção e/ou detecção de ondas eletromagnéticas.
2. Resposta pessoal. É provável que as ondas de luz visível sejam muito citadas, assim como as ondas utilizadas em telecomunicações, especialmente nas conexões com a internet.
3. a) Espera-se que, na pesquisa, os estudantes descubram a utilidade dos raios X nas máquinas que verificam a presença de armas, explosivos e outros itens perigosos e/ou ilegais na bagagem. Espera-se, também, que descubram que os detectores através dos quais as pessoas passam, nos aeroportos, não são baseados em raios X, mas sim no magnetismo (trata-se de detecção magnética de metais, como nos dispositivos existentes na porta de bancos).
b) Entre os exemplos que os estudantes podem encontrar estão a análise de materiais para detectar imperfeições ou trincas e a verificação de dimensões internas de peças e equipamentos.
4. O termo “radar” designa um aparelho que emite feixes de ondas eletromagnéticas (micro-ondas, geralmente), capta esses feixes quando retornam após reflexão em um objeto e, analisando o tempo gasto no percurso de ida e de volta, determina a posição e/ou a velocidade do objeto móvel.
O tipo de dispositivo citado no enunciado não avalia a velocidade do veículo por meio de ondas eletromagnéticas, mas por sensores (de pressão) posicionados no chão. Não se trata, portanto, de um verdadeiro radar.
Há, contudo, locais em que a fiscalização eletrônica é feita com auxílio de radares verdadeiros (incluindo radares móveis, posicionados em diferentes locais a cada dia), que dispensam, portanto, sensores posicionados no chão.
5. Espera-se que os estudantes concluam que o satélite geoestacionário permite que a antena que emite sinais para ele e também a que recebe sinais provenientes dele fiquem apontadas sempre na mesma direção, facilitando bastante o processo de comunicação via satélite.
Você pode comentar com os estudantes: Já imaginou, por exemplo, se, na recepção doméstica de sinais de tevê por antena parabólica, esta tivesse de ser constantemente reorientada a fim de apontar para o satélite? E como ficaria o sinal quando tal satélite estivesse do outro lado do planeta?
6. O tema permite que os estudantes descubram que as ondas eletromagnéticas foram previstas teoricamente pelo físico escocês Jeimes Clerk Maxuell (1831-1879). Ele consolidou as ideias do eletromagnetismo em um conjunto de quatro expressões matemáticas, denominadas equações de máquissuél. Por volta de 1862, ele previu, a partir de sua teoria, a existência de ondas eletromagnéticas e determinou sua velocidade no vácuo, obtendo um resultado que coincidiu com a velocidade da luz no vácuo. Isso sugeriu que a luz consiste de ondas eletromagnéticas. (Além de máquissuél, os estudantes poderão mencionar em seus resultados cientistas que o precederam no eletromagnetismo, enfatizando o caráter colaborativo da produção científica.)
Em 1888, o físico alemão Hertz (1857-1894) inventou um dispositivo que produziu ondas eletromagnéticas (da região espectral hoje denominada rádio). Contudo, rértis não explorou a potencialidade do uso das ondas de rádio na comunicação.
O italiano (1874-1937) aplicou a descoberta de Hertz para construir um telégrafo sem fio, em 1895, o que possibilitou trocar mensagens em código Mórsse entre dois telégrafos não fisicamente conectados. (Anteriormente, o código Mórsse já era usado na telegrafia com fio.)
O telégrafo de era um de rádio. A invenção de possibilitou uma nova era nas comunicações, abrindo caminho para diversas aplicações posteriores de ondas eletromagnéticas nas telecomunicações.
7. É possível. Como o rubídio é do 5º período, seus átomos têm 5 camadas eletrônicas. E, como é alcalino (grupo 1), tem um elétron na camada de valência (última camada).
8. É possível. Os elementos do grupo 14 (família do carbono) têm 4 elétrons na camada de valência.
9. a) O primeiro mencionado está no 4º período (4 camadas) e no grupo 2 (2 elétrons de valência).
O outro está no 3º período (3 camadas) e no grupo 15 (5 elétrons de valência).
b) Respectivamente, cálcio (cê á ) e fósforo (pê).
10. a) cá – 2 éle – 6
b) Grupo 16.
Observação: É o oxigênio.
11. a) cá – 2 éle – 4
b) Grupo 14.
Observação: É o carbono.

Fechamento da unidade
Isso vai para o nosso blog!


Os elementos químicos
A critério do professor, a classe será dividida em grupos e cada um deles criará e manterá um blog na internet sôbre a importância do que se aprende em Ciências da Natureza. Nesta atividade, a meta é selecionar informações (acessar, reunir, ler, analisar, debater e escolher as mais relevantes e confiáveis) relacionadas aos tópicos a seguir para incluir no blog.

Respostas e comentários
Fechamento da unidade A
Objetivo: Propiciar uma situação de trabalho em que os estudantes se interessem por informações referentes à Química, especialmente sôbre os elementos químicos, sua descoberta, suas aplicações e sua eventual periculosidade.
Comentário: O professor deve propor a cada equipe o nome de alguns elementos químicos, a fim de que sejam pesquisadas características dêsse elemento, tais como época da descoberta e contexto histórico em que se deu essa descoberta, ocorrência natural, importância no sistema produtivo, grau de necessidade ao organismo humano ou grau de toxicidade.
Atribua a cada equipe os mesmos elementos químicos já pesquisados por seus integrantes no Tema para pesquisa do item 9 do capítulo 2. Oriente-os a aproveitar seus resultados anteriores (origem e significado do nome) e a prosseguir, realizando as demais solicitações desta atividade.
Os resultados devem ser postados no blog de Ciências de cada equipe. A seu critério, as equipes podem também fazer um vídeo ou um podcast para cada elemento químico que lhes foi atribuído, apresentando, por meio dessa produção, os resultados que obtiveram.
Alternativamente, você pode solicitar a apresentação em público dos resultados, a qual pode incluir recursos digitais (de acôrdo com conveniência e disponibilidade).
Além de desenvolver habilidades e atitudes necessárias para expressar-se em público, a atividade pode despertar o interêsse dos estudantes sôbre outros assuntos correlatos, que poderão, a seu critério, ser desenvolvidos oportunamente.
tê cê tê Saúde e Ciência e Tecnologia
Essa atividade, em função das solicitações às equipes, relaciona-se aos tê cê tês Saúde e Ciência e Tecnologia.
De ôlho na Bê êne cê cê!
A atividade de fechamento de unidade favorece as competências gerais 1, 4, 5, 9 e 10 e as competências específicas 4, 6 e 8 (conforme comentado na parte inicial dêste Manual do professor).
É favorecido também o trabalho com a competência específica 7, no que se refere a conhecer, apreciar e cuidar de si, do seu corpo e bem-estar, recorrendo aos conhecimentos das Ciências da Natureza e às suas tecnologias.
Turmas numerosas
Esta atividade pode auxiliar no caso de turmas com muitos estudantes, pois permite destacar as qualidades de todos que compõem a turma. Atente para que as equipes propiciem equidade de oportunidades aos seus integrantes e para que haja um clima saudável de cooperação, favorecendo a interação e o aprendizado dos estudantes com seus pares.