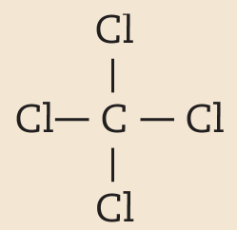UNIDADE B

CAPÍTULO 4 Ligações químicas


Respostas e comentários
Este capítulo e seus conteúdos conceituais
- Noções sôbre ligações químicas
- Algumas substâncias químicas de importância cotidiana
- Regra do octeto, distribuição eletrônica nas camadas e suas implicações na previsão de ligações químicas
- Noções sôbre substâncias iônicas, substâncias moleculares e substâncias metálicas e suas propriedades
- Importância dos elementos químicos no cotidiano
- Valência e tabela periódica
Nesta unidade B, um fio condutor são os materiais. O capítulo 4 permite perceber que determinadas propriedades das substâncias são condicionadas pela estrutura submicroscópica, que, por sua vez, está vinculada ao tipo de ligação química entre os átomos.
No capítulo 5, os estudantes verão que materiais em vibração produzem ondas sonoras, caracterizadas por propriedades como frequência e velocidade. A frequência das ondas sonoras está vinculada a características do material que as produz, e a velocidade de propagação depende do material pelo qual se propagam.
O capítulo 6, último da unidade, versa sôbre a interação da luz com materiais. Parte do capítulo se dedica à absorção ou reflexão das componentes da luz branca. Outra parte trabalha a passagem da luz por meios transparentes. Uma terceira parte versa sôbre a reflexão da luz na superfície de materiais, sejam aqueles que a refletem de maneira difusa (uma parede ou uma folha de papel, por exemplo), sejam aqueles que a refletem de maneira regular (um espelho ou uma superfície metálica limpa e polida).
Iniciando a unidade, este capítulo 4 tem como meta estabelecer a noção de que as substâncias podem ser classificadas em três categorias (iônicas, moleculares e metálicas), de acôrdo com o tipo de ligação química presente.
As ligações químicas podem ser classificadas fundamentalmente em interatômicas e intermoleculares. As primeiras, estudadas neste capítulo, subdividem-se em iônica, covalente e metálica, que dão origem a grupos de substâncias que, tipicamente, apresentam algumas semelhanças.
No caso de a ligação interatômica ser covalente ou no caso dos gases nobres (monoatômicos), a substância é constituída por moléculas que, por sua vez, interagem entre si (principalmente nas fases sólida e líquida) por meio de ligações intermoleculares. Uma noção comparativa da intensidade dessas ligações é fornecida na tabela do item 6 dêste capítulo.
Estudar ligações químicas interatômicas inclui perceber que há substâncias que conduzem eletricidade quando sólidas e que exibem brilho característico. Há substâncias que não conduzem corrente elétrica quando sólidas, mas, submetidas a temperaturas suficientemente altas para provocar sua fusão, passam a conduzi-la. E há substâncias que não apresentam condutividade elétrica apreciável em nenhum dos três estados de agregação, à pressão ambiente.
Da percepção da existência dêsses padrões, aliada à inclusão de cargas elétricas no modelo atômico, surgiram propostas de explicação para a ocorrência de ligações químicas entre os elementos e, também, para algumas das propriedades das substâncias resultantes de tais ligações.
tê cê tês Ciência e Tecnologia e Cidadania e Civismo
A foto de abertura, ao relacionar uma aplicação científica (a prótese que o atleta utiliza) à atuação no esporte de uma pessoa com deficiência, permite abordar os Temas Contemporâneos Transversais Ciência e Tecnologia (macroárea homônima) e Educação em Direitos Humanos (macroárea Cidadania e Civismo) na leitura e discussão da legenda.
Saliente a relevância da equidade entre as pessoas e a necessidade da valorização da cultura de paz na sociedade, o que implica a eliminação de todas as fórmas de preconceito.
Motivação
Em Ciência, um importante procedimento é classificar os objetos em estudo, ou seja, separá-los em categorias de acôrdo com suas semelhanças.
Vamos, inicialmente, conhecer uma possível classificação de substâncias químicas, que as divide em três grupos, de acôrdo com suas propriedades. Com essa finalidade, as propriedades de algumas substâncias são apresentadas na tabela. As propriedades são:
- temperatura de fusão;
- condutividade elétrica em fase sólida;
- condutividade elétrica em fase líquida.
A condutividade elétrica é a propriedade que diferencia um condutor de um isolante elétrico (conceitos vistos no item 4 do capítulo 2). Os condutores elétricos apresentam elevada condutividade elétrica, ou seja, cargas elétricas podem se movimentar através deles com facilidade. Os isolantes elétricos, ao contrário, têm condutividade elétrica nula. Em outras palavras, podemos dizer que os condutores elétricos conduzem corrente elétrica e os isolantes elétricos não a conduzem.
Analise os dados da tabela e veja se você percebe quais são as regularidades usadas para agrupar essas substâncias em três categorias distintas. Registre suas conclusões no caderno e volte a elas após estudar o capítulo, reformulando-as se julgar necessário.

|
Substância |
Fórmula que representa a substância |
Temperatura de fusão (°C) |
Conduz corrente elétrica em: |
|
|---|---|---|---|---|
|
fase sólida? |
fase líquida? |
|||
|
Substâncias iônicas |
||||
|
Cloreto de lítio |
LiCl |
610 |
Não |
Sim |
|
Brometo de potássio |
KBr |
734 |
Não |
Sim |
|
Cloreto de cálcio |
CaCl2 |
775 |
Não |
Sim |
|
Cloreto de sódio |
NaCl |
801 |
Não |
Sim |
|
Óxido de alumínio |
Al2O3 |
2.053 |
Não |
Sim |
|
Óxido de magnésio |
MgO |
2.825 |
Não |
Sim |
|
Substâncias moleculares |
||||
|
Etanol |
C2H6O |
–114 |
Não |
Não |
|
Cloro |
Cl2 |
–102 |
Não |
Não |
|
Água |
H2O |
0 |
Não |
Não |
|
Naftaleno |
C10H8 |
80 |
Não |
Não |
|
Iodo |
I2 |
114 |
Não |
Não |
|
Glicose |
C6H12O6 |
150 |
Não |
Não |
|
Substâncias metálicas |
||||
|
Alumínio |
Al |
660 |
Sim |
Sim |
|
Prata |
Ag |
962 |
Sim |
Sim |
|
Ouro |
Au |
1.064 |
Sim |
Sim |
|
Cobre |
Cu |
1.085 |
Sim |
Sim |
|
Ferro |
Fe |
1.538 |
Sim |
Sim |
|
Platina |
Pt |
1.768 |
Sim |
Sim |
Fonte das temperaturas de fusão: HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 97. ed. Boca Raton: CRC Press, 2016. p. 3-4ss e 4-44ss.
Respostas e comentários
De ôlho na Bê êne cê cê!
A foto e o texto de abertura dêste capítulo possibilitam o desenvolvimento: da competência geral 2, pois incentivam a exercitar a curiosidade intelectual e recorrer à abordagem própria das ciências, incluindo a investigação, a reflexão, a análise crítica, a imaginação e a criatividade; da competência geral 6, por estimularem o estudante a valorizar a diversidade de saberes e vivências culturais e apropriar-se de conhecimentos e experiências que lhe possibilitem entender as relações próprias do mundo do trabalho e fazer escolhas alinhadas ao exercício da cidadania e ao seu projeto de vida, com liberdade, autonomia, consciência crítica e responsabilidade; da competência específica 3, porque auxiliam em analisar, compreender e explicar características, fenômenos e processos relativos ao mundo natural, social e tecnológico, como também as relações que se estabelecem entre eles, exercitando a curiosidade para fazer perguntas e buscar respostas com base nos conhecimentos das Ciências da Natureza; e da competência específica 4, pois estimulam a avaliar aplicações e implicações culturais da ciência e de suas tecnologias para propor alternativas aos desafios do mundo contemporâneo, incluindo aqueles relativos ao mundo do trabalho.
Desenvolvimento do tema
1. Tipos de substâncias que estudaremos
Um dos possíveis critérios de classificação das substâncias, que é o empregado na tabela anterior, divide-as nos três grupos a seguir. Estudaremos a razão dos nomes dos grupos neste capítulo.
- Substâncias iônicas — conduzem a corrente elétrica em fase líquida, mas não em fase sólida. Têm temperaturas de fusão altas. Esse grupo inclui éle iCl, KBr, Cê aCl₂, êne áCl, a éle₂O e ême gê ó.
- Substâncias moleculares — não conduzem corrente elétrica nas fases sólida e líquida. Apresentam, em geral, temperaturas de fusão mais baixas que as substâncias dos outros dois grupos. Nesse grupo estão cêagáóh, cê éle, agáóh, cêagá, ih e cêagáóh.
- Substâncias metálicas — conduzem corrente elétrica tanto na fase sólida quanto na líquida. Diversas delas têm temperaturas de fusão relativamente altas. Aqui se incluem a éle, á gê, á ú, cê ú, éfe ê, pê tê.
Interrompa sua leitura por alguns instantes e procure na tabela periódica os elementos que formam essas substâncias. Verifique se são metais ou não metais. A que conclusão você chegou?



2. Ligações químicas que estudaremos
Ligações químicas e camada de valência
Todas as substâncias químicas são formadas por átomos de elementos químicos. Os cientistas observaram que a imensa maioria das substâncias conhecidas é formada por átomos combinados, unidos, ligados a outros. Às vezes são átomos de um mesmo elemento, às vezes de elementos diferentes.
Dos milhões de substâncias conhecidas, sabe-se de apenas seis nas quais existem átomos não ligados a outros. Essas substâncias são o hélio, o neônio, o argônio, o criptônio, o xenônio e o radônio, gases presentes em pequena quantidade na atmosfera terrestre e formados por átomos não combinados de elementos do grupo 18 da tabela periódica (agá ê, êne ê, á érre, , xis ê, ), o grupo dos gases nobres. Além disso, até hoje não foi descoberta sequer uma substância natural na qual átomos de gases nobres estejam combinados entre si ou com átomos de outros elementos.
Essas observações forneceram evidências iniciais aos cientistas para esclarecer como os átomos se combinam. Já que a eletrosfera é a parte mais externa dos átomos e o núcleo é muito pequeno, parece razoável ser a eletrosfera que atua na combinação dos átomos. Hoje, sabe-se que todas as ligações químicas entre átomos têm origem elétrica, representando compromissos entre fôrças atrativas (entre cargas de sinais diferentes) e fôrças repulsivas (entre cargas de sinais iguais).
Respostas e comentários
Itens 1 e 2
No item 1, um aspecto que pode ser discutido por você é um procedimento frequente em Ciências da Natureza: classificar objetos em estudo, isto é, separá‑los em categorias de acôrdo com suas propriedades. Em se tratando de substâncias químicas, um dos possíveis esquemas classificatórios consiste em dividi‑las em três grupos, de acôrdo com o conjunto das propriedades temperatura de fusão e condutividade elétrica, tanto em fase sólida quanto em fase líquida.
Ao longo do capítulo, os estudantes perceberão que essas propriedades estão relacionadas ao tipo de ligação química interatômica. Um dos grupos é o das substâncias tipicamente iônicas, que têm em comum o fato de a ligação ser predominantemente iônica. Elas apresentam elevadas temperaturas de fusão e conduzem bem a corrente elétrica na fase líquida, mas não na fase sólida.
Outro grupo é o das substâncias tipicamente moleculares, nas quais os átomos se unem por ligação predominantemente covalente, constituindo as moléculas. Quando puras e sob pressão ambiente, essas substâncias não conduzem corrente elétrica e apresentam temperaturas de fusão que, de modo geral, são bem mais baixas que as das substâncias iônicas.
Uma terceira categoria, a das substâncias tipicamente metálicas, nas quais existe ligação predominantemente metálica, caracteriza‑se pela boa condução de corrente elétrica tanto na fase sólida como na fase líquida. As temperaturas de fusão são relativamente altas, em geral superiores às das substâncias moleculares, embora haja algumas notáveis exceções a essa regularidade.
Exemplos dêsses três tipos de substância estão relacionados na tabela da seção Motivação.
No item 2, a apresentação da regra do octeto está vinculada à baixíssima tendência dos gases nobres a se combinarem quimicamente. A análise em sala de aula da tabela que apresenta a distribuição eletrônica em níveis de energia para esses elementos é relevante para favorecer o entendimento.
Ressalte que, embora a regra do octeto tenha sua relevância histórica e auxilie a prever alguns casos referentes a ligações químicas, ela não explica por que os átomos se combinam. Além disso, há grande variedade de substâncias cujas ligações químicas não são previsíveis por essa regra.
Também é importante esclarecer que já foram produzidos em laboratório compostos de determinados gases nobres, por exemplo xis êF₂, xis êF₄, xis êO₃, xis êO₄, xis êOF₂, xis êO₃F₂, xis êOF₄ e O₆. O primeiro composto de gás nobre foi sintetizado por (1932‑2008) em 1962, o xis ê[PtF₆]. Compostos de xenônio são os mais estudados, seguidos pelos compostos de criptônio. O estudo do radônio é bastante dificultado pelo fato de todos os seus isótopos serem radioativos.
Vimos, no capítulo 3, que os elétrons distribuem-se em camadas, ou em níveis (K, L, M etcétera).
A camada mais externa da eletrosfera, denominada camada de valência, é a que mais pode se aproximar da eletrosfera de outro átomo e, por isso, é aquela envolvida nas ligações químicas que ocorrem entre os átomos e os mantêm unidos.
Ao contrário de todos os outros elementos, os gases nobres apresentam a última camada contendo 8 elétrons, com exceção do hélio, no qual a última camada só comporta 2 (veja a tabela). No início do século vinte, cientistas consideraram que possuir 8 elétrons na última camada (ou 2, caso seja a camada K) faz com que o átomo fique estável. O estadunidense guílbert Niutom LIUÍS (1875-1946) propôs, em 1916, uma teoria para explicar a ligação entre os átomos, que ficou conhecida como modelo do octeto de elétrons, ou, simplesmente, regra do octeto. De acôrdo com essa regra, um átomo estará estável quando sua última camada (camada de valência) possuir 8 elétrons (ou 2, caso se trate da camada K). Os átomos não estáveis se unem uns aos outros a fim de adquirir essa configuração de estabilidade.
Neste capítulo, apresentaremos uma visão introdutória das ligações químicas e consideraremos substâncias iônicas e moleculares em que os átomos têm eletrosferas em conformidade com a regra do octeto. Tenha em mente, contudo, que são conhecidas muitas exceções a essa regra, estudadas no Ensino Médio e no Ensino Superior.
|
Gás nobre |
K |
L |
M |
N |
O |
P |
|---|---|---|---|---|---|---|
|
Hélio |
2 |
|||||
|
Neônio |
2 |
8 |
||||
|
Argônio |
2 |
8 |
8 |
|||
|
Criptônio |
2 |
8 |
18 |
8 |
||
|
Xenônio |
2 |
8 |
18 |
18 |
8 |
|
|
Radônio |
2 |
8 |
18 |
32 |
18 |
8 |
Fonte: cóts, J. êti áli. Chemistry and chemical reactivity. décima edição Boston: Cengage, 2019. página 316.
Ligações químicas e tipos de substâncias
As ligações químicas entre átomos, que estudaremos a seguir, são de três tipos: iônica, covalente e metálica. De modo geral:
- as substâncias iônicas são constituídas de metal e de não metal unidos por ligação iônica;
- as substâncias moleculares são constituídas de átomos de não metais entre os quais existe ligação covalente;
- as substâncias metálicas são constituídas de átomos de metal unidos por ligação metálica.
Fonte das figuras: Timberlêik, K. General, Organic, and Biological Chemistry; . sexta edição Harlow: Pearson, 2021. página 98, 102.
Respostas e comentários
Conteúdos procedimentais sugeridos
- Prever se uma substância é iônica, molecular ou metálica, com base em sua fórmula e consultando a tabela periódica.
- Elaborar a fórmula prevista para o composto iônico formado por um metal e um não metal, fundamentando-se na posição dos elementos na tabela periódica.
- Elaborar a fórmula eletrônica e a fórmula estrutural para casos simples de substâncias moleculares, a partir da fórmula molecular e da posição dos elementos na tabela periódica.
- De posse da tabela periódica e da carga de um íon, estabelecer uma comparação entre ele e o respectivo átomo neutro, no tocante ao número de prótons e ao de elétrons.
Prever se uma substância é iônica, molecular ou metálica depende do desenvolvimento da habilidade de verificar se cada elemento presente na fórmula da substância é metal ou não metal.
Esse e os demais conteúdos procedimentais elencados para este capítulo podem ser desenvolvidos com as atividades propostas no livro do estudante.
Conteúdos atitudinais sugeridos
- Interessar-se pelas ideias científicas e pela Ciência como maneira de entender melhor o mundo que nos cêrca.
- Perceber que muito do conforto da vida moderna se deve à utilização de progressos da Química.
- Prestar atenção aos rótulos de produtos industrializados.
- Compreender que a Ciência é um construto humano.
Essas são atitudes que se pretende desenvolver ao longo de todo o curso de Ciências da Natureza, em especial ao abordar temas ligados a tecnologia e sociedade. Este capítulo é bastante ilustrativo da importância prática das ideias científicas e permite que, durante ou após o seu desenvolvimento, se trabalhem esses conteúdos atitudinais com os estudantes.
De ôlho na Bê êne cê cê!
Todos os temas apresentados nos itens do Desenvolvimento do tema contribuem para que os estudantes possam compreender conceitos fundamentais e estruturas explicativas das Ciências da Natureza, de modo a sentir segurança no debate de questões científicas, tecnológicas e do mundo do trabalho, continuar aprendendo e colaborar para a construção de uma sociedade justa, democrática e inclusiva, o que favorece o desenvolvimento da competência específica 2.
Atividades
Ao final do item 2, proponha os exercícios 1 a 5 do Use o que aprendeu.
3. Ligação iônica
As substâncias iônicas são constituídas de íons, que são átomos (ou grupos de átomos) com carga elétrica não nula (positiva ou negativa).
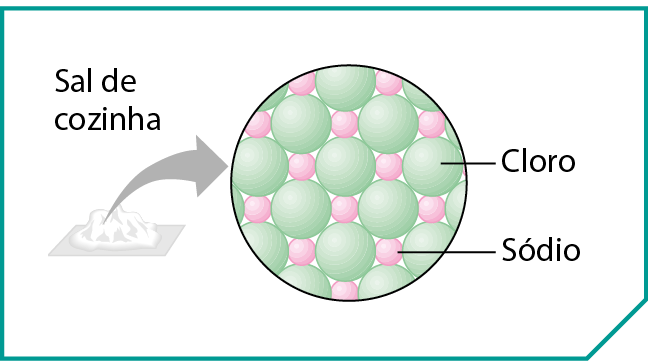
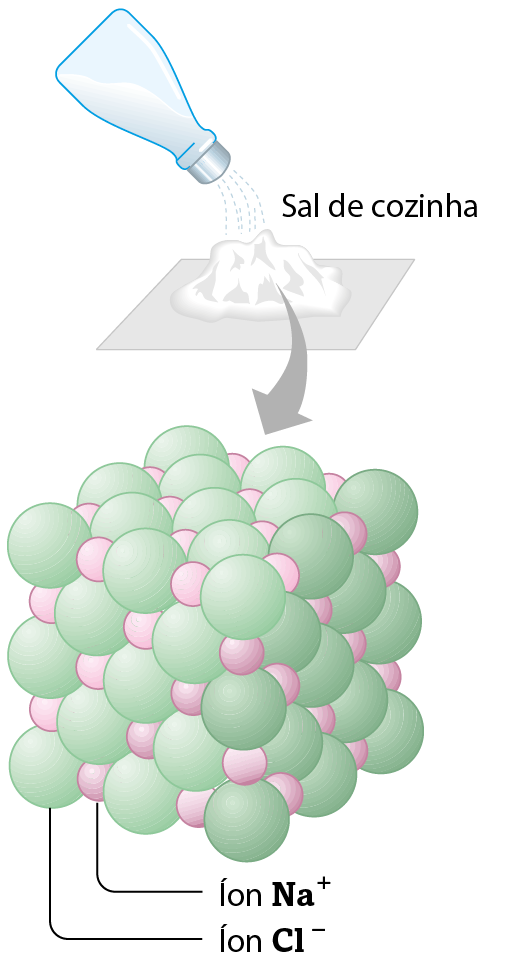
No cloreto de sódio (êne áCl), componente do sal de cozinha, existem íons do elemento químico sódio e íons do elemento químico cloro.
Para entender o fato de, no êne áCl, os átomos de sódio e de cloro serem dotados de carga elétrica, comecemos com as seguintes informações extraídas da tabela periódica:
|
Elemento |
Nº de prótons |
Nº de elétrons |
Carga elétrica total |
|---|---|---|---|
|
Sódio (Na) |
11 |
11 |
0 |
|
Cloro (Cl) |
17 |
17 |
0 |
Agora compare a eletrosfera dêsses elementos com a dos gases nobres neônio e argônio:
|
Elemento |
Nº de prótons |
Nº de elétrons |
Carga elétrica total |
|---|---|---|---|
|
Neônio (Ne) |
10 |
10 |
0 |
|
Argônio (Ar) |
18 |
18 |
0 |
Você notou que a eletrosfera do sódio está mais próxima, em número de elétrons, da eletrosfera do neônio? E que a do cloro está mais próxima da do argônio? Se não notou, analise novamente os dados apresentados antes de prosseguir a leitura.
Se o sódio perder um elétron, sua eletrosfera passará a ter o mesmo número de elétrons do neônio. E se o cloro receber um elétron, ficará com o mesmo número de elétrons do argônio.
Os cientistas verificaram que, no cloreto de sódio, os átomos de sódio têm 10 elétrons e os de cloro têm 18. Como consequência, esses átomos não estão eletricamente neutros.
|
Elemento |
Nº de prótons |
Nº de elétrons |
Carga elétrica total |
|---|---|---|---|
|
Sódio (Na) |
11 |
10 |
+1 |
|
Cloro (Cl) |
17 |
18 |
–1 |
Quando átomos perdem ou recebem elétrons, eles deixam de ser eletricamente neutros e passam a ser íons. Um íon positivo é chamado de cátion e um íon negativo é denominado ânion.
O cátion sódio é representado por , o que indica a sua carga positiva. O ânion do elemento cloro é representado por , o que indica a sua carga negativa. Como os íons e possuem cargas de sinais opostos, atraem-se mutuamente e mantêm-se unidos. Essa união entre íons é chamada ligação iônica e origina uma estrutura altamente organizada, o retículo cristalino iônico, esquematizada na figura.
Fonte: , J. Chemistry. quinta edição Nova York: McGraw-Hill, 2020. página 57.

ATIVIDADE
Para discussão em grupo
Após ler todo o item 3, consultar a tabela periódica e procurar nela os elementos éle i, cá, ême gê, bê á, a éle, Bê érre e ésse. Qual é o gás nobre cujo número de elétrons é mais próximo do de cada um deles? Quantos elétrons cada um dêsses elementos deve perder ou receber para adquirir eletrosfera similar à de gás nobre? Qual é a carga adquirida após a perda ou o recebimento de elétrons? Apresentar as conclusões ao professor e debater com ele cada caso.
Respostas e comentários
Item 3
Ao trabalhar a temática ligação iônica e o restante do capítulo, atente que a tabela periódica é um instrumento de consulta. Não faz sentido que os estudantes memorizem dados nela presentes.
A possibilidade de consulta à tabela periódica também deve ser estendida ao momento de realização das avaliações.
Para discussão em grupo
A intenção da atividade é exercitar a capacidade de consulta à tabela periódica e a execução de comparações.
A atividade permite concluir quais são as cargas, em ligação iônica, dos elementos apresentados:
L i mais,
K mais,
M g dois mais,
B a dois mais,
A l três mais,
B r menose
S dois menos.
Esteja atento para esclarecer o significado das notações 2+, 3+ e 2 que aparecem sobrescritas à direita dos símbolos:
- 2+: duas cargas positivas, resultantes da perda de 2 elétrons pelo átomo eletricamente neutro;
- 3+: três cargas positivas, resultantes da perda de 3 elétrons pelo átomo eletricamente neutro;
- 2–: duas cargas negativas, resultantes do recebimento de 2 elétrons pelo átomo eletricamente neutro.
Além de exercitar a consulta à tabela periódica e a realização de comparações, a proposta permite desenvolver nos estudantes a capacidade de argumentar em textos escritos (no momento de responder às questões) e em textos orais (durante a apresentação das conclusões e no momento do debate).
Em termos de distribuição eletrônica nos níveis de energia para os átomos eletricamente neutros de sódio e cloro, temos:

E, para os íons êne á+ e cêéle–, temos:

A comparação entre os átomos neutros e os íons constituintes do NaCl pode ser esquematizada, simplificadamente, representando-se por bolinhas os elétrons da última camada (a camada de valência) ao redor do símbolo do elemento:
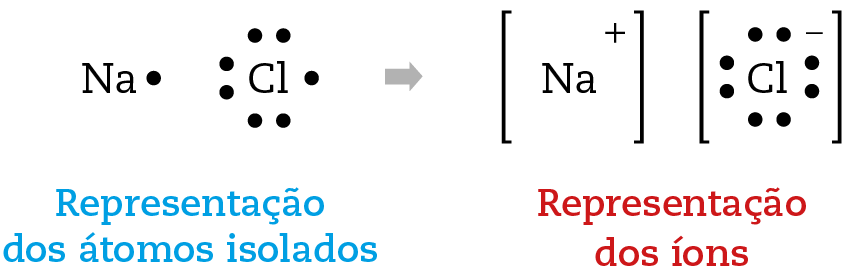
O êne á cê éle é um exemplo de composto iônico, ou seja, formado por íons.

Veja mais dois exemplos esquemáticos:

Para escrever a fórmula de um composto iônico, basta verificar a carga do íon formado pelos elementos (no nosso nível de estudo, pela regra do octeto) e considerar que, num composto, a carga elétrica total positiva deve ser igual à negativa, resultando carga total nula.

Por exemplo:

Respostas e comentários
Atente!
No item 3, outros exemplos de compostos iônicos que você pode explorar em aula são o e o aéleésse.
Em todo composto iônico, as cargas negativas e positivas se cancelam, e a carga total do composto é nula.
No , por exemplo, as duas cargas positivas de cada ême gê são compensadas por duas cargas negativas de cada dois Bê érre–.
E, no aéleésse, as seis cargas positivas de cada dois íons aéle são compensadas por seis cargas negativas de cada três íons ésse.
Atividades
Ao final do item 3, os estudantes têm condições de fazer os exercícios 6 a 21 do Use o que aprendeu.
4. Ligação covalente
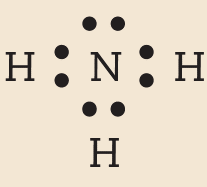
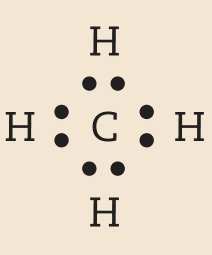
Os átomos que se unem para formar moléculas não se transformam em íons, apenas compartilham alguns de seus elétrons. Os elétrons compartilhados passam a fazer parte da eletrosfera de mais de um átomo. Nas moléculas em que os átomos estão em conformidade com a regra do octeto, é o compartilhamento que possibilita que cada átomo adquira um número de elétrons igual ao de um gás nobre.
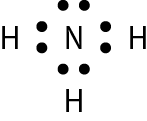
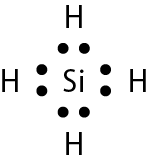
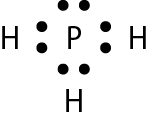
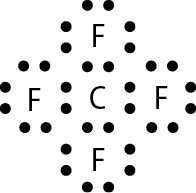
Vamos examinar os casos das substâncias que têm fórmula molecular agá, óh, êne, cê éle e agáóh. Para os átomos dos elementos que as constituem, as distribuições eletrônicas foram apresentadas no item 6 do capítulo 3.
Comparando o número de elétrons na camada de valência dêsses átomos com o dos gases nobres, concluímos o seguinte: Para se assemelhar ao hélio, o hidrogênio precisa de mais 1 elétron (na camada K). Para se assemelhar ao neônio, o nitrogênio necessita de mais 3 elétrons (na camada L) e o oxigênio, de mais 2 (na camada L). O cloro precisa de mais 1 elétron (na camada M) para ficar com o mesmo número de elétrons do gás nobre argônio.
Em substâncias como agá, óh, êne, cê éle e agáóh, os átomos se mantêm unidos porque suas eletrosferas compartilham alguns elétrons. Os elétrons compartilhados são atraídos pelos núcleos dos dois átomos e também os atraem. Essas fôrças atrativas equilibram a tendência de repulsão entre os dois núcleos e também entre as duas eletrosferas. O compromisso das fôrças atrativas e repulsivas possibilita a existência das moléculas.

Nenhum dos átomos envolvidos se transformou em íon, ou seja, nenhum deles perdeu ou recebeu elétrons. Devido ao compartilhamento, todos passaram a ter, na última camada, a quantidade de elétrons que os faz se assemelharem a gases nobres.
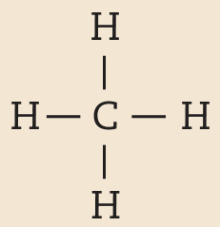
Quando átomos se unem por compartilhamento de elétrons, dizemos que entre eles se estabelece ligação covalente. Cada par de elétrons compartilhado é considerado uma ligação covalente. Os grupos de átomos unidos por ligação covalente são chamados moléculas. A fórmula estrutural de uma molécula é uma representação na qual cada ligação covalente é indicada por um traço.


ATIVIDADE
Para discussão em grupo
Após ler todo o item 4, consultar a tabela periódica e procurar nela os elementos éfe, Bê érre, ésse e pê. Qual é o gás nobre cujo número de elétrons é mais próximo do de cada um deles? Quantos elétrons cada um desses elementos deve compartilhar em para ficar com número de elétrons igual ao de um gás nobre? Qual seria a fórmula da molécula resultante da combinação de cada um dêsses elementos com o hidrogênio?
Apresentar as conclusões ao professor e debater com ele cada caso.
Respostas e comentários
Item 4
Um conceito incorreto, introduzido frequentemente em níveis elementares do ensino, é o de que todas as substâncias seriam formadas por moléculas. Isso não é verdade, e esse capítulo ajuda a evitar essa concepção errônea. As substâncias iônicas e as metálicas não têm natureza molecular. Moléculas são agrupamentos de átomos unidos por ligações covalentes. Por isso, as substâncias estudadas no item 4 são denominadas moleculares. Saliente isso aos estudantes ao trabalhar esse item.
Outra coisa que você pode comentar é que todas as ligações químicas têm origem elétrica. No caso da ligação covalente, a razão física de o compartilhamento eletrônico manter os átomos ligados é comentada a seguir. Quando os elementos A e B estabelecem uma ligação covalente A — B, a densidade de probabilidade de encontrar os elétrons compartilhados é elevada em uma região entre os núcleos. Os núcleos de A e B se repelem devido às cargas elétricas de mesmo sinal. Também os elétrons de A e B não envolvidos nas ligações se repelem mutuamente. Ocorre que os elétrons compartilhados são atraídos pelos núcleos (e os atraem), devido às cargas de sinais opostos, o que resulta numa tendência de aproximação dos núcleos, não porque estes se atraiam, mas devido à interação com os elétrons compartilhados. A distância de equilíbrio da ligação A — B é tal que as fôrças repulsivas são equilibradas pelas fôrças atrativas. Um pequeno deslocamento dos núcleos em relação a essa situação de equilíbrio faz com que haja predominância de uma das tendências envolvidas, atração ou repulsão. Um afastamento provoca predominância da fôrça atrativa; uma aproximação, ao contrário, causa intensificação da repulsão. Assim, os núcleos podem oscilar ao redor de uma distância de equilíbrio, a distância de ligação, na qual existe um compromisso entre atração e repulsão.
Ao trabalhar o tema ligação covalente, o simulador de modelos moleculares sugerido a seguir permite que você mostre aos estudantes (projetando em sala, se possível) a fórmula estrutural de um composto e seu modelo molecular tridimensional, rotacionando-o em todas as direções. Disponível em: https://oeds.link/uwpk0D Acesso em: 27 julho 2022.
O simulador não foi indicado no livro do estudante porque está em inglês. Contudo, seu uso é bastante simples e existem duas maneiras distintas de escolher uma molécula para exibição. Uma delas é digitar na caixa de busca (no canto superior esquerdo, indicada pelo ícone de lupa) o nome da substância (em inglês) ou sua fórmula molecular. Isso fará com que a fórmula estrutural apareça (na parte esquerda da tela). Clique no modelo molecular (do lado direito da tela) e arraste para girá-lo em qualquer direção e visualizá-lo de diferentes pontos de vista. O botão de rolagem do mouse possibilita ampliar ou reduzir o tamanho do modelo molecular.
Teste digitando, por exemplo: “agáóh”, “êne agá”, “cê ó”, “cê agá”, “cêagá”, “cêagá” e “agáóh”. No caso de fórmulas mais complexas, digite-as, mas não tecle enter; o programa mostrará uma lista de opções do banco de dados que se relacionam ao trecho digitado. Clique em uma das opções para poder visualizá-la.
Busque também algumas estruturas pelo nome. Sugestões:
- “vitamin A” (vitamina a);
- “vitamin B₂” (vitamina bê);
- “ascorbic acid” (ácido ascórbico ou vitamina C);
- “vitamin D₂” (vitamina dê);
- “vitamin E” (vitamina ê);
- “glycin” (glicina, o mais simples dos aminoácidos);
- “glucose” (glicose).
Você também pode utilizar esse simulador para montar uma fórmula estrutural. Clique primeiro no ícone da lata de lixo para limpar a fórmula estrutural mostrada. A seguir, elabore a estrutura desejada utilizando os símbolos dos elementos (que estão disponíveis à direita da parte branca da tela) e as ligações e cadeias carbônicas cíclicas (disponíveis na lateral esquerda da tela). O ícone da borracha permite apagar qualquer item que foi acrescentado, mas precisa ser removido.
Após montar a fórmula estrutural, clique em “2D to 3D” (na parte superior da tela) para visualizar o modelo molecular dêsse composto.
No item 6, o boxe Use a internet proporá aos estudantes a utilização de outro simulador para a elaboração de modelos moleculares, este em português.
Para discussão em grupo
O boxe Para discussão em grupo, mais uma vez neste capítulo, oportuniza exercitar a consulta à tabela periódica e a execução de comparações.
A atividade propõe uma comparação na qual se espera que os estudantes concluam o número de ligações covalentes esperadas para átomos de flúor (uma), bromo (uma), enxofre (duas) e fósforo (três).
Durante a discussão, os estudantes têm a oportunidade de desenvolver a capacidade de argumentação em textos orais.
Três maneiras distintas usadas para representar uma molécula são a fórmula molecular, a fórmula eletrônica (também denominada fórmula de LIUÍS) e a fórmula estrutural.

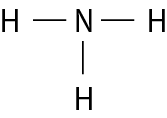
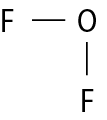
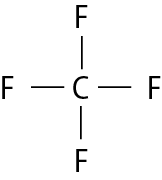
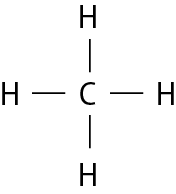
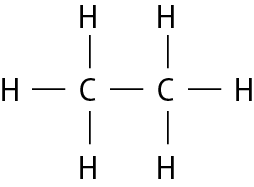
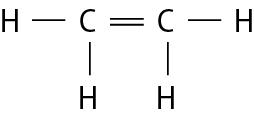
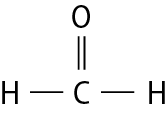
Na molécula de agá e na de cê éle, há uma ligação covalente simples. Na molécula de agáóh há duas ligações covalentes simples. Na molécula de óh há duas ligações covalentes ou, pode-se dizer também, uma ligação covalente dupla. Na molécula de êne, há três ligações covalentes ou uma ligação covalente tripla.
|
Elemento(s) |
Fórmula molecular |
Fórmula de Lewis |
Fórmula estrutural |
|---|---|---|---|
|
Flúor |
F2 |
|
F–F |
|
Bromo |
Br2 |
|
Br–Br |
|
Carbono e oxigênio |
CO2 |
|
O═C═O |
|
Enxofre e hidrogênio |
H2S |
|
|
|
Nitrogênio e hidrogênio |
NH3 |
|
|
|
Carbono e hidrogênio |
CH4 |
|
|
|
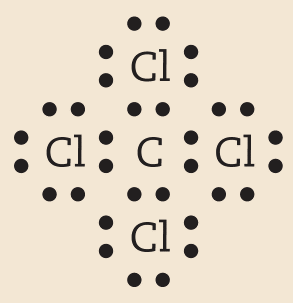
Carbono e cloro |
CCl4 |
|
|
Fontes: Zoomdal, S. S.; Zoomdal, S. A.; , D. J. Chemistry. décima edição Boston: Cengage, 2018. página 326, 328; bróun, T. L. êti áli. Chemistry: the central science. décima quinta edição Nova iórque: Pearson, 2022. página 379-380.
Respostas e comentários
Aprofundamento ao professor
Veja, na parte inicial dêste Manual do professor, na seção Aprofundamento ao professor, o texto “O que é grafeno?”.
Atividades
Os exercícios 22 a 34 do Use o que aprendeu são oportunos após o item 4.
5. Ligação metálica
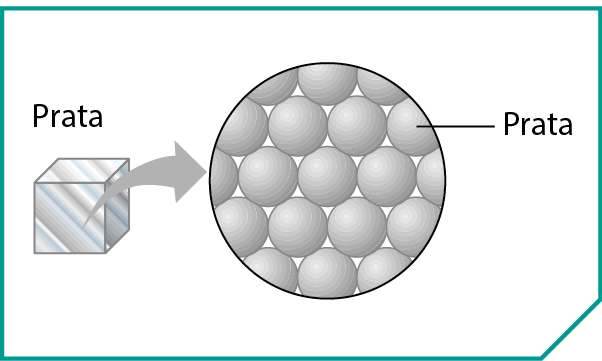
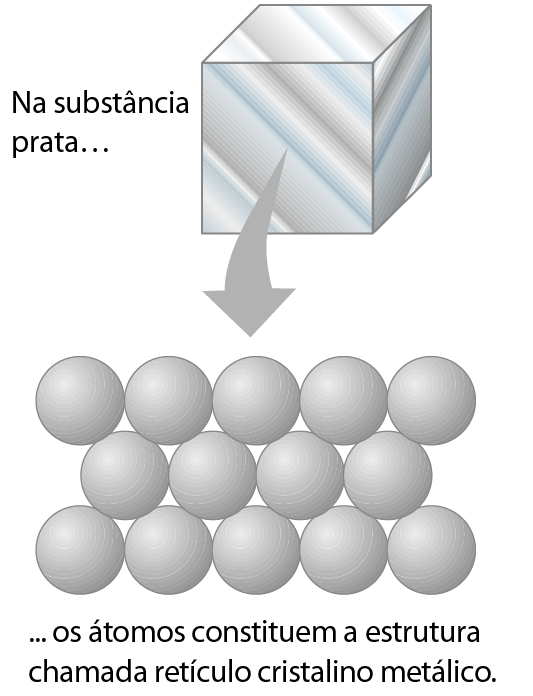
Consideremos uma amostra da substância simples prata, que é constituída de muitos átomos do elemento químico prata. Cada átomo está rodeado por outros átomos iguais a ele, em um arranjo regular denominado retículo cristalino metálico. A ligação entre átomos de metais é denominada ligação metálica, à qual não se aplica a regra do octeto.
Na estrutura da prata e dos demais metais, alguns dos elétrons não estão totalmente presos a um único átomo, apresentando a possibilidade de se moverem por toda a estrutura.
As substâncias metálicas (ou, simplesmente, metais) são úteis ao ser humano devido às suas propriedades, que, de modo bem genérico, estão listadas a seguir.
- Brilho característico. Quando polidos, os metais refletem muito bem a luz. Essa propriedade é fácil de ver em bandejas e em espelhos de prata.
- Alta condutividade térmica e elétrica. São propriedades que se devem aos elétrons livres. O movimento ordenado dos elétrons constitui a corrente elétrica, e sua agitação permite a rápida propagação do calor através das substâncias metálicas.
- Altas temperaturas de fusão e de ebulição. Em geral, são características dos metais (embora haja exceções, como mercúrio, têéfe = – 39 graus Célsius, gálio, tê éfe = 30 graus Célsius, e potássio, tê éfe = 64 graus Célsius). Devido a essa propriedade e também à boa condutividade térmica, alguns metais são usados em panelas e em radiadores de automóveis.
- Maleabilidade. Metais são muito maleáveis, ou seja, fáceis de serem transformados em lâminas. O metal mais maleável é o ouro, que permite a obtenção das lâminas mais finas.
- Ductilidade. Metais também são muito dúcteis, isto é, fáceis de serem transformados em fios. O ouro é também o mais dúctil dos metais, permitindo que dele se obtenham fios finíssimos.


EM DESTAQUE
Fios elétricos: uma aplicação de condutores e isolantes
Na instalação elétrica das residências são usados fios de cobre.
Como o cobre é um metal, tais fios são condutores elétricos.
Os plásticos usados para revestir os fios são substâncias moleculares e, portanto, não são condutores de corrente elétrica. São denominados isolantes elétricos. O papel desempenhado por esse revestimento plástico é justamente impedir que um fio toque outro ou que as pessoas encostem diretamente nos fios. Em ambos os casos, as consequências seriam perigosas (curto-circuito, choque elétrico).

Elaborado com dados obtidos de: , A. Physics. quinta edição Nova York: McGraw-Hill, 2020.
Respostas e comentários
Item 5
Ao trabalhar esse item, retome os conhecimentos pregressos (do 7º e do 8º anos) que os estudantes têm sobre o fato de os metais conduzirem bem calor e corrente elétrica (ê éfe zero sete cê ih zero três: “Utilizar o conhecimento das fórmas de propagação do calor para justificar a utilização de determinados materiais (condutores e isolantes) na vida cotidiana, explicar o princípio de funcionamento de alguns equipamentos (garrafa térmica, coletor solar etcétera) e/ou construir soluções tecnológicas a partir dêsse conhecimento.”; ê éfe zero oito cê ih zero dois: “Construir circuitos elétricos com pilha ou bateria, fios e lâmpada ou outros dispositivos e compará-los a circuitos elétricos residenciais.”).
Durante o desenvolvimento, saliente que a regra do octeto não propicia qualquer previsão ou explicação referente à ligação metálica.
Para explicar a ligação metálica, um modelo foi criado na primeira metade do século vinte e aprimorado subsequentemente por meio da Mecânica Quântica, o qual envolve a ideia de que alguns elétrons têm mobilidade pelo cristal metálico. Esse modelo possibilitou explicar qualitativamente propriedades como as altas condutividades elétrica e térmica, o brilho metálico e as elevadas maleabilidade e ductilidade (também grafada como ductibilidade).
Para o docente, transcrevemos a seguir dois trechos sôbre o surgimento do modelo para a ligação metálica.
“Uma teoria dos metais em que elétrons de valência são considerados como tendo livre movimentação sob influência do campo [elétrico] de íons foi desenvolvida pelo físico alemão [1853‑1928] e, em uma formulação quântica, pelo físico austríaco vôlfigan [1900‑1958].” (, L. General Chemistry. Nova iórque: Dover, 1970. página 588. Tradução dos autores.)
“Lorentz propôs uma teoria dos metais que explica de modo qualitativo algumas de suas propriedades características e que foi extensivamente desenvolvida reticências por meio da Mecânica Quântica. reticências Essa teoria de elétrons livres provê uma explicação simples do brilho e de outras propriedades ópticas dos metais, das altas condutividades elétricas e térmicas, das elevadas entropias e capacidades térmicas molares e de algumas outras propriedades.” (, L. The nature of chemical bonding. terceira edição Ithaca: Cornell University Press, 1960. página 393. Tradução dos autores.)
Atividades
Após trabalhar em aula o texto Em destaque “Ligas metálicas”, proponha aos estudantes a realização dos exercícios 35 a 42 da seção Use o que aprendeu.
De ôlho na Bê êne cê cê!
A foto da máscara mortuária do faraó egípcio, no item 5, contribui para o desenvolvimento da competência geral 3, por incentivar os estudantes a valorizar e fruir as diversas manifestações artísticas e culturais, das locais às mundiais.

EM DESTAQUE
Ligas metálicas
Ligas metálicas são misturas sólidas de dois ou mais elementos, sendo a totalidade, ou pelo menos a maior parte dos átomos nelas existentes, de elementos metálicos.
Ouro 18 quilates é uma liga de ouro e cobre (eventualmente contém também prata e outros metais) empregada pelos joalheiros.
Bronze é uma liga de cobre e estanho. É empregado na fabricação de sinos, estátuas, medalhas e monumentos.
Latão é uma liga de cobre e zinco. Serve para produzir torneiras, instrumentos musicais, porcas e parafusos.
Aço é uma liga de ferro com pequena quantidade de carbono. Trata-se da liga metálica mais usada pela nossa civilização, encontrando aplicação na produção de automóveis, navios, ferramentas, trilhos de trem, pregos e parafusos, latas para alimentos, arames, cabos para elevadores etcétera



Elaborado com dados obtidos de: guílbert, T. R. êti áli. Chemistry: an atoms-focused approach. terceira edição Nova iórque: nórton, 2020.
6. Comparação entre os tipos de substâncias
Substâncias iônicas
As substâncias iônicas têm geralmente átomos de metal e não metal em sua composição. São constituídas por íons que se unem por ligação iônica formando o retículo cristalino iônico. Apresentam altas temperaturas de fusão e de ebulição, por causa da forte atração entre os íons vizinhos de cargas opostas, e tendem a ser sólidas nas condições ambientes. São exemplos de substâncias iônicas:
- cloreto de sódio, êne á cê éle, formado pelos íons êne ámais e cê éle–;
- brometo de potássio, , formado pelos íons cá+ e bêérre–;
- cloreto de magnésio, , formado pelos íons ême gê2+ e cê éle–;
- óxido de alumínio, a éleóh, formado pelos íons a éle3+ e óh2–.

ATIVIDADE
Tema para pesquisa
Pesquise eventos relevantes na história da Química e elabore uma linha do tempo indicando-os.
A critério do professor, pode-se construir uma grande linha do tempo colaborativa em uma parede da escola, reunindo as contribuições de todos.
Qual a proporção entre mulheres e homens cientistas envolvidos nesses eventos? O que isso indica? Como mudar essa realidade?
Substâncias moleculares
As substâncias moleculares têm em sua composição átomos de um ou mais não metais. São formadas por moléculas, nas quais os átomos se unem por ligações covalentes. Apresentam temperaturas de fusão e de ebulição relativamente baixas.
Respostas e comentários
tê cê tê Ciência e Tecnologia
Os textos Em destaque dêste capítulo são pertinentes ao tê cê tê Ciência e Tecnologia, pois exploram aplicações cotidianas e comerciais de diversas substâncias, cuja utilização para diferentes finalidades relaciona-se a suas propriedades e, em última análise, a sua composição e ao tipo de ligação química presente.
Item 6
Nesse item, retome as ideias apresentadas sôbre ligações iônicas, covalentes e metálicas e compare as propriedades das substâncias iônicas, moleculares e metálicas conforme apresentado no livro do estudante.
História da Ciência
O Tema para pesquisa do item 6 propõe a elaboração de uma linha do tempo a partir da pesquisa de eventos importantes para a história da Química. O ideal nessa atividade é permitir aos estudantes que busquem informações que considerem importantes e curiosas, para que se sintam estimulados pela atividade e para que ela gere, em seguida, interação entre eles para um debate.
Após a pesquisa e a elaboração da linha do tempo, estimule toda a turma a analisar qual a proporção entre mulheres e homens cientistas envolvidos nos eventos pesquisados. Em seguida, peça a contribuição dos estudantes para responder às perguntas: O que essa proporção indica? Atualmente essa proporção é diferente? Se sim, quão diferente é? Como mudar essa realidade?
A intenção é, além de promover a aprendizagem sôbre História da Ciência, estimular a análise da nossa sociedade quanto ao papel de mulheres e de homens na Ciência e na comunidade de fórma geral. Já existiu igualdade entre mulheres e homens na sociedade? E na Ciência? E hoje, existe?
É importante que os próprios estudantes possam debater e procurar informações para constatar que não existe igualdade entre os dois grupos e que é de extrema importância desenvolver mecanismos para favorecer a participação das mulheres na Ciência. A sociedade deve se mobilizar no sentido de propiciar a equidade e valorizar o protagonismo da mulher em todos os setores profissionais, culturais, artísticos e sociais.
Exemplos:
- cloreto de hidrogênio, , formado por moléculas nas quais há 1 átomo de hidrogênio e 1 de cloro;
- gás cloro, cê éle, formado por moléculas em que existem 2 átomos de cloro;
- água, agáóh, formada por moléculas nas quais há 2 átomos de hidrogênio e 1 de oxigênio;
- sacarose, cêagáóh, formada por moléculas com 12 átomos de carbono, 22 de hidrogênio e 11 de oxigênio.
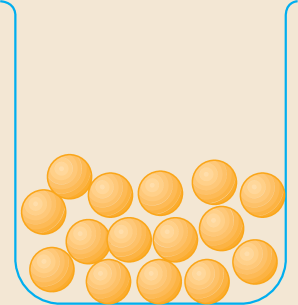
As substâncias moleculares podem ser sólidas, líquidas ou gasosas nas condições ambientes. Em uma substância gasosa, as moléculas estão fracamente unidas umas às outras. Em um líquido, elas estão fortemente unidas e, em um sólido, mais unidas ainda.

Use a internet
Monte modelos moleculares com a simulação disponível em: https://oeds.link/oeY91O Acesso em: 8 junho 2022.
Nos modelos mostrados na tabela, as moléculas estão representadas por esferas em cor fantasiosa, ampliadas alguns milhões de vezes.
|
Gás |
Líquido |
Sólido |
|
|---|---|---|---|
|
Propriedades macroscópicas |
Volume variável |
Volume fixo |
Volume fixo |
|
Modelo em nível molecular |
|
|
|
|
Atração que mantém as moléculas unidas |
Muitíssimo fraca |
Forte |
Mais forte que no líquido |
|
Espaço entre as moléculas |
Muito grande (centenas de vezes maior que no líquido) |
Pequeno |
Menor que no líquido |
|
Organização das moléculas |
Total desordem, com as moléculas se movimentando muito rapidamente |
Moléculas livres para se movimentarem, mas sob influência das vizinhas |
Moléculas em um arranjo organizado, mas oscilando (vibrando) ao redor de suas posições |
Fonte: , N. J. Principles of Chemistry; a molecular approach. quarta edição Harlow: Pearson, 2021. página 48, 539.

ATIVIDADE
Amplie o vocabulário!
Hora de debater o significado de cada conceito, redigi-lo com nossas palavras e incluí-lo no nosso blog.
• ligação iônica
• ligação covalente
• ligação metálica
Substâncias metálicas
As substâncias metálicas apresentam átomos de metal em sua composição, unidos por ligação metálica. Elas têm, em geral, altas temperaturas de fusão e de ebulição, sendo sólidas nas condições ambientes. Notável exceção é o mercúrio, que é líquido.
São exemplos de substâncias metálicas:
- zinco, , formado por muitos átomos de ;
- ferro, éfe ê, formado por muitos átomos de éfe ê;
- prata, á gê, formada por muitos átomos de á gê;
- ouro, á ú, formado por muitos átomos de á ú.
Respostas e comentários
De ôlho na Bê êne cê cê!
• ê éfe zero nove cê ih zero um
“Investigar as mudanças de estado físico da matéria e explicar essas transformações com base no modelo de constituição submicroscópica.”
No capítulo 1, os estudantes tomaram contato com as mudanças de fase (mudanças de estado de agregação da matéria) e seus nomes. Também aprenderam que, a determinada pressão fixa, a temperatura permanece constante quando uma substância pura muda de fase, o que implica que as temperaturas de fusão e de ebulição são propriedades características das substâncias químicas.
Neste ponto do capítulo 4, os estudantes passam a ser capazes de explicar as mudanças de fase com base em modelos de constituição submicroscópica da matéria. As atividades do Explore diferentes linguagens envolvem a utilização dêsses modelos.
Também neste capítulo, a utilização dêsses modelos, juntamente com as noções adquiridas sôbre ligações químicas, possibilita que os estudantes prevejam a condutividade elétrica, ou não, de substâncias iônicas, moleculares e metálicas, em diferentes fases (item 6 e atividades 45 a 48 do Use o que aprendeu).
Amplie o vocabulário!
Redações possíveis, considerando o nível de compreensão atual dos estudantes:
- ligação iônica União química entre cátions e ânions. Está presente nas chamadas substâncias iônicas.
- ligação covalente União química entre átomos que compartilham elétrons. É ela que mantém os átomos unidos em substâncias moleculares (isto é, constituídas de moléculas).
- ligação metálica União química entre átomos de um ou mais elementos metálicos, da qual resulta uma estrutura em que há elétrons com livre movimentação. Está presente em substâncias metálicas.
Use a internet
A atividade proposta nesse boxe pretende que os estudantes utilizem um simulador para produzir modelos de moléculas que sejam constituídas de diversos elementos químicos. A atividade pode ser feita com direcionamento do programa sôbre quais substâncias devem ter seus modelos construídos (nos modos sozinha e várias) ou de maneira livre, em que os estudantes escolhem que modelos vão construir a partir de alguns elementos disponibilizados ao mesmo tempo ao usuário (modo diversão). Nos modos sozinha e várias, após montar cada modelo, este deve ser arrastado para o respectivo local na região direita da tela. Após completar todos os modelos solicitados, o estudante será conduzido para um novo nível, mais elaborado. Esse simulador é bastante útil para que os estudantes possam, de maneira prática, entender melhor o conceito de molécula, que é abstrato por se referir a entidades não visíveis macroscopicamente.
De ôlho na Bê êne cê cê!
O uso pelos estudantes do simulador sugerido no boxe Use a internet, que permite construir modelos moleculares, possibilita o desenvolvimento da competência geral 5, pois estimula compreender e utilizar tecnologias digitais de fórma crítica e significativa para produzir conhecimentos, e da competência específica 6, posto que solicita utilizar tecnologia digital para produzir conhecimentos e resolver problemas das Ciências da Natureza de fórma crítica e significativa.
Explicação para a condutividade elétrica
Após estudar as ligações iônica, covalente e metálica, é importante que você tenha uma visão geral a respeito de algumas propriedades das substâncias que estão resumidas na tabela a seguir.
|
Substância |
Temperaturas de fusão e de ebulição geralmente |
Fase em que geralmente se encontra nas condições ambientes |
Conduz corrente elétrica em |
|
|---|---|---|---|---|
|
fase sólida? |
fase líquida? |
|||
|
Iônica |
Altas |
Sólida |
Não |
Sim |
|
Molecular |
Baixas |
Sólida, líquida ou gasosa |
Não |
Não |
|
Metálica |
Altas |
Sólida* |
Sim |
Sim |
* Exceção relevante é o mercúrio (Hg), que é líquido.
Fonte: Elaborada a partir de dados de , N. J. Principles of Chemistry; a molecular approach. quarta edição Harlow: Pearson, 2021. página 444, 594-598.
Vamos, agora, explicar a diferença no comportamento dêsses três tipos de substâncias quanto à condutividade elétrica. Para isso, vamos empregar as seguintes ideias que já foram comentadas:
- substâncias iônicas são constituídas por íons (cátions e ânions) em retículos cristalinos iônicos;
- substâncias moleculares são constituídas por moléculas;
- substâncias metálicas são constituídas de átomos de elementos do tipo metal unidos por ligação metálica; alguns dos elétrons dêsses átomos têm liberdade para se movimentar através de toda a amostra (pedaço, peça, objeto) dessa substância;
- corrente elétrica é uma movimentação ordenada de cargas elétricas através de uma determinada substância ou de um determinado material.
As substâncias metálicas conduzem corrente elétrica em fase sólida devido aos elétrons livres (veja o esquema A). Quando essas substâncias passam para a fase líquida (isto é, são fundidas, derretidas, sofrem fusão), os elétrons continuam livres e a condutividade elétrica se mantém.
Moléculas não possuem carga elétrica, ou seja, são eletricamente neutras. Assim, as substâncias moleculares não apresentam cargas livres e, portanto, são incapazes de conduzir corrente elétrica.
Íons são entidades possuidoras de carga elétrica, isto é, não são eletricamente neutros. Uma substância iônica pode conduzir eletricidade em fase líquida, pois, nessas circunstâncias, os íons que a constituem não estão presos em um retículo cristalino, mas livres para se movimentar (esquema B).
Em fase sólida, ao contrário, as substâncias iônicas não conduzem a corrente elétrica, porque os íons não têm mobilidade através do retículo cristalino iônico (esquema C).
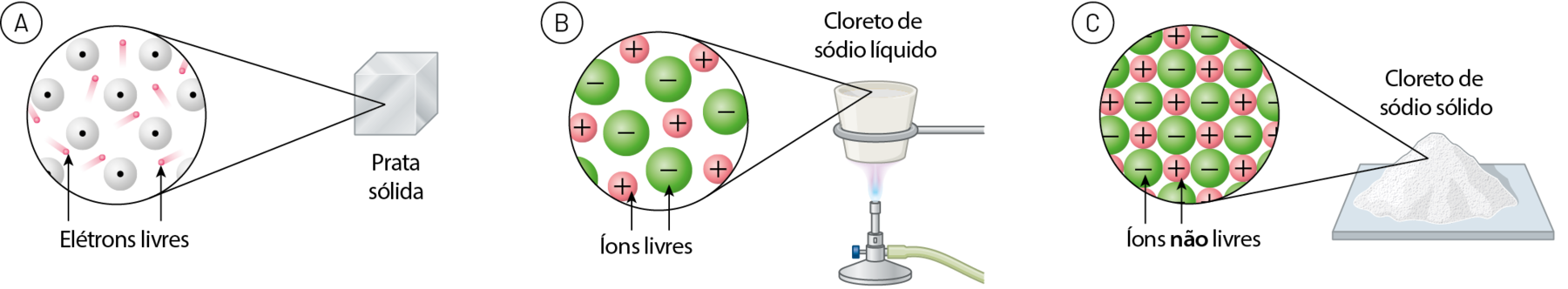
Fonte: , N. J. Principles of Chemistry; a molecular approach. quarta edição Harlow: Pearson, 2021. página 444, 597.
Respostas e comentários
Atividades
Ao final do subitem Explicação para a condutividade elétrica, proponha aos estudantes os exercícios 43 a 48 do Use o que aprendeu e também as atividades 1 a 3 do Explore diferentes linguagens.
Atente!
Uma situação problemática diz respeito à condutividade elétrica da água. Quando um químico diz que, nas condições ambientes, a água pura (composto molecular) “não conduz corrente elétrica”, ele está afirmando que ela apresenta uma condutividade elétrica extremamente baixa.
De fato, a água destilada contém pequenas concentrações de íons agáóhmais e ó agá, provenientes da autoionização da água, responsáveis por uma condutividade elétrica muitíssimo reduzida, mas de mensuração possível desde que se disponha de equipamento adequado.
A condutividade elétrica da água pura ou de uma solução aquosa de um não eletrólito (sacarose, por exemplo) é muitíssimo baixa se comparada à de uma solução iônica. Apenas para efeito de comparação, considere os seguintes dados: a condutividade elétrica da água pura (a 25 graus Célsius) é 5,50 por ⁻⁸ ômega⁻¹ por centímetro⁻¹, e a condutividade de uma solução aquosa 0,1 de êne á cê éle (a 25 graus Célsius) é 10,67 ômega⁻¹ por centímetro⁻¹. Nesse exemplo, a solução do eletrólito salino, o éle, tem condutividade elétrica 194 milhões de vezes maior que a da água destilada!
Porém, atenção: a água presente em nosso dia a dia não é pura. A água da torneira, por exemplo, contém várias substâncias dissolvidas, principalmente sais minerais. Muitas dessas substâncias são iônicas e, dissolvidas em água, têm seus íons dissociados. Assim, a água da torneira é condutora de corrente elétrica.
Muito cuidado deve ser tomado para que esse líquido não tome contato com fios elétricos desencapados nem caia dentro de aparelhos eletrônicos. No caso de a água tomar contato com componentes elétricos dêsses aparelhos, pode causar danos a eles e, muito mais sério, colocar o usuário em risco de eletrocussão e morte.

EM DESTAQUE
Substâncias são constituídas de elementos
Todas as substâncias têm átomos em sua composição. E cada átomo, de acordo com seu número atômico (número de prótons no núcleo), é de determinado elemento químico.
Assim, tudo de material que existe é formado por átomos de elementos químicos, que, consequentemente, têm presença marcante em nossa vida, na tecnologia e na produção industrial.
O texto e as ilustrações desta seção mostram um pequeno resumo da importância dos elementos. Cada item listado pode ser uma aplicação, utilidade, ocorrência ou característica de:
- substância simples;
- substância composta ou íon constituído do elemento;
- mistura em que um dos componentes contenha o elemento.
Fontes dos dados compilados: Djéksôn, T. The periodic table book: a visual encyclopedia of the elements. : Dorling Kindersley, ; Gardner, djêi Understanding the periodic table: theChemistryof everyday elements. Broomall: Mason Crest, 2018; , C. J.; , V. V.; , G. S. (edição). 150 years of the periodic table. Cham: Springer, 2021; , W. Chemical elements in life. Hackensack: World Scientific, 2021.

Respostas e comentários
Interdisciplinaridade
Se considerar oportuno, converse com o colega de Arte para, juntos, realizarem um trabalho interdisciplinar no qual os estudantes explorem a ocorrência e as aplicações dos diversos elementos químicos. Mediante a divisão dos estudantes em equipes, cada uma ficando incumbida de elaborar um infográfico acerca dos elementos químicos e suas características.
Muitas possibilidades podem ser exploradas. Apenas exemplificando, pode-se sugerir: a abundância dêsses elementos no organismo humano, na água do mar, na crosta terrestre e no Universo; as diferentes aplicações (associadas a dados econômicos); e a toxicidade de alguns deles (atrelada a representações das partes do corpo humano e/ou do ambiente que podem contaminar e prejudicar).
Se for possível, reserve um tempo em aula para que os estudantes realizem pesquisas na internet (usando celular, táblet ou computador) para buscar novas imagens e outros dados sôbre o tema.
Estimule-os também a pesquisar na biblioteca da escola, caso haja referências disponíveis que contemplem o tema.
Com o material coletado pelos estudantes, as equipes devem elaborar o infográfico.
As produções podem ser expostas na escola, a fim de que sejam fruídas por toda a comunidade escolar. Além disso, os infográficos podem ser publicados no blog das diversas equipes.
Essas produções também podem ser usadas como parte integrante da avaliação.
Se houver professor de Informática, considere a possibilidade de convidá-lo para se integrar à atividade.
Nesse caso, podem ser exploradas técnicas de programação em (ou outras tecnologias que o docente considerar oportunas) para criar infográficos digitais que sejam interativos.
Turmas numerosas
A produção coletiva de infográficos propicia uma vivência em que os estudantes podem cooperar e se complementar com suas diversas qualidades, aprendendo uns com os outros. As diversidades individuais são enriquecedoras e propiciam aos estudantes aprender também com base na interação com os demais integrantes da equipe. Procure contemplar a diversidade e a complementaridade na composição das equipes, que não precisam ser as mesmas que mantêm os blogs de Ciências.
As produções podem, ainda assim, ser postadas nos blogs, pois cada estudante pode inserir a produção da qual participou no blog para o qual contribui, independentemente de haver repetição de postagens dos infográficos nos diferentes blogs. Saliente aos estudantes que os blogs são ferramentas de divulgação do conhecimento científico e quanto mais visibilidade as produções da turma tiverem, melhor para a comunidade como um todo.

Respostas e comentários
De ôlho na Bê êne cê cê!
A atividade proposta de produção artística de infografias, interdisciplinar com Arte, vai ao encontro do desenvolvimento da competência geral 3, posto que constitui estímulo a valorizar e fruir as diversas manifestações artísticas e culturais e também participar de práticas diversificadas da produção artístico-cultural. Também oportuniza o desenvolvimento da competência geral 4, na medida em que propõe utilizar conhecimentos da linguagem artística para se expressar e partilhar informações, experiências, ideias e sentimentos em diferentes contextos.
A atividade pode abranger diversas técnicas e ir ao encontro de algumas das habilidades de Arte, como a ê éfe seis nove á érre zero seis (“Desenvolver processos de criação em artes visuais, com base em temas ou interêssis artísticos, de modo individual, coletivo e colaborativo, fazendo uso de materiais, instrumentos e recursos convencionais, alternativos e digitais.”).
Outras duas habilidades de Arte potencializadas pela atividade são a ê éfe seis nove á érre zero sete (“Dialogar com princípios conceituais, proposições temáticas, repertórios imagéticos e processos de criação nas suas produções visuais.”) e a ê éfe seis nove á érre três um (“Relacionar as práticas artísticas às diferentes dimensões da vida social, cultural, política, histórica, econômica, estética e ética.”).
A inclusão da Informática na atividade propicia desenvolver também a competência geral 5, pois envolve compreender, utilizar e criar tecnologias digitais de informação e comunicação de fórma crítica, significativa, reflexiva e ética nas diversas práticas sociais (incluindo as escolares) para se comunicar, acessar e disseminar informações, produzir conhecimentos, resolver problemas e exercer protagonismo e autoria na vida pessoal e coletiva.
Propicia ainda o desenvolvimento da competência específica 6, posto que solicita utilizar diferentes linguagens e tecnologias digitais de informação e comunicação para se comunicar, acessar e disseminar informações, produzir conhecimentos e resolver problemas das Ciências da Natureza de fórma crítica, significativa, reflexiva e ética.
Organização de ideias
MAPA CONCEITUAL
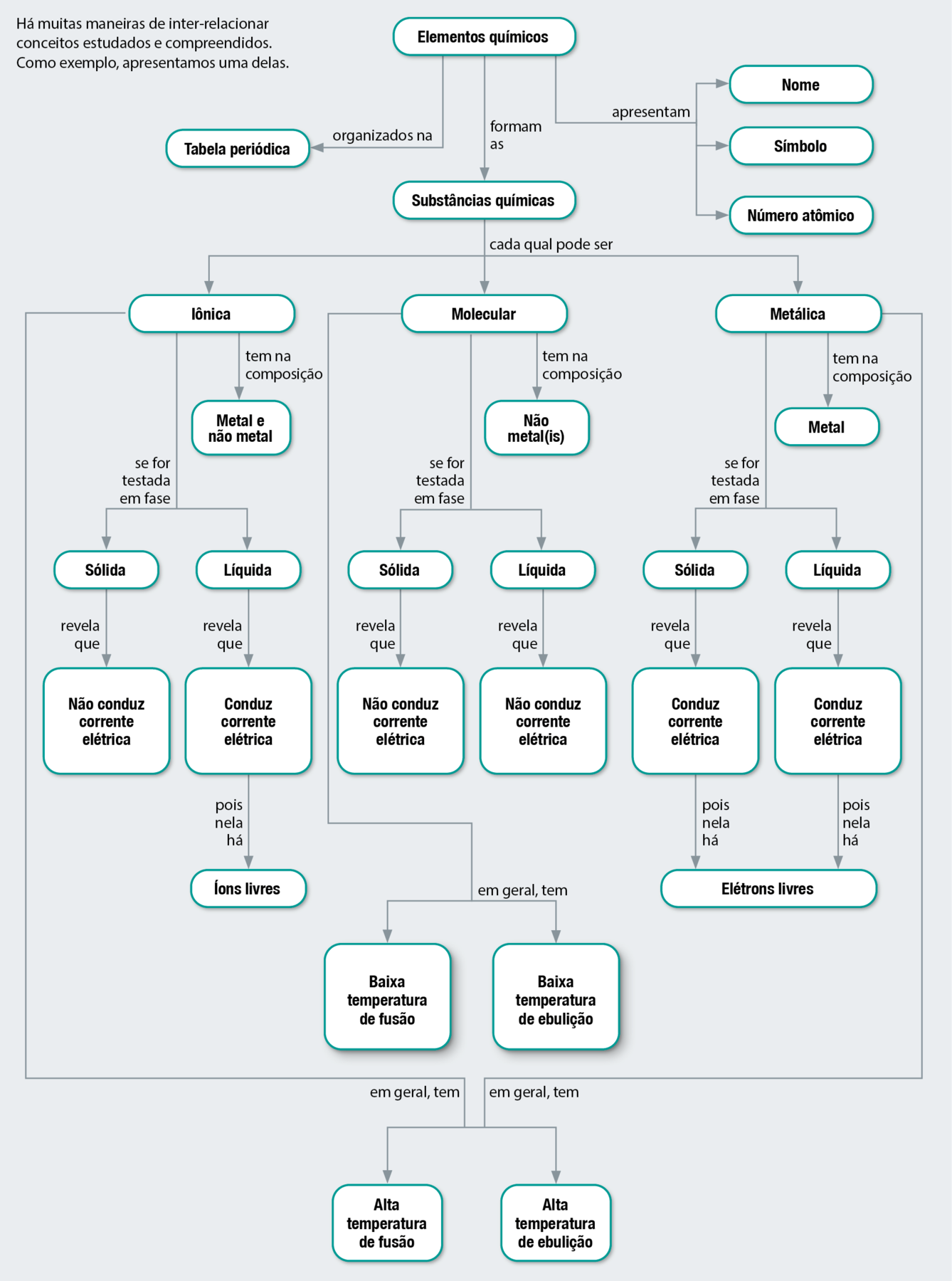

Atividades
Use o que aprendeu
1. Existem seis substâncias na natureza formadas por átomos não ligados a outros.
Quais são essas substâncias?
- As eletrosferas de alguns elementos químicos são consideradas modelos de estabilidade. Que elementos são esses?
- As ligações químicas interatômicas são as uniões que mantêm os átomos coesos formando as substâncias.
- O estabelecimento dessas ligações envolve que parte da eletrosfera?
- Como essa parte é denominada?
- A regra do octeto é empregada (em casos relativamente simples) para realizar determinada previsão. O que diz essa regra e como ela possibilita fazer a previsão?
- O cloreto de sódio (êne á cê éle) é uma substância iônica, a sacarose () é uma substância molecular e a prata (á gê) é uma substância metálica. Que tipo de ligação química existe em cada uma delas?
- A cal viva é um material muito usado por pedreiros, pintores e agricultores. Ela pode ser representada pela fórmula cê a ó.
- Essa substância é simples ou composta? Justifique.
- Em que grupos da tabela periódica estão os elementos que a compõem?
- Que tipo de ligação química existe na cal viva?
- Justifique sua resposta à pergunta anterior, comparando os elementos que formam a cal viva com os gases nobres dos quais eles mais se aproximam em número de elétrons.
- Consulte, na tabela periódica, os números atômicos dos seguintes elementos e localize o gás nobre mais próximo de cada um. Com base nessas informações, responda: qual é a carga que seus átomos terão ao se transformarem em íons e estabelecerem ligação iônica?
- cá
- Bê érre
- Cê a
- cê éle
- êne á
- ésse
- ême gê
- óh
- Consulte os dados necessários no item 6 do capítulo 3 e, a seguir, escreva a distribuição eletrônica nas camadas para os elementos:
- cá
- Bê érre
- Cê a
- cê éle
- êne á
- ésse
- ême gê
- óh
- Fundamentado nas respostas da questão anterior, elabore a distribuição eletrônica nas camadas dos íons estáveis formados pelos seguintes elementos:
- cá
- Bê érre
- Cê a
- cê éle
- êne á
- ésse
- ême gê
- óh
- Os pares de elementos representados por seus símbolos unem-se por ligação iônica. Usando suas respostas às questões 7 e 9, preveja, em cada caso, a fórmula do composto formado.
- cá e Bê érre
- Cê a e cê éle
- êne á e ésse
- ême gê e óh
- Faça a previsão da fórmula do composto no qual há íons:
a.
L i mais e F menosb.
B a dois mais e C l menosc.
A l três mais e S dois menosd.
S r dois mais e O dois menose.
C s mais e C l menosf.
K mais e O 2 menos- Preveja a fórmula de um composto iônico formado por um metal A, do grupo 1 da tabela periódica, e um não metal B, do grupo 16. (Em enunciados como este, as letras são símbolos de elementos hipotéticos.)
- Um metal alcalinoterroso X combina-se com um halogênio Y. Deduza a fórmula do composto formado e indique o tipo de ligação química nele existente.
- Considere o composto iônico de fórmula QR, no qual os cátions de Q e os ânions de R obedecem à regra do octeto. Responda e justifique.
- Q pode ser alcalino e R halogênio?
- Q pode ser alcalino e R calcogênio?
- Q pode ser alcalinoterroso e R halogênio?
- Q pode ser alcalinoterroso e R calcogênio?
- Q pode ser do grupo 13 e R do grupo 17?
Respostas e comentários
Respostas do Use o que aprendeu
1. Os gases nobres existentes na natureza: hélio (agá ê), neônio (êne ê), argônio (á érre), criptônio (), xenônio (xis ê) e radônio (). (O oganessônio, Z = 118, é artificial; não existe na natureza e, por isso, não foi incluído na resposta.)
2. Os gases nobres.
3. a) A última camada (camada mais externa).
b) Camada de valência.
4. Um átomo tem eletrosfera estável quando sua última camada possui 8 elétrons (ou 2, caso se trate da camada K). Para saber se a eletrosfera está estável, devemos consultar a distribuição eletrônica do átomo e verificar se o número de elétrons na última camada está de com a regra do octeto.
5. No éle, há ligação iônica, na cêagáóh, há ligação covalente, e, na á gê, ligação metálica.
6. a) Substância composta, pois é constituída de dois elementos químicos distintos, o cálcio e o oxigênio.
b) O cálcio está no grupo 2, e o oxigênio, no 16.
c) Ligação iônica.
d) Um átomo neutro de cálcio tem 20 elétrons. Ele mais se aproxima do argônio, que tem 18 elétrons. Assim, o cálcio tende a perder 2 elétrons, transformando-se no íon
C a 2 mais.
A cal viva é uma substância iônica, em que há íons
C a 2 maise
O 2 menos.
7. a)
K mais(1 elétron é perdido para ficar com eletrosfera similar à do á érre).
b)
B r menos(1 elétron é ganho para ficar com eletrosfera similar à do ).
c)
C a dois mais(2 elétrons são perdidos para ficar com eletrosfera similar à do á érre).
d)
C l menos(1 elétron é ganho para ficar com eletrosfera similar à do á érre).
e)
N a mais(1 elétron é perdido para ficar com eletrosfera similar à do êne ê).
f)
S dois menos(2 elétrons são ganhos para ficar com eletrosfera similar à do á érre).
g)
M g dois mais(2 elétrons são perdidos para ficar com eletrosfera similar à do êne ê).
h)
O 2 menos(2 elétrons são ganhos para ficar com eletrosfera similar à do êne ê).
8. a) : K – 2, L – 8, M – 8, N – 1.
b) : K – 2, L – 8, M – 18, N – 7.
c) Cê a: K – 2, L – 8, M – 8, N – 2.
d) cê éle: K – 2, L – 8, M – 7.
e) êne á: K – 2, L – 8, M – 1.
f) ésse minúsculo: K – 2, L – 8, M – 6.
g) : K – 2, L – 8, M – 2.
h) : K – 2, L – 6.
9. a)
K. Subscrito à esquerda: dezenove. Sobrescrito à direita: mais.:
K – 2, L – 8, M – 8.
b)
B r. Subscrito à esquerda: trinta e cinco. Sobrescrito à direita: menos.:
K – 2, L – 8, M – 18, N – 8.
c)
C a. Subscrito à esquerda: 20. Sobrescrito à direita: dois mais.:
K – 2, L – 8, M – 8.
d)
Cl. Subscrito à esquerda: 17. Sobrescrito à direita: menos.:
K – 2, L – 8, M – 8.
e)
N a. Subscrito à esquerda: 11. Sobrescrito à direita: mais.:
K – 2, L – 8.
f)
S. Subscrito à esquerda: 16. Sobrescrito à direita: dois menos.:
K – 2, L – 8, M – 8.
g)
M g. Subscrito à esquerda: doze. Sobrescrito à direita: dois mais.:
K – 2, L – 8.
h)
O. Subscrito à esquerda: oito. Sobrescrito à direita: dois menos.:
K – 2, L – 8.
10. a)
b) Cê aCl₂
c) êne áésse
d) ême gê ó
11. a) éle iF
b) bê áCl₂
c) aéleésse
d) ésse érre ó
e) éle
f) cáóh
12. • O metal A (grupo 1) fórma cátion
A mais sobrescrito.
• O não metal B (grupo 16) fórma ânion
B dois menos sobrescrito.
Assim:
séta para ábit
13. • O metal X (grupo 2) fórma cátion
X dois mais sobrescrito.
• O halogênio Y (grupo 17) fórma ânion
Y menos sobrescrito..
Assim:
séta para
A ligação entre X e Y é iônica.
14. A fórmula QR só é possível se o cátion e o ânion apresentarem cargas elétricas iguais (em módulo).
a) Sim, porque
Q mais sobrescrito.e
R menos sobrescrito.constituem quê érre.
b) Não, porque
Q mais sobrescrito.e
R dois menos sobrescrito.constituiriam érre minúsculo.
c) Não, porque
Q dois mais sobrescrito.e
R menos sobrescrito.constituiriam .
d) Sim, porque
Q dois mais sobrescrito.e
R dois menos sobrescrito.constituem quê érre.
e) Não, porque
Q três mais sobrescrito.e
R menos sobrescrito.constituiriam quê érre.
15. O principal constituinte do rubi e da safira é uma substância incolor denominada óxido de alumínio, composta dos elementos alumínio e oxigênio. (A cor vermelha do rubi e a cor azul da safira se devem a pequenas quantidades de outras substâncias.)
Deduza a fórmula do óxido de alumínio.

16. O elemento químico flúor é extraído de um mineral denominado fluorita, que consiste principalmente de fluoreto de cálcio, cuja fórmula é Cê aF₂.
Consultando a tabela periódica, determine se as eletrosferas do cálcio e do flúor estão com o octeto completo nessa substância.

17. Denomina-se valência de um íon o valor de sua carga, desconsiderando o sinal. Assim, por exemplo, a valência do
N a mais. é 1 e a do O 2 menos é 2. Sabendo disso, determine a valência dos íons da questão 9.- Considere as seguintes definições:
- íon monovalente é o que tem valência 1;
- íon bivalente é o que tem valência 2;
- íon trivalente é o que tem valência 3.
Fundamentado nelas, classifique os íons constituintes da substância:
- óxido de alumínio (da questão 15);
- fluoreto de cálcio (da questão 16).
- Preveja a fórmula de um composto iônico constituído de ânions monovalentes de um elemento Z e cátions trivalentes de um elemento Y.
- Analise o esquema referente à formação de um ânion a partir do átomo neutro:
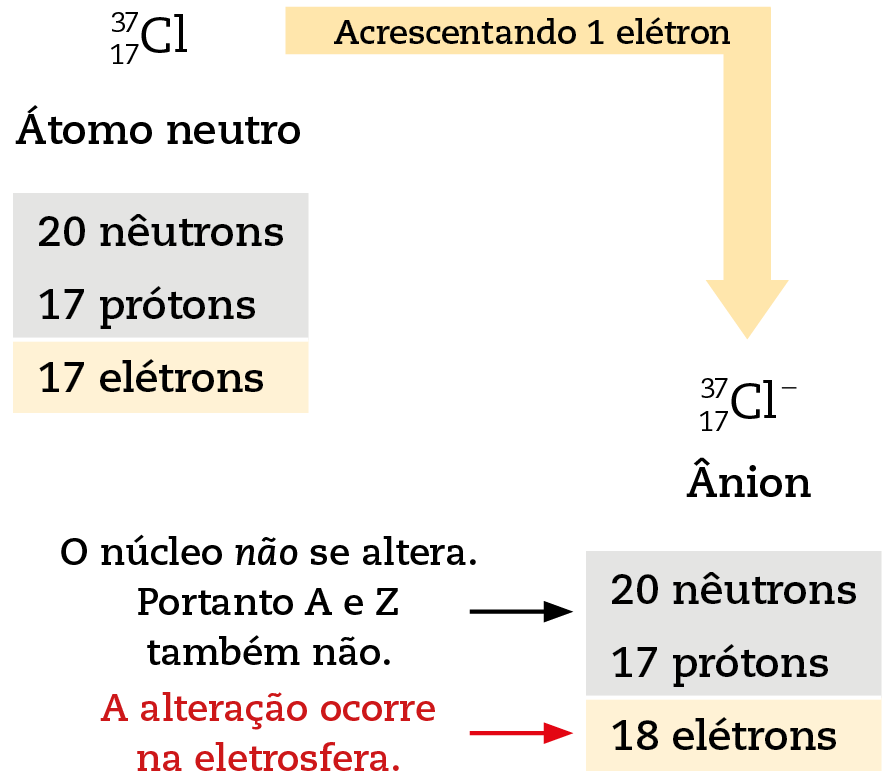
Inspirado nele, determine quantos prótons, nêutrons e elétrons existem num ânion:
a.
F. Sobrescrito à esquerda: 19; subscrito à esquerda: 9. Sobrescrito à direita: menosb.
S. Sobrescrito à esquerda: 32; subscrito à esquerda: 16. Sobrescrito à direita: 2 menosc.
P. Sobrescrito à esquerda: 32; subscrito à esquerda: 15. Sobrescrito à direita: 3 menos21. Analise o esquema referente à formação de um cátion a partir do átomo neutro:

Inspirado nele, determine quantos prótons, nêutrons e elétrons existem num cátion:
a.
K. Sobrescrito à esquerda: 39; subscrito à esquerda: 19. Sobrescrito à direita: maisb.
M g. Sobrescrito à esquerda: 24; subscrito à esquerda: 12. Sobrescrito à direita: 2 mais.c.
A l. Sobrescrito à esquerda: 27; subscrito à esquerda: 13. Sobrescrito à direita: 3 mais.Respostas e comentários
15.
Abre parêntesis A l, 3 mais sobrescrito, fecha parêntesis 2 subscrito; abre parêntesis O, 2 menos sobrescrito, fecha parêntesis 3 subscrito; implicaséta para
16. O cálcio (grupo 2) tem 2 elétrons de valência. Perdendo os 2 elétrons, passa a ter octeto completo.
O flúor (grupo 17) tem 7 elétrons de valência. Ao receber mais 1 elétron, fica com o octeto completo.
Os íons
C a 2 maise
F menos.têm o octeto completo.
17. a) 1; b) 1; c) 2; d) 1; e) 1; f) 2; g) 2; h) 2.
18. a)
A l 3 mais.é trivalente;
O 2 menos.é bivalente.
b)
C a 2 maisé bivalente;
F menos.é monovalente.
19.
abre parêntesis Y, 3 mais sobrescrito, fecha parêntesis 1 subscrito; abre parêntesis Z, menos sobrescrito, fecha parêntesis 3 subscrito; implica queséta para
20. Prótons, nêutrons e elétrons, nessa ordem:
a) 9, 10 e 10.
b) 16, 16 e 18.
c) 15, 17 e 18.
21. Prótons, nêutrons e elétrons, nessa ordem:
a) 19, 20 e 18.
b) 12, 12 e 10.
c) 13, 14 e 10.
- Consulte, na tabela periódica, os números atômicos dos seguintes elementos e localize o gás nobre mais próximo de cada um. Com base nessas informações, responda: quantas ligações covalentes cada um deles deve estabelecer?
- éfe
- cê éle
- Bê érre
- óh
- ésse
- êne
- pê
- cê
- agá
- á érre
- á ésse
- agá ê
- Consulte os dados necessários no item 6 do capítulo 3 e, a seguir, escreva a distribuição eletrônica nas camadas para os elementos:
- éfe
- cê éle
- Bê érre
- óh
- ésse
- êne
- pê
- cê
- agá
- á érre
- á ésse
- agá ê
- Analise o número de elétrons na camada de valência de cada um dos elementos da questão anterior e preveja quantas ligações covalentes cada um deles deve estabelecer. Sua previsão está de acôrdo com a resposta que você deu à questão 22?
- Represente a fórmula eletrônica (também denominada fórmula de LIUÍS) de cada uma das substâncias cuja fórmula molecular aparece a seguir. Lembre-se de que a tabela periódica é um instrumento de consulta.
- agáésse
- êne agá
- óh
- êne
- agá í
- ésse ÍH₄
- pê agá
- cê éfe
- cê ó
- Represente a fórmula estrutural das substâncias da questão anterior.
- A seguir, é mostrada a fórmula estrutural do ácido acético, substância que dá odor e sabor ao vinagre.
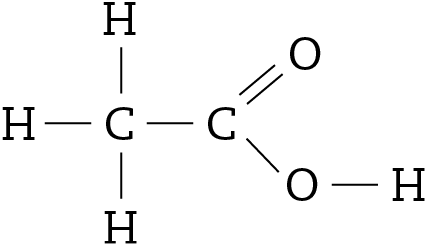
- O que significa cada traço presente nessa fórmula estrutural?
- Qual é a fórmula molecular do ácido acético?
28. A água oxigenada, usada para desinfetar esfolados, é uma solução aquosa de peróxido de hidrogênio, substância cuja fórmula eletrônica é a seguinte:

- Verifique se a eletrosfera dos átomos está estável.
- Elabore a fórmula estrutural do composto.
- A hidrazina, combustível de foguetes, tem fórmula molecular êneagá. Elabore sua fórmula eletrônica e sua fórmula estrutural.
- O número atômico do hidrogênio é 1 e o do oxigênio é 8. Isso significa que um átomo neutro de H tem 1 elétron e um átomo neutro de O tem 8 elétrons. Portanto, a molécula de água tem 10 elétrons; 1 de cada H e 8 do O.
Então, por que na fórmula eletrônica da água (veja a seguir) são representados somente 8 elétrons, e não 10?
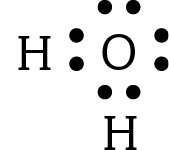
- De acôrdo com a regra do octeto, quantos átomos devem existir, ao todo, na molécula formada pela combinação de:
- um calcogênio e um halogênio?
- fósforo e um halogênio?
- Para um elemento presente em uma molécula, denomina-se valência o número de ligações covalentes que ele faz. Qual é a valência dos elementos em cada substância listada na questão 25?
- Considerando a valência de cada elemento, elabore a fórmula estrutural das seguintes substâncias:
- cê agá
- cêagá
- cêagá
- cêagá
- cêagá
- cê cê éle
- cê agáóh
- cê ésse
- êneagá
- Consultando a tabela periódica, determine quantos prótons e elétrons há nas moléculas:
- agá
- óh
- êne
- cê agá
- êne agá
- cê ó
Respostas e comentários
22. a) 1 (éfe, Z = 9; êne ê, Z = 10)
b) 1 (cêéle, Z = 17; á érre, Z = 18)
c) 1 (Bê érre, Z = 35; , Z = 36)
d) 2 (óh, Z = 8; êne ê, Z = 10)
e) 2 (ésse, Z = 16; á érre, Z = 18)
f) 3 (êne, Z = 7; êne ê, Z = 10)
g) 3 (pê, Z = 15; á érre, Z = 18)
h) 4 (cê, Z = 6; êne ê, Z = 10)
i) 1 (agá, Z = 1; agá ê, Z = 2)
j) zero (á érre é gás nobre)
k) 3 (á ésse, Z = 33; , Z = 36)
l) zero (agá ê é gás nobre)
23. a) K – 2, L – 7.
b) K – 2, L – 8, M – 7.
c) K – 2, L – 8, M – 18, N – 7.
d) K – 2, L – 6.
e) K – 2, L – 8, M – 6.
f) K – 2, L – 5.
g) K – 2, L – 8, M – 5.
h) K – 2, L – 4.
i) K – 1.
j) K – 2, L – 8, M – 8.
k) K – 2, L – 8, M – 18, N – 5.
l) K – 2.
24. O número de ligações, nesses casos, é igual ao número de elétrons que faltam para completar o octeto e coincidem, em todos os casos, com as respostas da questão 22.
25.
a)
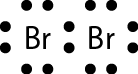
b)
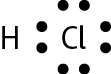
c)

d)
e)

f)

g)

h)
i)
j)

k)
l)
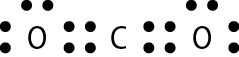
26.
a)
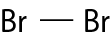
b)
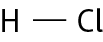
c)
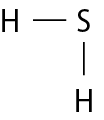
d)
e)
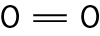
f)

g)
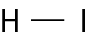
h)
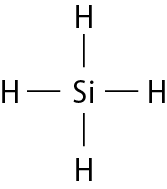
i)

j)
k)
l)
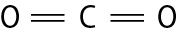
27. a) Cada traço simboliza uma ligação covalente.
b) cêagáóh
28. a) Sim; O com 8 elétrons na camada de valência e H com 2.
b) H — O — O — H
29.
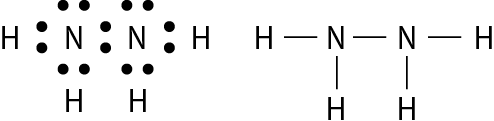
30. Em uma fórmula eletrônica, são representados apenas os elétrons da camada de valência; no caso, 1 de cada H e 6 do óh. Assim, há 2 elétrons da primeira camada do óh não incluídos na fórmula.
31. a) Três átomos: um do calcogênio (X) e dois do halogênio (Y).

b) Quatro átomos: um de fósforo (P) e três do halogênio (Y).
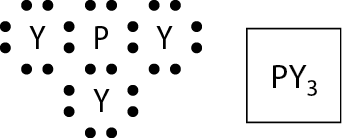
32. a) Bê érre: 1
b) agá: 1, cêéle: 1
c) agá: 1, ésse: 2
d) agá: 1, êne: 3
e) óh: 2
f) êne: 3
g) agá: 1, ih: 1
h) agá: 1, ésse Í: 4
i) agá: 1, pê: 3
j) éfe: 1, óh: 2
k) éfe: 1, cê: 4
l) óh: 2, cê: 4
33. a)
b)
c)
d)
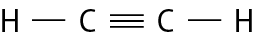
e)
f)
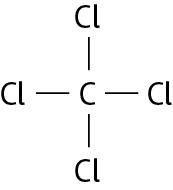
g)
h)
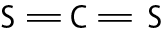
i)

34. Consultamos o número de prótons de cada átomo na tabela periódica. Por serem moléculas e não íons, o número de elétrons de cada átomo é igual ao de prótons (neutralidade elétrica). A seguir, adicionamos a contribuição de cada átomo presente na molécula.
a) 1 + 1 = 2
b) 8 + 8 = 16
c) 7 + 7 = 14
d) 1 + 17 = 18
e) 6 + 1 + 1 + 1 + 1 = 10
f) 7 + 1 + 1 + 1 = 10
g) 1 + 6 + 7 = 14
h) 6 + 8 + 8 = 22
i) 16 + 9 + 9 = 34
- Apresente cinco propriedades que, consideradas em conjunto, possibilitam diferenciar uma substância metálica das substâncias iônicas e moleculares.
- Comente o papel desempenhado por materiais condutores e materiais isolantes nos fios elétricos usados em circuitos residenciais.
- Que tipo de material é designado pela expressão liga metálica?
- De que é feito o ouro 18 quilates, empregado na confecção de joias?
- Qual é a constituição química do bronze? Para que se utiliza esse material?
- Que elementos químicos fazem parte do latão? Quais são as utilidades dessa liga?
- Quais são os dois elementos químicos presentes no aço? Qual deles comparece em maior quantidade?
- Pesquise o que significa a palavra “inox” utilizada na expressão aço inox. Elabore uma lista de objetos feitos dêsse material que existam em sua casa. Por que esses objetos não são feitos de aço comum?
- Comparando-se três substâncias moleculares, uma delas sólida, outra líquida e outra gasosa, todas na mesma temperatura, qual ou quais delas :
- fórma constante?
- fórma variável?
- volume constante?
- volume variável?
- Consulte a tabela periódica, se necessário, e classifique as substâncias representadas a seguir em iônicas, moleculares ou metálicas.
Além de realizar a classificação, explique o critério utilizado por você para fazer essa classificação.
- êne áóh
- éfe ê
- cê ó
- cê agá
- Cê aF₂
45. Ouro (á ú) e iodo (ih) são substâncias sólidas nas condições ambientes.
Comparando o tipo de ligação química existente em cada uma, é possível prever qual apresenta maior temperatura de fusão.
Diga qual é e explique como chegou a essa conclusão.
46. Comparando as substâncias de fórmulas e , é possível prever qual apresenta maior temperatura de fusão.
Diga qual é e explique como chegou a essa conclusão.
- As perguntas dos itens a até d referem-se às seguintes substâncias:
- Cobre (cê ú)
- Brometo de cálcio (Cê aBr₂)
- Amônia (êne agá)
- Cloreto de hidrogênio ()
- Ouro (á ú)
- Óxido de magnésio (ême gê ó)
- qual ou quais delas é ou são certamente nas condições ambientes?
- Sabe-se que duas dessas substâncias são gasosas nas condições ambientes. Quais são elas? Como você chegou a essa conclusão?
- qual ou quais delas corrente elétrica em fase sólida?
- qual ou quais delas não corrente elétrica em fase sólida, mas quando em fase líquida?
- Analise atentamente os dados apresentados na seguinte tabela:
|
Substância |
Temperatura de fusão (°C) |
Temperatura de ebulição (°C) |
|---|---|---|
|
Magnésio (Mg) |
650 |
1.100 |
|
Cloro (Cl2) |
–101 |
–34 |
|
Cloreto de magnésio (MgCl2) |
708 |
1.412 |
Fonte: Reines, W. M. (edição). CRC Handbook of Chemistry and Physics. nonagésima sétima edição Boca Raton: CRC Press, 2016. página 4-44ésse ésse.
- A 25 graus Célsius e na pressão a que se referem os dados da tabela, em que fase essas substâncias se encontram?
- Relacione os dados da tabela com o tipo de ligação química existente nas substâncias.
Respostas e comentários
35. Brilho metálico característico, alta condutividade elétrica e térmica, temperaturas de fusão e ebulição (em geral) altas, maleabilidade e ductibilidade.
36. Condutores elétricos (em geral, o cobre) são empregados na fiação elétrica. Isolantes elétricos são usados no revestimento dessa fiação, a fim de evitar curto-circuitos e choques elétricos.
37. Mistura de dois ou mais elementos, na qual a totalidade ou a maior parte é de elementos metálicos.
38. Ouro e cobre. (Eventualmente, outros metais podem estar presentes.)
39. É uma liga de cobre e estanho, usada para fazer sinos, estátuas, medalhas e monumentos.
40. Cobre e zinco. Serve para fabricar torneiras, porcas, parafusos e instrumentos musicais.
41. Ferro (em maior quantidade) e carbono.
42. “Inox” é uma fórma reduzida de “inoxidável”, ou seja, aquilo que não se oxida. A oxidação do ferro acarreta a formação de ferrugem. Assim, aço inox é aquele que não enferruja.
A elaboração da lista é resposta pessoal.
Objetos são feitos de inox quando têm aplicações que os tornariam sujeitos à ferrugem (por exemplo, ferramentas, utensílios de cozinha, pias, fogões etcétera).
43. a) A substância sólida.
b) A líquida e a gasosa.
c) A sólida e a líquida.
d) A substância gasosa.
44. O critério é: (1) metal e não metal: substância iônica; (2) somente não metal(is): substância molecular; (3) somente metal: substância metálica. Portanto:
a) iônica
b) metálica
c) metálica
d) molecular
e) molecular
f) iônica
g) molecular
h) iônica
45. O ouro é substância metálica. O iodo é substância molecular. A temperatura de fusão das substâncias metálicas é, de modo geral, maior que a das moleculares. Portanto, espera-se que a temperatura de fusão do ouro seja maior. (De fato, a temperatura de fusão do ouro é .1064 graus Célsius e a do iodo é 114 graus Célsius.)
46. O é substância molecular e o é substância iônica. A temperatura de fusão do deve ser maior. (De fato, a do é –87 graus Célsius e a do é 734 graus Célsius.)
47. a) Ouro, cobre, brometo de cálcio e óxido de magnésio, ou seja, as substâncias metálicas e as iônicas.
b) Por exclusão, devem ser as substâncias moleculares da lista, ou seja, amônia e cloreto de hidrogênio.
c) As substâncias metálicas: cobre e ouro.
d) As substâncias iônicas: brometo de cálcio e óxido de magnésio.
48. a) Cloro: fase gasosa. Magnésio e cloreto de magnésio: fase sólida.
b) O magnésio é substância metálica e o cloreto de magnésio é substância iônica. Esses dois tipos de substâncias apresentam, em geral, altas temperaturas de fusão e de ebulição. Já o cloro é substância molecular; esse tipo, em geral, apresenta baixas temperaturas de fusão e de ebulição.

Atividade
Explore diferentes linguagens
A critério do professor, estas atividades poderão ser feitas em grupos.
ANÁLISE DE MODELOS
1. A ilustração a seguir representa uma mudança de fase que ocorre com uma substância molecular. Ele é um modelo mais apropriado para representar qual mudança de fase? Por quê?
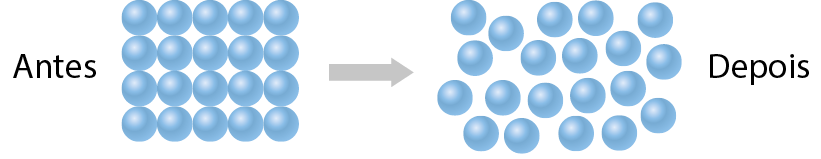
2. A seguir, é mostrado outro esquema de mudança de fase que ocorre com uma substância molecular. Trata-se de um modelo que representa mais corretamente qual mudança de fase? Justifique.
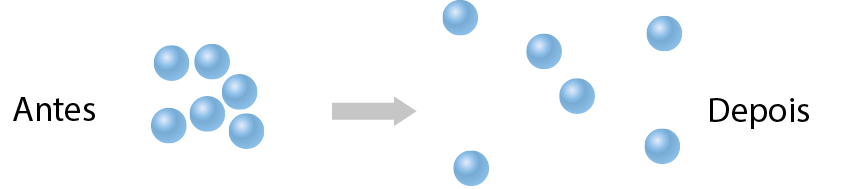
- Analise os modelos numerados e, no caderno, associe cada um a uma substância da lista.
- Zinco () sólido.
- Cloreto de sódio (êne á cê éle) sólido.
- Água (agáóh) líquida.
- Dióxido de carbono (cê ó) gasoso, também denominado gás carbônico.
- Dióxido de carbono (cê ó) sólido, também chamado de gelo-seco.
- Hélio (agá ê) gasoso.
- Cloro (cê éle) gasoso.
- Bromo (Bê érre) líquido.
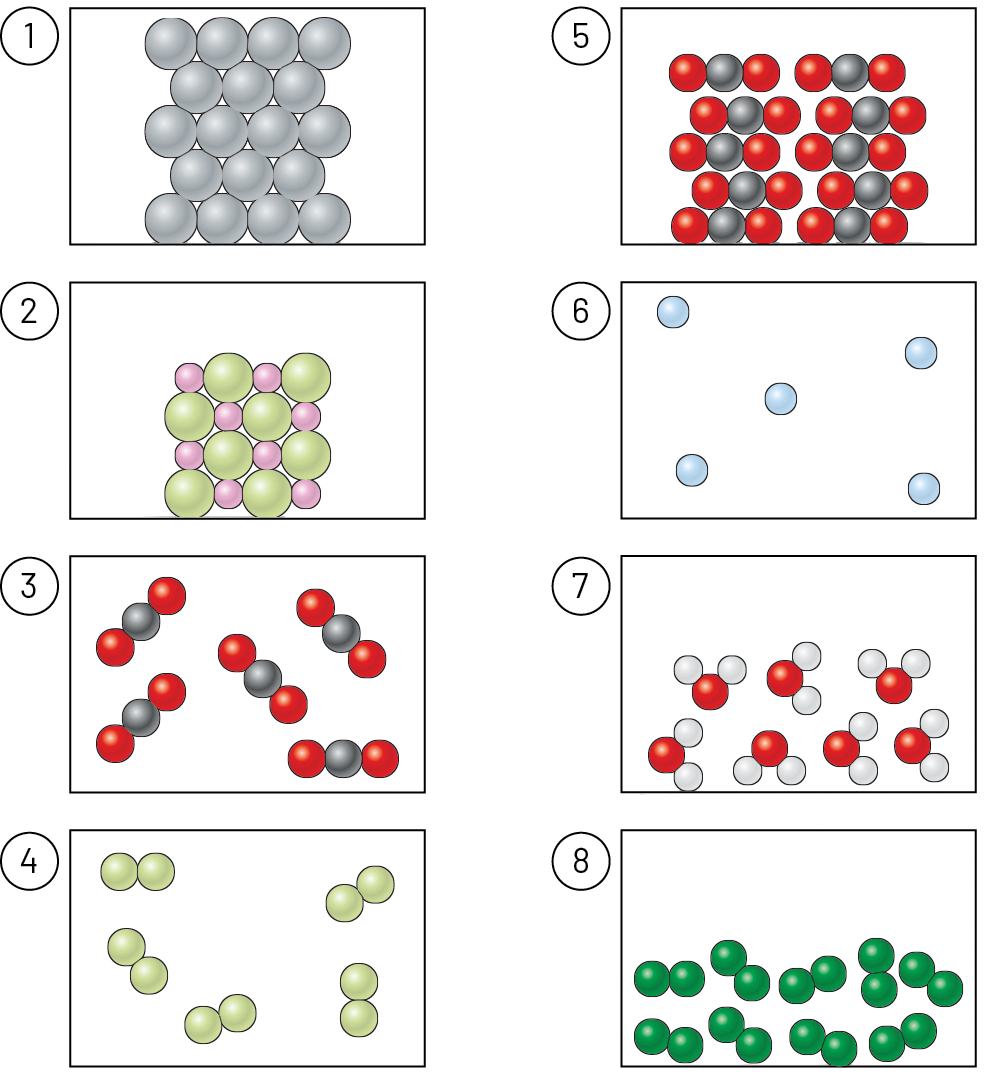
Seu aprendizado não termina aqui
Na Antiguidade, o domínio de técnicas para obter e trabalhar metais significou riqueza e poder.
Primeiro, a humanidade descobriu meios para produzir e utilizar o bronze. Depois, dominou a obtenção e o uso do ferro. Tanto o bronze quanto o ferro (sob a fórma de aço, liga de ferro e carbono) foram de grande importância, por exemplo, para fazer armaduras, escudos, ferramentas, espadas e lanças.
Pesquise mais sôbre a história da obtenção dos metais entre povos antigos e sua importância econômica e militar.
Respostas e comentários
Respostas do Explore diferentes linguagens
1. O modelo da situação inicial representa um sólido e o da situação final, um líquido. Assim, o modelo, como um todo, representa a fusão de uma substância molecular.
2. No modelo, está representada a passagem da fase líquida para a fase gasosa, ou seja, uma vaporização.
3. a) 1; b) 2; c) 7; d) 3; e) 5; f) 6; g) 4; h) 8.
De ôlho na Bê êne cê cê!
O boxe Seu aprendizado não termina aqui estimula valorizar e utilizar os conhecimentos historicamente construídos sobre o mundo físico, social e cultural para entender e explicar a realidade e continuar aprendendo (competência geral 1); e compreender as Ciências da Natureza como empreendimento humano, e o conhecimento científico como provisório, cultural e histórico (competência específica 1).