Página 176
CAPÍTULO
7 Tabela periódica
Analise a seguir as imagens de uma mesma tela de computador em datas diferentes.
Representação com elementos não proporcionais entre si. Cores-fantasia.
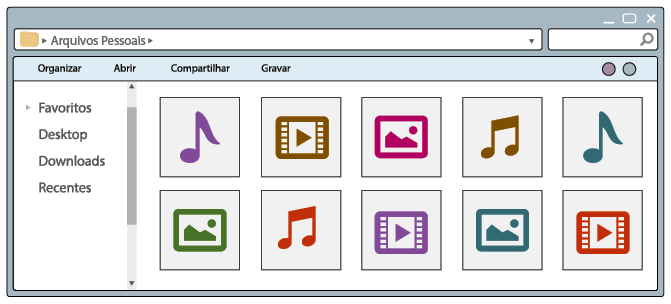
Questão 1. Quais são os tipos de arquivos que podem ser identificados nas
telas dos computadores A e B?
Resposta pessoal. Espera-se que os alunos respondam vídeos, músicas e imagens.
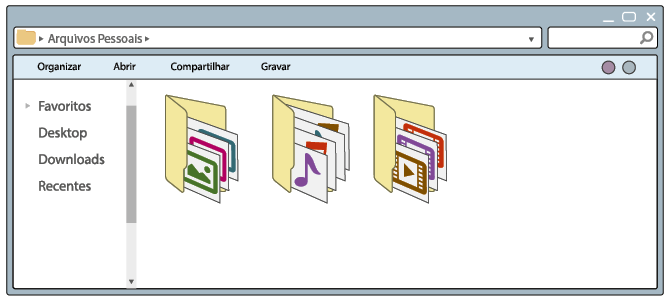
Questão 2. Que modificações você verifica na tela B em relação à A? Qual
é o objetivo dessa mudança?
Resposta pessoal. Espera-se que os alunos respondam que a tela B está organizada em pastas que contêm tipos específicos de arquivos, e o objetivo da mudança é facilitar a localização dos tipos de arquivos.
Questão 3. Qual foi o critério usado para organizar os arquivos?
Resposta pessoal. Espera-se que os alunos respondam que os arquivos foram organizados de acordo com o tipo de cada um.
Como você pôde conferir na imagem A, os arquivos no computador estão misturados, sem critério de organização. Nesse modo de distribuição, sempre que fosse necessário procurar um arquivo, demoraria certo tempo para encontrá-lo. Já na imagem B, os arquivos estão organizados em pastas, cada uma agrupando apenas um tipo de arquivo – imagem, vídeo ou música. Essa organização facilita a localização dos arquivos.
Assim, a organização facilita o desenvolvimento de nossas tarefas. Nesse contexto, a fim de facilitar a identificação e a compreensão das propriedades dos mais de 60 elementos químicos descobertos até a metade do século XIX, vários pesquisadores se dedicaram à criação de um método que pudesse organizá-los.
Página 177
Vamos conhecer a seguir alguns desses métodos de organização dos elementos químicos.
- No início do século XIX, o químico inglês John Dalton (1766-1844) listou os elementos químicos de acordo com a massa atômica conhecida na época. No entanto, não obteve sucesso porque os dados estavam imprecisos.
- Em 1829, o químico alemão Johann Wolfgang Döbereiner (1780-1849) propôs a formação de grupos de três elementos químicos, de acordo com a semelhança de massas atômicas.
- Em 1864, o químico inglês John Alexander Reina Newlands (1837-1898) ordenou os elementos químicos conhecidos na época em sete grupos dispostos em colunas, seguindo a ordem crescente de massa atômica.
- Em 1869, o químico russo Dmitri Ivanovich Mendeleev (1834-1907) propôs organizar os 63 elementos químicos até então conhecidos de acordo com sua massa atômica. Enquanto estava preparando seu livro de química inorgânica, Mendeleev deduziu que os elementos químicos tinham propriedades semelhantes.

Em 1913, o físico inglês Henry Gwyn Jeffreys Moseley (1887-1915) propôs a ordenação dos elementos químicos em função de seu número atômico , e não de sua massa atômica, como proposto por Mendeleev. Moseley percebeu que com essa organização os elementos químicos ficavam arranjados de forma mais regular.

Questão 4. Contraponha a organização dos elementos químicos feita por Mendeleev à organização feita por Moseley.
Resposta: Mendeleev propôs organizar os elementos químicos com base na massa atômica deles. Já Moseley organizou os elementos químicos com base em seus números atômicos.
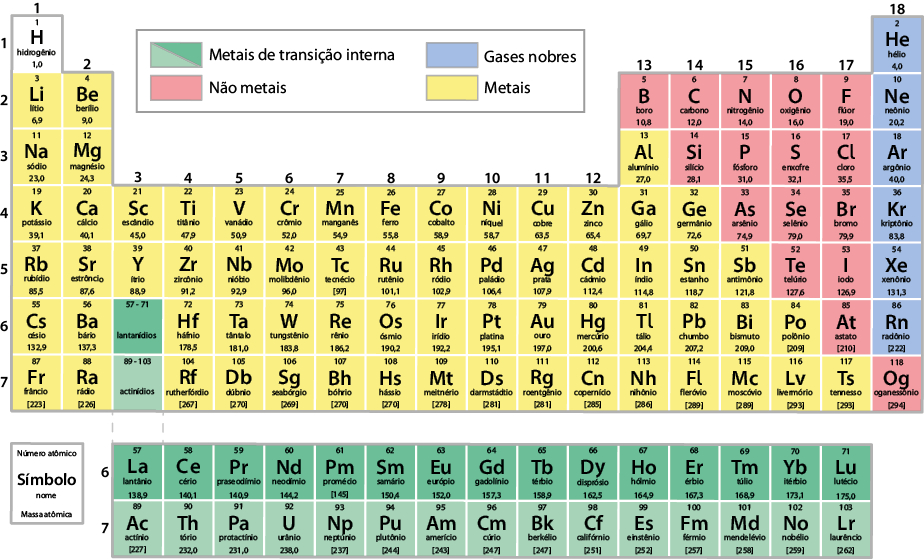
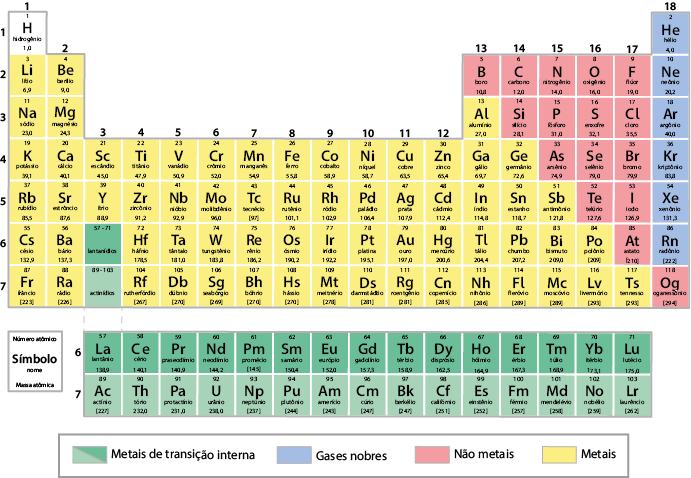
Atualmente, a tabela periódica é organizada em ordem crescente do número atômico dos elementos químicos. Nela, há 118 elementos oficialmente reconhecidos pela União Internacional de Química Pura e Aplicada (Iupac). Verifique essa tabela na próxima página. Você poderá consultá-la sempre que for necessário.
Página 178
Tabela periódica dos elementos químicos
Com massas atômicas referidas ao isótopo 12 do carbono
- As massas atômicas com mais de uma casa decimal tiveram seus valores arredondados.
- Observação: as cores utilizadas nesta tabela não têm significado científico; são apenas recursos visuais pedagógicos.
- Para elementos que não apresentam átomos estáveis, apresenta-se a massa atômica do isótopo com maior tempo de vida entre colchetes.
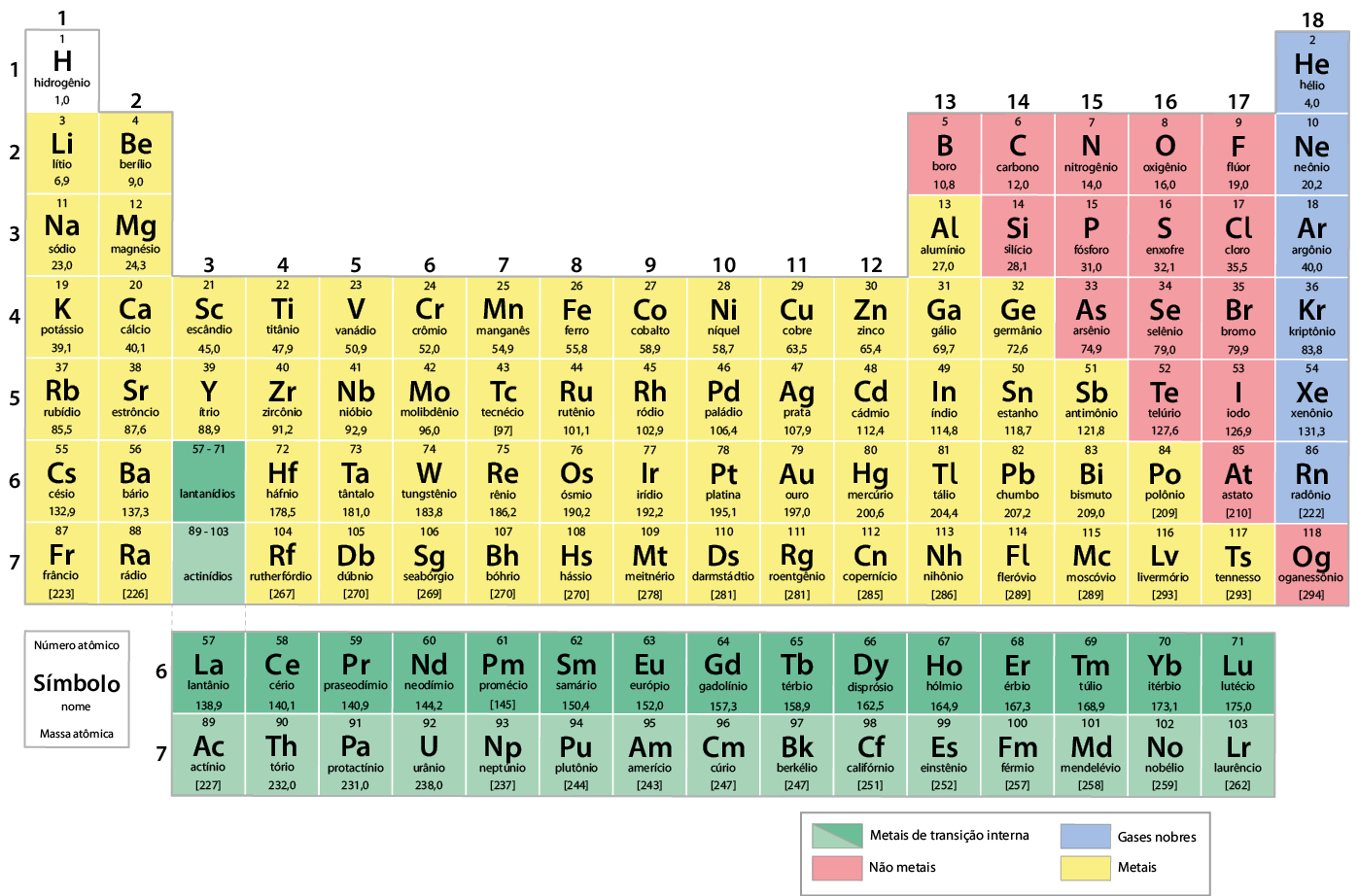
Tabela organizada com informações de:
ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
BROWN, Theodore L. et al. Chemistry: the central science. 15. ed. Expanded edition. Pearson, 2022.
IUPAC COMMISSION ON ISOTOPIC ABUNDANCES AND ATOMIC WEIGHTS. Atomic weights of the elements 2021. Disponível em: https://oeds.link/ZANVkZ. Acesso em: 4 mar. 2022.
SOCIEDADE BRASILEIRA DE QUÍMICA. Tabela Periódica dos Elementos. 2022. Disponível em: https://oeds.link/2QCPW4. Acesso em: 4 mar. 2022.
Página 179
Estudando a tabela periódica atual
Como estudamos, os elementos químicos estão organizados sequencialmente na tabela periódica em ordem crescente do número atômico. Além dessa organização, os elementos com propriedades químicas e físicas semelhantes, que variam gradualmente, estão ordenados em colunas verticais chamadas grupos. A tabela periódica atual apresenta 18 grupos. Observe a seguir.
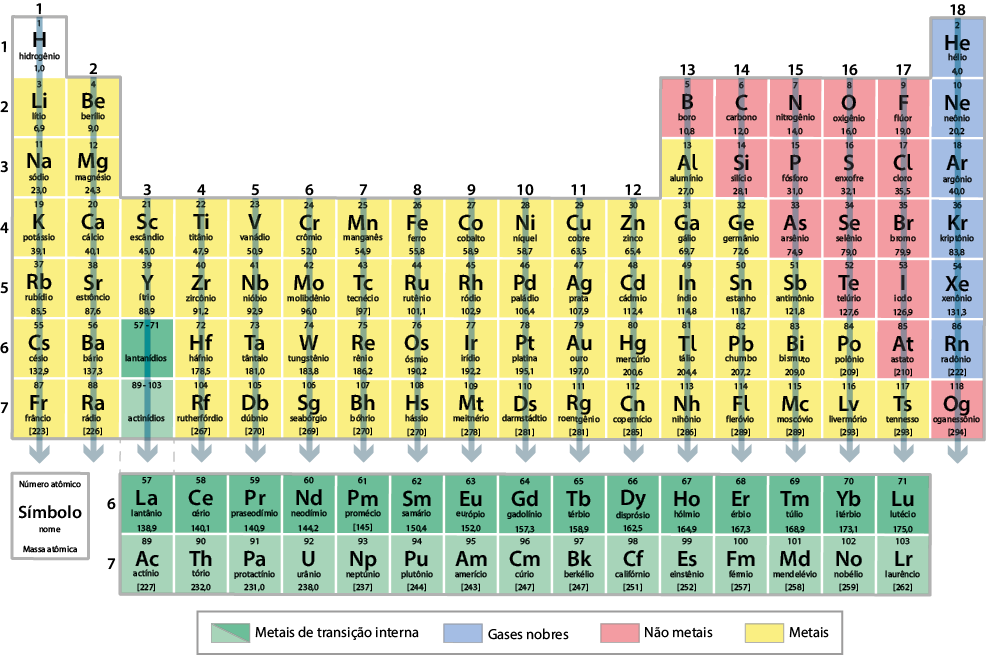
Existem tabelas periódicas que dividem os grupos em "A", "B" e "zero". No entanto, a Iupac recomenda numerar os grupos da esquerda para a direita, de 1 a 18.
Alguns grupos, inclusive, recebem nomes especiais. Verifique no quadro a seguir.
| Grupo | Nome de grupo |
|---|---|
| 1 | metais alcalinos |
| 2 | metais alcalinos terrosos |
| 3 a 12 | metais de transição |
| 13 | grupo do boro |
| 14 | grupo do carbono |
| 15 | grupo do nitrogênio |
| 16 | calcogênios |
| 17 | halogênios |
| 18 | gases nobres |
Professor, professora: Os símbolos dos elementos químicos e as fórmulas químicas das substâncias serão apresentadas na primeira ocorrência, por capítulo.
Página 180
Para agrupar em colunas os elementos com propriedades químicas e físicas semelhantes, foi necessário formar algumas linhas na tabela periódica. Cada uma delas é chamada período e mantém a organização dos elementos químicos em ordem crescente de número atômico. A tabela periódica atual apresenta sete períodos. Observe a seguir.

O sexto período corresponde à série dos lantanídios, que inicia com o elemento lantânio e encerra com o lutécio . A outra série ocupa o sétimo período e corresponde à dos actinídios, iniciando com o elemento químico actínio e encerrando com o laurêncio . Essas duas séries referem-se aos metais de transição interna. Optou-se por essa organização para evitar que a tabela periódica ficasse com linhas extensas.
Questão 5. Qual é o grupo e o período do elemento químico telúrio ?
Resposta: Grupo 16 (calcogênios) e período 5.
Questão 6. Qual é o nome e o símbolo do elemento que ocupa o quarto
período e o grupo dos metais alcalinos terrosos?
Resposta: Cálcio .
Na tabela periódica, há também divisões de acordo com algumas propriedades específicas dos elementos. Essa divisão é normalmente indicada por cores distintas, classificando os elementos em metais, não metais e gases nobres.
Página 181
Observe a seguir.
Com exceção do mercúrio , os metais são sólidos à temperatura ambiente, , e são bons condutores de eletricidade e de calor. Eles também são dúcteis, ou seja, podem ser moldados em fios. Por isso, podem formar liga metálica com outras substâncias e ser transformados em lâminas. Outra propriedade dos metais é a tendência que eles têm a de ceder elétrons, formando cátions.
Por causa dessas características, os metais são usados em diversas finalidades. O ferro e o alumínio , por exemplo, são frequentemente utilizados na fabricação de peças de automóveis, pois são maleáveis e apresentam baixo custo em relação a outros metais.
Os elementos químicos
que não têm as propriedades dos metais são classificados como não metais. Tanto a aparência quanto os estados
físicos deles são variados. Por exemplo, à temperatura ambiente, o carbono
encontra-se no estado sólido, o bromo , no estado líquido e o
cloro , no
estado gasoso.
Os não metais não são bons condutores de corrente elétrica nem de calor. Além
disso, têm a tendência de receber elétrons, formando ânions.
Os gases nobres são elementos químicos que se caracterizam por serem pouco reativos, ou seja, não reagem facilmente com outros elementos químicos. A maioria deles é encontrada em pequenas concentrações na atmosfera, sendo o argônio o mais abundante.
O hidrogênio apresenta propriedades distintas e não se enquadra em outros grupos da tabela periódica. Ele se encontra no grupo dos metais alcalinos por apresentar um elétron em sua última camada, de forma semelhante aos elementos desse grupo. No entanto, não pertence a esse grupo.
Página 182
Utilizando a tabela periódica
A tabela periódica é uma ferramenta que oferece diversas informações sobre os elementos químicos. A seguir, vamos aprender como identificar essas informações.
Além da disposição dos elementos químicos, a tabela periódica padroniza a nomenclatura deles. O símbolo que designa cada elemento químico é escrito com a primeira letra maiúscula. Se houver segunda letra, ela deverá ser sempre minúscula.
Os quadros da tabela periódica apresentam diversas informações sobre os elementos químicos. Confira a seguir a disposição padronizada dessas informações por meio da representação do elemento químico berílio .

Questão 7. Consulte a tabela periódica e escreva em seu caderno o símbolo, o número atômico e a massa atômica dos elementos químicos sódio e kriptônio.
Resposta: Para o sódio: ; ; . Para o kriptônio: ; ; .
Questão 8. Vire-se para um colega e conversem sobre as principais dificuldades e facilidades que
tiveram ao consultar a tabela periódica.
Resposta pessoal. O objetivo desta questão é levar os alunos a fazer uma autoavaliação sobre o uso da tabela periódica, relatar a sua vivência com relação à utilização desse recurso e escutar o relato do colega, de maneira empática.
Sugestões complementares
No site Laboratório Aberto de Interatividade para Disseminação do Conhecimento Científico e Tecnológico (Labi), vinculado à Universidade Federal de São Carlos (UFSCar), você encontra uma tabela periódica virtual com informações a respeito da descoberta de cada elemento químico e de suas principais propriedades e aplicações. Além disso, é possível acessar jogos digitais sobre a tabela e seus elementos químicos.
Laboratório Aberto de Interatividade para Disseminação do Conhecimento Científico e Tecnológico. Disponível em: https://oeds.link/UDfY9k. Acesso em: 13 abr. 2022.
Página 183
O papel das cientistas na descoberta de elementos químicos
Ao organizar os elementos químicos na tabela periódica, Mendeleev acreditava que novos elementos químicos ainda poderiam ser descobertos pelos cientistas.
Essa previsão de Mendeleev foi confirmada ao longo dos anos por meio de estudos realizados por vários cientistas. A descoberta de alguns desses elementos químicos teve a participação de muitas cientistas mulheres. Confira a seguir.
A física polonesa Marie Curie (1867-1934), apresentada na imagem A, e seu marido, o físico francês Pierre Curie (1859-1906), descobriram o polônio e o rádio , em 1898.
A física nuclear canadense Harriet Brooks (1876-1933) e seu orientador, o físico neozelandês Ernest Rutherford (1871-1937), descobriram o radônio , em 1901.
A física austríaca Lise Meitner (1878-1968) e o químico alemão Otto Hahn (1879-1968) descobriram o protactínio , em 1918.
A química alemã Ida Noddack (1896-1978) e seu marido, o químico alemão Walter Noddack (1893-1960), descobriram o elemento químico rênio , em 1925.
A química francesa Marguerite Perey (1909-1975), apresentada na imagem B, descobriu o frâncio .
A química nuclear estadunidense Darleane Hoffman (1926 -) e um grupo de pesquisadores descobriram o seabórgio , em 1974.
A química nuclear estadunidense Clarice Phelps, apresentada na imagem C, participou da descoberta do tennesso , em 2010.
A química nuclear estadunidense Dawn Shaughnessy liderou a equipe de cientistas que descobriu e confirmou a existência do livermório , do nihônio , do fleróvio , do tennesso e do oganessônio .



Página 184
Atividades
Faça as atividades no caderno.
1. A tabela periódica atual apresenta um total de quantos grupos e quantos períodos?
Resposta: A tabela periódica atual apresenta um total de 18 grupos e 7 períodos.
2. Mendeleev sugeriu uma organização para os elementos químicos em 1869. Com suas palavras, descreva como ela era e como se encontra atualmente.
Resposta: Em 1869, Mendeleev propôs uma organização dos elementos químicos com base em sua massa atômica. No entanto, em 1913, Moseley propôs outra forma de organização, agora com base no número atômico dos elementos químicos. Essa organização se mantém na tabela periódica atual: ordem crescente do número atômico.
3. Se um elemento hipotético X for considerado isótopo do rubídio , quantos prótons ele apresentará? Consulte a tabela periódica.
Resposta: Ser isótopo de um elemento químico significa apresentar o mesmo número de prótons que ele. O rubídio apresenta número atômico 37; portanto, ele tem 37 prótons. Nesse caso, o elemento hipotético X deve apresentar 37 prótons.
4. Utilizando a tabela periódica, identifique o nome do grupo ao qual pertence cada um dos elementos químicos que formam os compostos a seguir.
a) Sulfato de bário : composto utilizado como contraste em radiografias.
Resposta: – metais alcalinos terrosos; – calcogênios; – calcogênios.
b) Fluoreto de sódio : composto utilizado na prevenção de cáries.
Resposta: – metais alcalinos; – halogênios.
c) Bromato de potássio : era muito utilizado na panificação, mas atualmente está proibido porque libera compostos carcinogênicos.
Resposta: – metais alcalinos; – halogênios; – calcogênios.
d) Ácido clorídrico : utilizado nas indústrias e também faz parte do suco gástrico.
Resposta: – não se enquadra em grupo; – halogênios.
5. O mercúrio era muito utilizado na fabricação de termômetros. No entanto, a partir de 2019, a Agência Nacional de Vigilância Sanitária (Anvisa) proibiu sua fabricação e comercialização, bem como seu uso em serviços de saúde. Atualmente, são utilizados termômetros de álcool ou digitais.
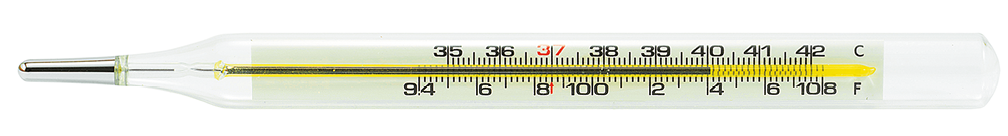
Identifique a alternativa correta a respeito do elemento químico mercúrio.
a) O mercúrio é um não metal.
b) O mercúrio pertence ao grupo 15 e ao quarto período da tabela periódica.
c) O símbolo químico desse elemento químico é .
d) O mercúrio é sólido em temperatura ambiente.
e) O número atômico do mercúrio é 80.
Resposta: Alternativa e.
Página 185
6. O nêonio é um elemento químico utilizado em letreiros luminosos. Ao ser percorrido por correntes elétricas, ele emite luz na cor laranja.

Identifique a alternativa correta a respeito da posição do elemento químico neônio na tabela periódica.
a) Sexto período, grupo 15.
b) Segundo período, grupo 18.
c) Sétimo período, grupo 16.
d) Sexto período, grupo 6.
e) Terceiro período, grupo 14.
Resposta: Alternativa b.
7. Considere os elementos químicos hipotéticos a seguir.
- sólido à temperatura ambiente e com brilho.
- gasoso à temperatura ambiente e não conduz eletricidade.
- sólido à temperatura ambiente e bom condutor de calor.
- líquido à temperatura ambiente e bom condutor de calor.
- sólido à temperatura ambiente e não conduz calor nem eletricidade.
- líquido à temperatura ambiente e não conduz calor nem eletricidade.
- sólido à temperatura ambiente e bom condutor de eletricidade.
Imagine que a tabela periódica ainda não tenha sido inventada e você precise criar uma maneira de classificar os elementos químicos hipotéticos apresentados.
No caderno, organize esses elementos químicos de acordo com critérios específicos. Depois apresente aos seus colegas, comparando suas classificações.
Resposta: Os alunos podem escolher critérios como número atômico, massa atômica ou as propriedades dos elementos.
Página 186
Ligações químicas
Observe a foto a seguir.

Quando analisamos a imagem de uma praia, percebemos que há elementos químicos em toda parte desse ambiente.
O ar atmosférico é uma mistura de gases composta principalmente de gás nitrogênio , gás oxigênio , argônio e gás carbônico . A água do mar também é uma mistura, composta principalmente de água e cloreto de sódio . Já a areia é uma mistura composta basicamente de dióxido de silício .
Questão 9. Quais elementos químicos compõem o gás carbônico, o cloreto de
sódio e o dióxido de silício?
Resposta: O gás carbônico é formado por carbono e oxigênio; o cloreto de sódio, por sódio e cloro; o dióxido de silício, por silício e oxigênio.
Assim como o ar atmosférico, a água do mar e a areia, a maioria das substâncias encontradas na Terra é composta de mais de um elemento químico. Para formar essas substâncias, os átomos de um elemento químico se unem a outros.
Por exemplo, cada molécula de água é formada pela combinação dos elementos químicos oxigênio e hidrogênio , em uma proporção de dois átomos de hidrogênio para cada átomo de oxigênio. Essa combinação é possível por causa da capacidade que os elementos químicos têm de realizar ligações químicas.
Representação com elementos não proporcionais entre si. Cores-fantasia.
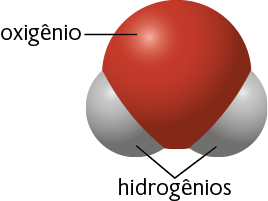
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 58.
Os elétrons situados no último nível energético dos átomos ligam-se uns aos outros e são denominados elétrons de valência. As ligações químicas ocorrem até que os átomos fiquem estáveis. Isso ocorre quando eles têm oito elétrons na camada de valência.
Assim, as ligações químicas ocorrem entre os átomos e criam os diversos compostos, tanto naturais quanto sintéticos.
Vamos estudar a seguir como ocorrem os três tipos de ligações químicas: a iônica, a covalente e a metálica.
Página 187
Ligação iônica
Alguns elementos químicos têm a tendência de ceder seus elétrons de valência mais facilmente; outros, de receber elétrons.
O átomo que cede elétrons se torna um cátion, pois passa a ser eletricamente positivo. Já o que recebe elétrons se torna um ânion, ficando eletricamente negativo.
Representação com elementos não proporcionais entre si e sem proporção de distância. Cores-fantasia.
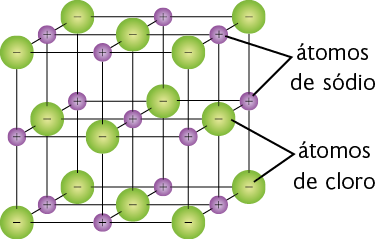
Representação simplificada da estrutura do cloreto de sódio. Nessa imagem, as barras representam as ligações iônicas entre os átomos.
Fonte de pesquisa: RUSSELL, John B. Química geral. 2. ed. São Paulo: Pearson Makron Books, 1994. v. 1. p. 344.
Na ligação iônica do cloreto de sódio, por exemplo, o cloro recebe um elétron e o sódio cede um elétron.
Os dois íons formados interagem por causa das forças de atração de cargas, gerando uma ligação iônica. Geralmente esse tipo de ligação ocorre entre metais e não metais ou entre metais e hidrogênio.
Em geral, os compostos iônicos são sólidos à temperatura ambiente, estado físico em que são maus condutores elétricos. Do contrário, quando estão dissolvidos em água ou fundidos, apresentam boa condutividade elétrica.
Ligação covalente
Na ligação covalente, os átomos competem igualmente pelos elétrons de valência. Dessa forma, os elétrons são compartilhados entre os átomos. Geralmente esse tipo de ligação existe entre não metais ou entre não metais e hidrogênio.
Após a ligação covalente se estabelecer, a estrutura que se forma é chamada molécula. As substâncias moleculares podem se encontrar nos estados físicos sólido, líquido e gasoso, em temperatura ambiente, e são maus condutores elétricos.
As moléculas de água e de gás oxigênio, por exemplo, são formadas por ligação covalente. Portanto, há compartilhamento de elétrons entre os átomos constituintes delas.
Representação com elementos não proporcionais entre si e sem proporção de distância. Cores-fantasia.
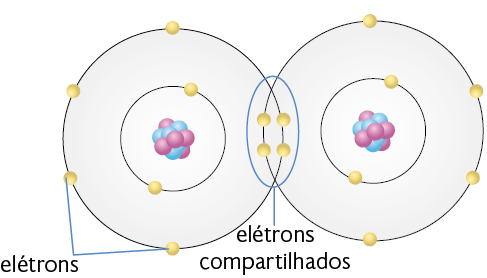
Fonte de pesquisa: COVALENT bonds. Brooklyn College. Disponível em: https://oeds.link/t9NaPi. Acesso em: 27 fev. 2022.
Página 188
Ligação metálica
A ligação metálica ocorre apenas entre metais. Os átomos dos metais apresentam os elétrons de sua camada de valência parcialmente livres para se movimentar, de acordo com o modelo chamado "mar de elétrons". A força de atração entre os núcleos dos átomos e o "mar de elétrons" é o que mantém os átomos dos metais unidos, formando a ligação metálica.
Observe o exemplo a seguir.
Representação com elementos não proporcionais entre si e sem proporção de distância. Cores-fantasia.
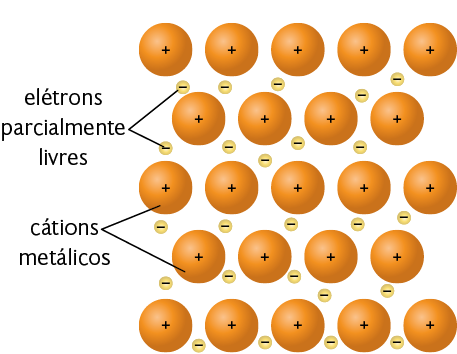
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 521.
Neste modelo de ligação metálica, note que os cátions metálicos estão mergulhados no "mar de elétrons". Os elétrons estão livres para se movimentar entre os cátions metálicos, gerando estabilidade e organização entre esses cátions.
O tipo de ligação química entre os átomos explica por que os metais apresentam boa condutividade elétrica e térmica, no estado sólido e no estado líquido. O movimento dos elétrons livres auxilia na condução de calor e de energia elétrica.
Ligas metálicas
Grande parte dos objetos metálicos que utilizamos no dia a dia não é feita de apenas um metal, e sim de uma mistura homogênea formada por mais de um elemento químico, com propriedades características dos metais. Essas misturas são chamadas ligas metálicas e são obtidas com base em ligações químicas.
Geralmente o ser humano cria ligas metálicas para obter algumas características específicas de que necessita para determinados materiais, por exemplo, maior durabilidade, menor massa e maior resistência a altas temperaturas.
O aço é uma liga metálica formada por ferro e carbono. Ele é utilizado para fabricar a carroceria de muitos automóveis, por ser mais duro e resistente que o ferro puro.

As rodas de liga leve dos automóveis geralmente são compostas por uma liga de alumínio, silício , magnésio , titânio e estrôncio , entre outros metais. Essa combinação oferece menor massa e maior resistência e maleabilidade ao material.
Página 189
Atividades
Faça as atividades no caderno.
1. Analise as substâncias químicas a seguir e escreva no caderno qual tipo de ligação química elas realizam, justificando sua resposta. Para fazer essa atividade, consulte a tabela periódica.
a) Dióxido de carbono .
Resposta: Ligação covalente, pois ocorre entre não metais .
b) Ácido sulfúrico .
Resposta: Ligação covalente, pois ocorre entre não metais e o hidrogênio.
c) Prata .
Resposta: Ligação metálica, pois ocorre entre metais .
d) Hidreto de sódio .
Resposta: Ligação iônica, pois ocorre entre metais e o hidrogênio.
e) Brometo de potássio .
Resposta: Ligação iônica, pois ocorre entre metais e não metais .
2. Julgue as afirmativas a seguir em verdadeiras ou falsas, corrigindo as falsas em seu caderno.
a) O composto químico , chamado ácido sulfídrico, é formado pela ligação metálica entre seus átomos.
Resposta: Falsa. O composto químico , chamado ácido sulfídrico, é formado pela ligação covalente entre seus átomos.
b) As ligações químicas entre os átomos do composto são ligações metálicas.
Resposta: Falsa. As ligações entre os átomos do composto são ligações iônicas.
c) As ligações químicas no composto são do tipo iônicas.
Resposta: Verdadeira.
3. Analise a distribuição eletrônica dos elementos químicos a seguir. Em seguida, indique, em seu caderno, qual(is) deve(m) perder e qual(is) deve(m) ganhar elétrons para se tornar(em) estável(eis).
a)
| K | L | M | N |
|---|---|---|---|
| 2 | 8 | 15 | 2 |
Resposta: Deve perder 2 elétrons.
b)
| K | L | M | N |
|---|---|---|---|
| 2 | 8 | 8 | 1 |
Resposta: Deve perder 1 elétron.
c)
| K | L |
|---|---|
| 2 | 6 |
Resposta: Deve ganhar 2 elétrons.
d)
| K | L | M | N | O |
|---|---|---|---|---|
| 2 | 8 | 18 | 18 | 7 |
Resposta: Deve ganhar 1 elétron.