Página 150
UNIDADE
3
Matéria

Página 151
Cinco, quatro, três, dois, um... e começa um espetáculo de luzes e cores no céu, que encantam aqueles que assistem ao show pirotécnico.
Os fogos de artifício são um tipo de explosivo cujo funcionamento envolve a emissão de luzes e/ou sons. Atualmente, eles são utilizados para diferentes finalidades, como em comemorações, especialmente de datas festivas, por exemplo, o Ano Novo.
Embora a emissão de luzes de cores variadas e sons pareça mágica, são reações químicas com elementos químicos específicos. Mas cuidado! Por serem explosivos, os fogos de artifício devem ser manipulados apenas por adultos e seguindo normas de segurança.
Iniciando a conversa
1. Explique, com suas palavras, a formação e a emissão de luzes coloridas durante os shows pirotécnicos.
2. Explique se a queima de fogos de artifício, como os retratados na gravura, envolve transformação da matéria.
3. Como a queima de fogos de artifício pode se relacionar com os átomos? Reflita sobre essa questão e, em seguida, converse com um colega a respeito. Anotem no caderno suas conclusões e as leiam em voz alta aos demais colegas da turma.
Agora vamos estudar...
- o que é matéria;
- as propriedades e a constituição da matéria;
- os modelos atômicos;
- os átomos;
- a tabela periódica;
- as transformações da matéria.
Página 152
CAPÍTULO
6 Estudando a matéria
Observe a foto a seguir.

Questão 1. Em sua opinião, do que as
rochas mostradas na imagem são
constituídas?
Questão 2. O que é matéria?
Ao responder à questão sobre a constituição das rochas, você pode ter citado que elas são compostas por minerais. No entanto, também podemos dizer que são constituídas por matéria. Afinal, o que é matéria?
Ao longo do tempo, os filósofos da Grécia Antiga buscaram compreender a composição dos diferentes materiais por meio de um conceito chamado matéria. Verifique mais informações a seguir.

A. 625 a.C.-560 a.C.
No século VI a.C., o filósofo grego Tales de Mileto (aproximadamente 624 a.C.-556 a.C.) sugeriu que toda matéria era constituída de água.
B. 588 a.C.-470 a.C.
Os filósofos gregos Anaxímenes (aproximadamente 586 a.C.-526 a.C.) e Heráclito (aproximadamente 540 a.C.-480 a.C.) defendiam que o ar e o fogo eram os principais constituintes da matéria.
C. 490 a.C.-435 a.C.
O filósofo grego Empédocles de Agrigento (490 a.C.-430 a.C.) adicionou a terra aos elementos já citados por Tales, Anaxímenes e Heráclito. Empédocles afirmava que todos os materiais eram constituídos de quatro elementos básicos: terra, água, ar e fogo, combinados em diferentes proporções.
D. 384 a.C.-322 a.C.
O filósofo grego Aristóteles (384 a.C.-322 a.C.) completou a teoria de Empédocles afirmando que a base do mundo material era a chamada "matéria primitiva". Ela não podia ser percebida enquanto não tomasse forma. Quando a "matéria primitiva" tomava forma, ela dava origem aos quatro elementos básicos: terra, ar, água e fogo.
Página 153
As ideias de Aristóteles predominaram durante muitos séculos. No entanto, foram contestadas na Europa durante o Renascimento, período da história entre os séculos XIV e XVI em que se observa uma intensa mudança de pensamento e, consequentemente, da construção do pensamento científico. Tal modificação foi tão intensa que nesse período ocorreu a chamada Revolução Científica.
Com a estruturação da Ciência moderna e o desenvolvimento de diversos instrumentos, foi possível analisar detalhadamente a matéria. Com essas observações, foram propostas novas hipóteses sobre a constituição da matéria, marcando o início das ideias aceitas até os dias atuais.
Propriedades da matéria
Para iniciar o estudo da matéria, considere a situação a seguir.
Em um dia ensolarado, Diego e sua irmã Flávia encheram completamente uma piscina com água. Em seguida, entraram nela.
Representações com elementos não proporcionais entre si. Cores-fantasia.


Representações da piscina completamente cheia de água (imagem A) e da mesma piscina com água transbordando e as crianças dentro dela (imagem B).
Questão 3. Explique com suas palavras o
que ocorreu na situação
representada e o que você concluiu.
Analisando a situação vivenciada pelas crianças, por exemplo, podemos afirmar que a matéria é tudo aquilo que tem massa e que ocupa lugar no espaço. Agora, vamos aplicar esse conceito na situação apresentada. A piscina, a água e as crianças são exemplos de matéria, pois têm massa e ocupam lugares no espaço. Como verificamos na imagem, ao entrarem na piscina, os corpos das crianças deslocaram parte da água para fora dela. Isso ocorreu porque eles preencheram o mesmo espaço que antes era ocupado pela água.
Além disso, se compararmos, por exemplo, a piscina e a água que está em seu interior, podemos notar que elas apresentam características distintas, como a cor e o estado físico. Isso indica que cada matéria apresenta as próprias características, dependendo de sua constituição.
Página 154
Ao estudarmos um corpo, precisamos conhecer as principais propriedades que ele apresenta, como massa, volume e densidade. É sobre esse assunto que vamos estudar nas próximas páginas.
Massa
Leia a seguir informações a respeito do halterofilismo.
O halterofilismo é uma modalidade esportiva olímpica em que o atleta tem que levantar a maior quantidade de massa, do chão até acima de sua cabeça. A categoria em que cada atleta compete é indicada de acordo com a sua massa corpórea.
A massa a ser levantada está presente em discos de carga que são separados por cores e massas. Os discos de menor massa são os que têm menor diâmetro e cor branca. Já os de maior massa têm maior diâmetro e cor vermelha. Nas competições, cada atleta tem três tentativas para levantar a maior carga possível. Observe as imagens a seguir.


Questão 4. O que acontecerá com as barras
retratadas nas fotos A e B se as atletas não
aplicarem força suficiente para movê-las?
Questão 5. Explique em qual das situações
retratadas (A e B) a atleta deve
aplicar maior força para levantar a carga.
Os corpos têm uma tendência natural de permanecer no estado em que se encontram, seja em repouso, seja em movimento uniforme. Ela é chamada inércia.
Nas situações A e B das competições de halterofilismo, caso as atletas não apliquem força suficiente nas barras, elas permanecerão em repouso por tempo indeterminado. Isso porque essas situações estão diretamente relacionadas à massa dos objetos.
Página 155
A massa é uma das propriedades de um corpo e reflete a resistência dele a uma mudança de estado de movimento.
Tomemos como exemplo a situação B das competições de halterofilismo. Nessa circunstância, ela teve de exercer maior força para levantar a carga, pois havia discos de maior massa. Assim, havia maior resistência à mudança do estado de movimento da barra. Em outras palavras, a haste com discos nessa situação oferece maior tendência em permanecer em repouso do que a retratada na situação A.
De acordo com o Sistema Internacional de Unidades (SI), a unidade de medida padrão de massa é o quilograma . No entanto, também pode ser expressa em outras unidades de medida, como grama e tonelada .
Massa e peso
Em 20 de julho de 1969, três astronautas estadunidenses chegaram à Lua, graças à missão espacial Apollo 11. Além de esse evento marcar a chegada do ser humano à Lua, ele possibilitou que os astronautas constatassem, na prática, os conceitos de peso e massa de um corpo.

Antes de darmos continuidade a esse assunto, responda à questão proposta a seguir, envolvendo o elefante-africano.
Questão 6. Analise as afirmativas A e B.
A.Um elefante-africano macho pesa, em média, .
B.Um elefante-africano macho tem massa de, em média, .
Em sua opinião, qual(is) das afirmativas apresenta(m) as informações de maneira correta: afirmativa A, afirmativa B ou ambas? Registre sua resposta no caderno, justificando-a.
Elefante-africano: pode atingir aproximadamente de altura.

Página 156
Ao analisar a questão sobre o elefante-africano, você deve ter percebido que são usados dois termos distintos – massa e peso – para se referir aos . A massa está relacionada à quantidade de matéria de um corpo. Já o peso é uma força que envolve a massa do corpo e a gravidade, um tipo de força de interação que ocorre entre corpos que apresentam massa.
A massa é uma característica própria e individual de um corpo, ou seja, ela independe do local onde esse corpo se localiza. Já a atração gravitacional depende das massas e da distância entre os corpos. Por isso, o valor do peso de um corpo pode variar.
O peso de um corpo pode ser calculado pela fórmula apresentada a seguir.
em que:
- P é a força peso;
- m é a massa do corpo;
- g é a aceleração da gravidade do local.
Questão 7. Considerando um valor constante
para g, qual é a
relação de igualdade que podemos estabelecer entre a massa e o peso?
O valor da aceleração da gravidade na superfície terrestre é de . Considerando essas informações, podemos afirmar, por exemplo, que uma pessoa com massa de tem um peso de, aproximadamente, na superfície da Terra. Observe a seguir.
Na superfície da Lua, no entanto, o peso dessa pessoa seria de, aproximadamente, . Isso porque a atração gravitacional na Lua é, aproximadamente, seis vezes menor do que a da Terra.
Perceba que tanto na superfície da Terra quanto na da Lua a massa dessa pessoa é a mesma, ou seja, . O que variou foi o peso dela.
Questão 8. Se a massa do astronauta na
Terra é de , qual é a
massa desse astronauta na Lua?
Questão 9. Qual seria o peso do seu
corpo na Terra e na Lua, considerando no satélite natural?
Questão 10. Por que é importante criar uma
padronização para medidas, como
a massa? Converse com um colega sobre isso.
Página 157
Volume
Observe a imagem a seguir.
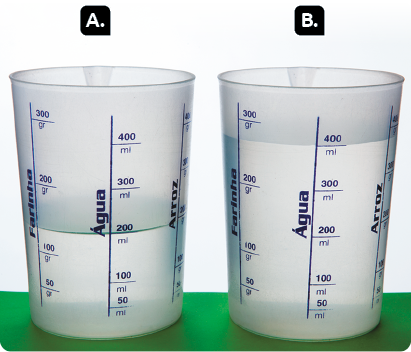
Questão 11. Qual dos dois recipientes
(A e B) contém maior volume de água? Justifique sua resposta.
O volume é uma medida que indica o espaço que um corpo ocupa. Assim, quanto maior o espaço ocupado pelo corpo, maior será seu volume.
Ao analisar a imagem dos recipientes contendo água, podemos afirmar que o B apresenta maior volume de água. Isso porque o espaço ocupado por essa matéria é maior que o ocupado por ela no recipiente A.
A unidade de medida padrão de volume, determinada pelo SI, é o metro cúbico . Em muitas situações do nosso cotidiano, no entanto, o volume também pode ser expresso em outras unidades de medida, como mililitros e litros .
Densidade
Para iniciarmos o estudo sobre densidade, realize a atividade prática proposta a seguir.
Vamos praticar
Materiais
- copo transparente
- água
- óleo
A. Coloque água até a metade do copo.
B. Adicione óleo até completar cerca de do copo.
C. Deixe o copo em repouso e verifique o que acontece.
Agora, faça o que se pede a seguir.
a) Relate o que você observou e explique o resultado.
O óleo é insolúvel em água. Por isso, ela não o dissolve. Além disso, eles têm densidades diferentes.
Página 158
Agora, analise o experimento a seguir.


Balança com copo contendo água (imagem A) e balança com copo contendo óleo de soja (imagem B).
Considere dois copos semelhantes, com a mesma capacidade. Em um deles foram adicionados de água e, no outro, de óleo de soja. Cada um dos copos foi colocado sobre uma balança a fim de verificar a massa deles.
A balança em que estava o copo com água (imagem A) registrou uma massa de ou . Já a balança com o copo com óleo de soja (imagem B) registrou uma massa de ou .
Questão 12. Por que o copo com água tem
massa maior do que o com óleo de
soja, apesar de em ambos terem sido adicionados os mesmos volumes de matéria?
A densidade é uma grandeza que expressa a relação entre a massa de um corpo em determinado volume. Ela é dada pela razão entre a massa do corpo e seu volume. Observe a seguir.
em que:
- d é a densidade;
- m é a massa do corpo;
- V é o volume do corpo.
No SI, a unidade de medida da densidade de um corpo é o quilograma por metro cúbico . No entanto, também é possível representar essa medida em gramas por centímetro cúbico , por exemplo.
Como se constatou, a densidade da água é maior do que a do óleo de soja. Ou seja, em determinado volume de água, há maior quantidade de massa do que no mesmo volume de óleo.
Página 159
Atividades
Faça as atividades no caderno.
1. Analise as afirmativas a seguir.
A. A massa é uma grandeza que representa o espaço ocupado pela matéria.
B. A densidade é uma grandeza que relaciona massa e volume de um corpo.
C. O volume é uma grandeza que representa a quantidade de matéria.
D. Massa e peso são sinônimos.
E. Massa, densidade e volume são propriedades da matéria.
Identifique a alternativa que apresenta a informação correta.
a) Somente a afirmativa E está correta.
b) Somente as afirmativas B, D e E estão corretas.
c) Todas as afirmativas estão incorretas.
d) Somente as afirmativas B e E estão corretas.
2. Considere uma situação hipotética de um veículo de comunicação ter publicado a manchete a seguir.
Astronautas pousam na superfície de Marte
a) A massa dos astronautas em Marte será diferente da que eles têm na Terra? E o peso? Por quê?
b) A manchete apresentada poderá ser uma realidade no futuro? Converse com um colega sobre isso, expondo sua opinião com base nos conhecimentos científicos sobre as condições que possibilitam a manutenção de vida em outros planetas.
3. O cubo de madeira mostrado na foto a seguir tem arestas de comprimento de e massa de .

a) Determine a densidade do cubo de madeira.
b) Qual seria a densidade de um cubo com aresta de feito com a mesma madeira? E a massa dele?
Página 160
4. Observe as situações a seguir e identifique a alternativa correta.


a) Na situação B, a densidade da esponja diminui, pois a mesma massa ficou concentrada em um volume maior.
b) Na situação B, o volume da esponja aumentou e a massa diminuiu quando ela foi pressionada.
c) Na situação B, a densidade da esponja aumentou, pois a mesma massa ficou concentrada em um volume menor.
d) Na situação B, o volume e a massa da esponja continuaram iguais, não ocorrendo alteração em relação à situação A.
5. Observe a imagem a seguir e, após responder ao item a, realize o experimento representado.

Dica!
Antes de iniciar o experimento, separe os materiais necessários e organize as etapas a serem executadas. Conforme realiza o experimento, anote suas observações no caderno.
a) Escreva em seu caderno as hipóteses sobre o que considera que acontecerá quando o copo for inserido dentro do balde.
b) O que aconteceu ao mergulhar o copo na água? Por que isso ocorreu?
c) Com base nos resultados observados, as suas hipóteses elaboradas no item a foram confirmadas ou rejeitadas?
d) O que você pode concluir com esse experimento?
e) Uma das propriedades da matéria é a impenetrabilidade. Ela nos mostra que dois corpos não podem ocupar, simultaneamente, um mesmo lugar no espaço. Explique a relação entre essa propriedade e os resultados obtidos com esse experimento.
Página 161
Constituição da matéria
Leia o trecho da reportagem a seguir.
[…]
A necessidade de medir o tempo com maior precisão, na área científica e em muitas atividades humanas, levou à criação de relógios baseados em certas propriedades dos átomos. Utilizados nas últimas décadas por alguns países mais desenvolvidos, os relógios atômicos permitiram até a criação de novo padrão para o segundo, hoje a grandeza física mais bem definida.
Agora, o Brasil entrou para esse seleto grupo: acaba de ser testado, com sucesso, o primeiro relógio atômico brasileiro, e já há estudos para a construção — o que poucos países estão fazendo — de um modelo mais avançado, em que a margem de erro é de apenas um segundo a cada três bilhões de anos.
[…]
TUBOY, Aparecida M. et al. O relógio atômico brasileiro. Instituto de Física de São Carlos, Universidade de São Paulo. Disponível em: https://oeds.link/5jtRMv. Acesso em: 14 abr. 2022.
Questão 13. Como o trecho da reportagem
pode ser relacionado com o tema Constituição da matéria?
A estrutura da matéria foi estudada por diversos filósofos. Entre eles, os gregos Leucipo (cerca de 500 a.C.-430 a.C.) e Demócrito (460 a.C.-370 a.C.). Esses estudiosos propuseram que a matéria era formada por pequenas partículas indivisíveis chamadas átomos – termo grego que significa indivisível.
O átomo é a menor partícula que caracteriza um elemento químico e que apresenta as propriedades específicas dele. Observe o exemplo a seguir.
Representações com elementos não proporcionais entre si. Cores-fantasia.



Representação de porção da barra de prata mostrando átomos de prata – imagem B – e representação de um átomo de prata – imagem C.
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Robson Mendes Matos. 9. ed. São Paulo: Pearson Prentice Hall, 2005. p. 120.
A barra de prata (imagem A) é composta por átomos de prata (imagem B). Se ampliássemos sucessivas vezes uma pequena porção dessa barra, por exemplo, chegaremos ao átomo de prata (imagem C). Esse átomo é a menor partícula da matéria que apresenta as propriedades e as características da prata.
Página 162
Modelos atômicos
As ideias sugeridas por Leucipo e Demócrito foram aceitas por vários anos. Ou seja, durante muito tempo, acreditou-se que o átomo fosse indivisível.
As ideias do átomo como uma estrutura indivisível só foram confrontadas quando novos estudos, com base em experimentos e observações, possibilitaram aos cientistas desenvolver modelos. Esses modelos representavam a estrutura dos átomos e descreviam algumas de suas características.
A seguir, vamos conhecer os principais modelos criados pelos cientistas ao longo do tempo para representar a estrutura do átomo.
Modelo atômico de Dalton
Em 1803, o químico inglês John Dalton (1766-1844) propôs uma teoria que reafirmou o pensamento grego sobre a existência de átomos. Ela ficou conhecida como teoria atômica de Dalton e trazia as propostas apresentadas a seguir.
- Todo elemento químico é formado por partículas extremamente pequenas chamadas átomos.
- Todos os átomos de um determinado elemento químico são idênticos. Ou seja, átomos de diferentes elementos químicos são diferentes uns dos outros e têm propriedades também distintas.
- Os átomos de um elemento químico não podem ser criados, destruídos ou transformados em átomos de outro elemento químico em reações químicas.
- Dois ou mais elementos químicos são capazes de formar um composto. Cada composto sempre tem o mesmo número relativo de átomos.


Representação não proporcional. Cor-fantasia.
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 44.
Com base na teoria proposta por Dalton, concluiu-se que o modelo sugerido por ele considerava o átomo uma esfera maciça, homogênea, indivisível e indestrutível. Além disso, essa teoria propõe que todo elemento químico apresenta determinada massa. Esse modelo atômico ficou conhecido como bola de bilhar.
Página 163
A teoria proposta por Dalton foi aceita pela comunidade científica até o final do século XIX, quando sucessivos estudos mostraram que o átomo não era uma partícula indivisível e imutável.
Outros modelos foram criados, substituindo o modelo atômico de Dalton. Apesar disso, algumas das ideias expressas nessa teoria são aceitas até os dias de hoje. A teoria de Dalton também foi de grande importância para o conhecimento científico. Isso porque forneceu respostas satisfatórias a diversos problemas químicos da época e incentivou a comunidade científica a investigar a estrutura dos átomos.
Modelo atômico de Thomson
No final do século XIX, cientistas como o químico inglês William Crookes (1832-1919) e o físico inglês Joseph Thomson (1856-1940) realizaram experimentos para compreender a estrutura do átomo.

Crookes e Thomson evidenciaram que os átomos apresentavam uma porção carregada positivamente e outra carregada negativamente. A presença de cargas elétricas era um fato ainda não esclarecido na época. Por isso, surgiram mais dúvidas sobre a constituição e a estrutura dos átomos.
Um dos experimentos realizados por Crookes utilizava um tubo contendo gás e dois eletrodos✚, os quais permitiam submeter o gás a altas tensões elétricas. Esse experimento ficou conhecido como tubo de Crookes. Por meio dele, o cientista percebeu que havia um fluxo de partículas pelo gás, os chamados raios catódicos✚. Verificou também que esse fluxo estava relacionado à emissão de luz dentro do tubo, o que sugeria a natureza elétrica da matéria.
Glossário
Página 164
Thomson realizou diversos experimentos com o tubo de Crookes. Observe a representação de um deles a seguir.
Em um de seus experimentos com o tubo de Crookes, Thomson observou que os raios catódicos eram desviados ao passar entre placas de metais eletricamente carregadas. Esse desvio ocorria em direção à placa carregada positivamente. Logo, Thomson concluiu que as partículas do raio catódico tinham carga elétrica negativa.
Representação com elementos não proporcionais entre si. Cores-fantasia.
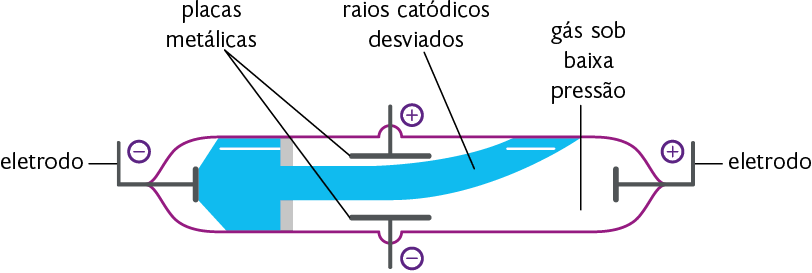
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. 9. ed. São Paulo: Education do Brasil, 2016 p. 45.
Após diversos estudos sobre esse fenômeno, Thomson concluiu que a luz observada nos experimentos com o tubo de Crookes era emitida em virtude do deslocamento de partículas carregadas negativamente. Ele também constatou que elas estavam presentes em toda matéria.
Diante dessas observações, em 1897, Thomson sugeriu um modelo atômico. De acordo com ele, o átomo seria uma esfera carregada positivamente. Imersas nessa esfera, havia partículas com carga elétrica negativa, as quais posteriormente foram chamadas elétrons. Para Thomson, esses elétrons poderiam ser facilmente removidos dos átomos. Por isso, nesse modelo, o átomo passou a ser considerado divisível.
Representação com elementos não proporcionais entre si. Cores-fantasia.
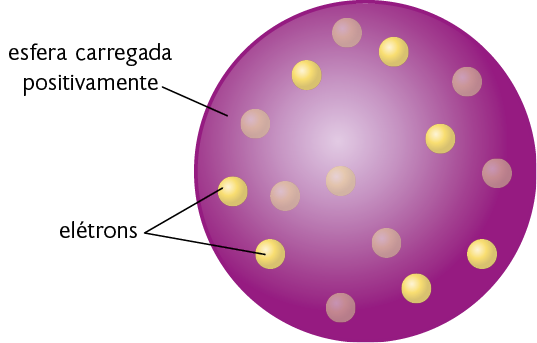
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas, Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 48.
Página 165
Modelo atômico de Rutherford
O modelo atômico de Thomson foi aceito pela comunidade científica por alguns anos. No entanto, experimentos realizados no início do século XX por cientistas como o neozelandês Ernest Rutherford (1871-1937) contestaram o modelo proposto por Thomson.

Observe a seguir um dos experimentos realizados por Rutherford.
Representação com elementos não proporcionais entre si. Cores-fantasia.
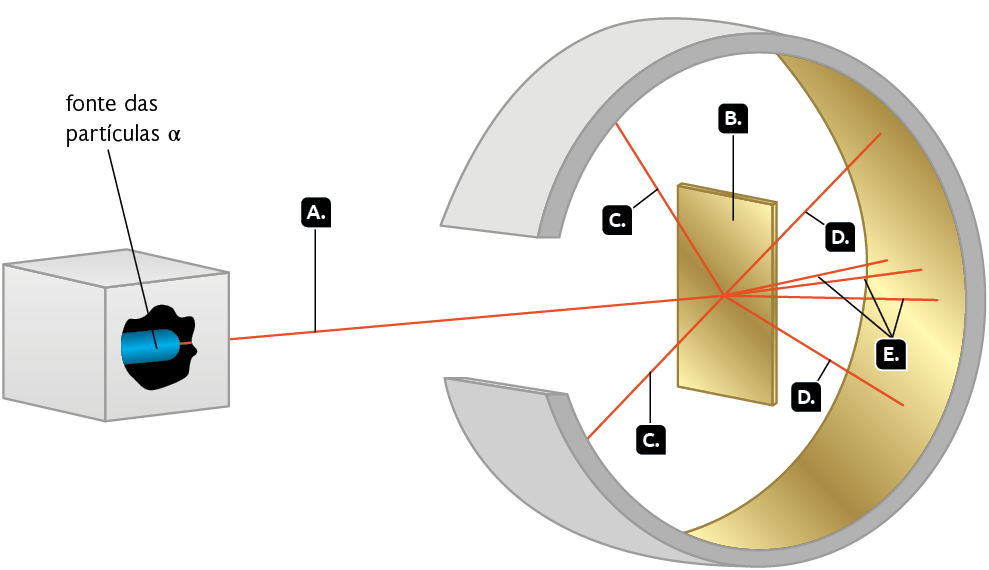
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 49.
Rutherford incidiu um feixe de partículas positivas, chamadas partículas alfa (A), sobre uma fina lâmina de ouro (B). Uma pequena porção das partículas (C) foi refletida pela lâmina. Algumas sofreram desvios em sua trajetória (D), enquanto a maioria das partículas positivas atravessou a lâmina (E).
Durante a análise dos resultados obtidos, Rutherford propôs três conclusões. Elas se baseavam no comportamento das partículas positivas durante o experimento realizado e ajudaram a propor a estrutura do átomo. Observe a seguir.
Página 166
Representação com elementos não proporcionais entre si. Cores-fantasia.
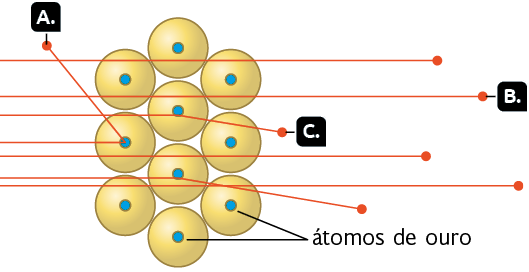
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 49.
A. A reflexão de algumas partículas ocorria porque elas atingiam diretamente a região pequena e densa do átomo.
B. Algumas partículas positivas conseguiam atravessar a lâmina de ouro porque elas incidiam nos espaços praticamente vazios no átomo. Eles continham os elétrons.
C. As partículas que sofriam desvios eram aquelas que se aproximavam de uma região dos átomos que contém partículas de mesma carga, ou seja, positiva.
Com base nos resultados de seus experimentos, Rutherford percebeu que, diferentemente do proposto pelo modelo atômico de Thomson, as cargas positivas não estavam espalhadas por todo o átomo. Elas estavam concentradas em uma região que Rutherford chamou de núcleo. Em 1919, esse cientista deu o nome de prótons às partículas positivas do átomo.
Assim, de acordo com Rutherford, o átomo consistia em um pequeno núcleo com prótons, ou seja, partículas de carga positiva. No núcleo se concentrava a maior parte da massa do átomo.
O volume ao redor do núcleo apresentava espaços vazios, que correspondiam à maior porção do átomo e onde os elétrons – partículas de carga negativa – se movimentavam.
Representação com elementos não proporcionais entre si. Cores-fantasia.
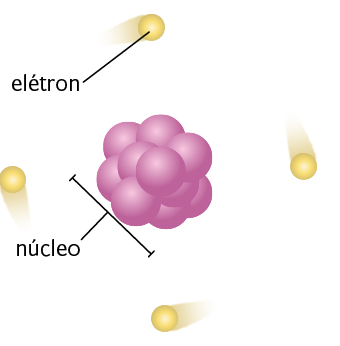
Fonte de pesquisa: MODELO atômico de Rutherford. Enciclopédia Britânica. Disponível em: https://oeds.link/pi9SKk. Acesso em: 27 fev. 2022.
Em 1932, o físico inglês James Chadwick (1891-1974) descobriu que existiam partículas no núcleo atômico que não tinham carga elétrica. Elas foram denominadas nêutrons e, juntamente com os prótons, compunham toda a massa do núcleo de um átomo. Além disso, Chadwick verificou que o valor da massa de um nêutron é praticamente o mesmo da de um próton.
Página 167
Modelo atômico de Rutherford-Bohr
O modelo atômico proposto por Rutherford continha importantes informações relativas ao núcleo e às cargas positivas dos átomos. No entanto, ainda no início do século XX, houve diversas tentativas de explicar o comportamento dos elétrons, ou seja, das cargas negativas.
O físico dinamarquês Niels Bohr (1885-1962) foi o primeiro cientista a apresentar um modelo que representasse o comportamento dos elétrons nos átomos.

Bohr propôs que, em um átomo, o elétron se moveria em órbita circular ao redor do núcleo atômico, não estando totalmente livre para obter qualquer quantidade de energia. Isso porque, de acordo com esse cientista, os elétrons poderiam conter apenas quantidades específicas de energia.
Assim, Bohr desenvolveu para o átomo de hidrogênio um modelo atômico que tem um conjunto de níveis de energia, representados pelas circunferências em torno do núcleo atômico. Nesse modelo, os elétrons de cada nível apresentam determinada quantidade de energia — quanto mais afastados do núcleo, maior é a quantidade de energia que eles têm. Além disso, segundo Bohr, um elétron pode mudar momentaneamente de nível quando absorve ou libera energia.
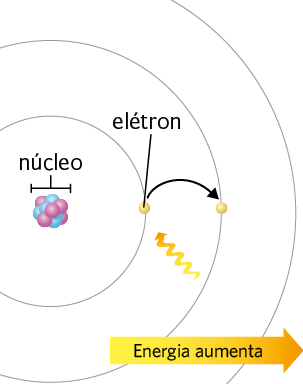
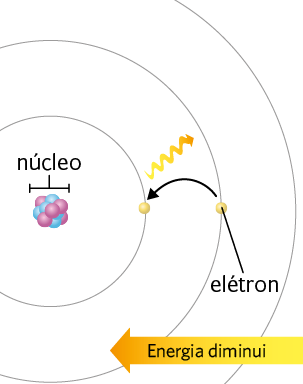
Representações simplificadas do átomo de hidrogênio, com os diferentes níveis de energia, e das mudanças de nível realizadas por um elétron: absorvendo energia (imagem A) e liberando energia (imagem B). Nessas imagens, a seta tortuosa representa a energia absorvida ou liberada durante a transição do elétron entre os níveis de energia.
Fonte de pesquisa: TIPLER, Paul A.; LLEWELLYN, Ralph A. Física moderna. Tradução: Ronaldo Sérgio de Biasi. 3. ed. Rio de Janeiro: LTC, 2001. p. 117.
Representações com elementos não proporcionais entre si. Cores-fantasia.
A. Ao absorver energia, o elétron "salta" para um nível de energia mais afastado do núcleo.
B. Ao "saltar" para um nível de energia mais próximo ao núcleo, o elétron libera energia, como na forma de luz.
Página 168
De acordo com o modelo de Rutherford-Bohr, a maior região do átomo fica ao redor do núcleo e contém os elétrons. Ela é chamada eletrosfera. Nela, os elétrons estão em constante movimento. Já as regiões da eletrosfera com maior probabilidade de se encontrar elétrons são conhecidas como camadas eletrônicas ou níveis de energia.
O núcleo do átomo é constituído de prótons, partículas de carga positiva, e de nêutrons, partículas eletricamente neutras. O número de nêutrons pode ser diferente do de prótons.
Observe a seguir uma representação simplificada do átomo, baseada no modelo de Rutherford-Bohr.
Representação com elementos não proporcionais entre si. Cores-fantasia.
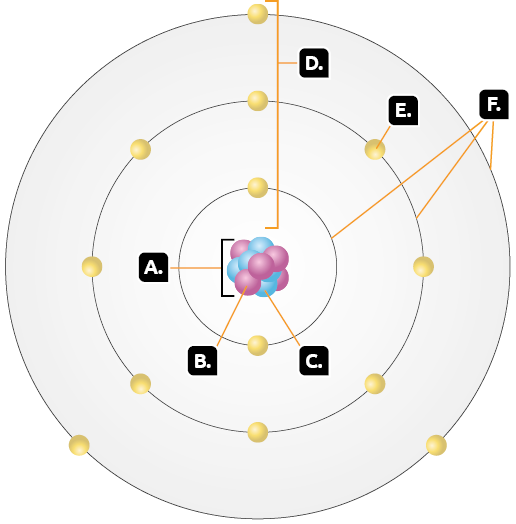
De acordo com esse modelo atômico, o átomo consiste em um núcleo central (A) composto por prótons (B) e nêutrons (C).
Na eletrosfera (D) estão os elétrons (E), distribuídos em níveis de energia (F).
Fonte de pesquisa: ATOMIC models. University of New South Wales. Disponível em: https://oeds.link/nfQ7tD. Acesso em: 12 abr. 2022.
Os estudos sobre a estrutura e a composição da matéria são muito importantes, pois, além de permitir a criação de diferentes modelos atômicos, auxiliam na compreensão de diversos fenômenos, como os relacionados à eletricidade.
Questão 14. Considerando que, em um átomo,
o número de
prótons é igual ao de elétrons, o que você pode concluir quanto à carga
elétrica desse átomo?
Os átomos dos elementos químicos conhecidos atualmente, no estado fundamental✚, podem ter até sete níveis de energia. Cada um deles é designado, respectivamente, pelas letras K, L, M, N, O, P e Q, seguindo essa ordem desde a camada mais próxima do núcleo até a mais distante.
- Estado fundamental:
- nesse caso, refere-se ao estado de menor energia do átomo e no qual ele se encontra mais estável, ou seja, aquele em que seus elétrons estão nos níveis mais baixos de energia possíveis.↰
Página 169
Para os elementos químicos conhecidos e no estado fundamental, a quantidade máxima de elétrons que pode ocupar cada nível de energia é apresentada no quadro a seguir.
|
Nível de energia |
Quantidade máxima de elétrons |
|---|---|
|
K |
2 |
|
L |
8 |
|
M |
18 |
|
N |
32 |
|
O |
32 |
|
P |
18 |
|
Q |
8 |
A distribuição dos elétrons nos níveis de energia é realizada respeitando diversas regras, como a quantidade máxima de elétrons admitida em cada nível. De modo geral, nem todos os átomos têm os sete níveis de energia apresentados.
Além de estarem associados às regiões da eletrosfera com maior probabilidade de encontrarem os elétrons, os níveis de energia também estão relacionados à energia dos elétrons. Por exemplo, um elétron que está no nível L tem maior quantidade de energia do que um elétron que se encontra no nível K.
Observe a imagem a seguir e responda às questões propostas.
Representações com elementos não proporcionais entre si. Cores-fantasia.
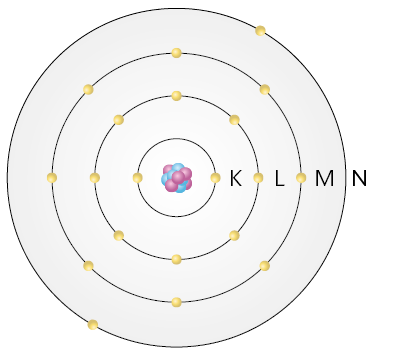

Representações simplificadas da estrutura do átomo de cálcio (imagem A) e da estrutura do átomo de hidrogênio (imagem B).
Fonte de pesquisa: ATOMIC models. University of New South Wales. Disponível em: https://oeds.link/nfQ7tD. Acesso em: 12 abr. 2022.
Fonte de pesquisa: SALMERON, Roberto A. A estrutura atômica. Centro de ensino e pesquisa aplicada, USP. Disponível em: https://oeds.link/iaI6fh. Acesso em: 28 fev. 2022.
Questão 15. Quantos e quais níveis de
energia os átomos de
cálcio e de hidrogênio têm?
Questão 16. Quantos elétrons cada um dos
átomos
representados tem em cada nível de energia?
Página 170
Íons
Um átomo eletricamente neutro apresenta a mesma quantidade de prótons e de elétrons. No entanto, em algumas situações, um átomo pode ceder ou receber elétrons, passando a ser chamado íon.
Quando um átomo cede um elétron, seu número de prótons passa a ser maior que o de elétrons. Como o próton tem carga positiva, o átomo fica carregado positivamente, originando um íon chamado cátion. Observe a seguir.
Representações com elementos não proporcionais entre si. Cores-fantasia.
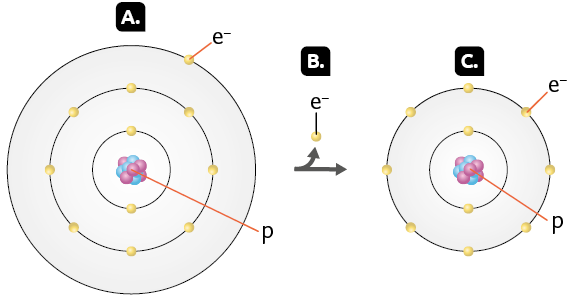
O átomo de sódio neutro (imagem A) contém 11 prótons e 11 elétrons .
Ao perder um elétron (imagem B), o átomo de sódio passa a apresentar 11 prótons e 10 elétrons, formando o cátion sódio (imagem C).
Fonte de pesquisa: TREFIL, James; HAZEN, Robert M. Física viva: uma introdução à física conceitual. Tradução: Ronaldo Sérgio de Biasi. Rio de Janeiro: LTC, 2006. v. 3. p. 49.
Quando um átomo recebe um elétron, a quantidade de elétrons passa a ser maior que a de prótons. Como o elétron tem carga negativa, o átomo fica carregado negativamente, originando um íon chamado ânion. Observe a seguir.
Representações com elementos não proporcionais entre si. Cores-fantasia.
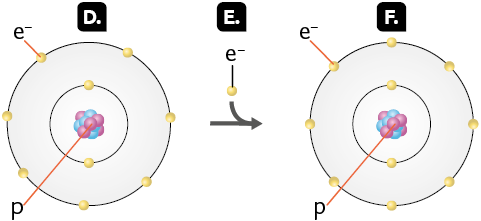
O átomo de flúor neutro (imagem D) contém 9 prótons e 9 elétrons.
Ao ganhar um elétron (imagem E), o átomo de flúor passa a apresentar 9 prótons e 10 elétrons, formando o ânion flúor (imagem F).
Fonte de pesquisa: TREFIL, James; HAZEN, Robert M. Física viva: uma introdução à física conceitual. Tradução: Ronaldo Sérgio de Biasi. Rio de Janeiro: LTC, 2006. v. 3. p. 49.
Os íons são representados com um sinal sobrescrito ao símbolo do elemento químico. Os cátions apresentam um sinal positivo, e os ânions, um sinal negativo. O número que aparecer acompanhando esses sinais indica a quantidade de elétrons que o elemento cedeu ou recebeu. Leia os exemplos a seguir.
- : o átomo de potássio cedeu um elétron.
- : o átomo de oxigênio recebeu dois elétrons.
Página 171
Propriedades dos átomos
Observe as fotos a seguir.
Representações com elementos não proporcionais entre si. Cores-fantasia.


Questão 17. Em sua opinião, os objetos
apresentados nas
fotos A
e B são
compostos pelo mesmo tipo de material?
Justifique sua resposta.
Questão 18. O que você pode dizer a
respeito dos átomos
que compõem os metais apresentados nas imagens A e B?
Cada elemento químico que compõe a matéria apresenta características próprias. Em geral, essas características não são visíveis. No entanto, em alguns casos, certas características podem se apresentar de maneira bastante clara, como as cores no caso do alumínio (imagem A) e do cobre (imagem B).
Tanto o cobre quanto o alumínio são metais. Se analisarmos os átomos desses materiais, perceberemos que eles também apresentam propriedades distintas, como número atômico e número de massa.
Número atômico (Z)
Cada elemento químico apresenta um número fixo de prótons em seu núcleo atômico. Sendo assim, todos os átomos de um mesmo elemento químico têm o mesmo número de prótons em seu núcleo. Por exemplo, todos os átomos que apresentarem 29 prótons em seu núcleo serão átomos do elemento químico cobre. Já todos os átomos que tiverem 13 prótons em seu núcleo serão do elemento químico alumínio.
O que difere um elemento de outro é, portanto, o número de prótons existentes em seu núcleo. No estudo da Química, o número de prótons no núcleo de um átomo é chamado número atômico e é representado por Z.
Número de massa (A)
O núcleo de um átomo contém prótons e nêutrons , constituindo, aproximadamente, toda a massa do átomo. A massa dos elétrons é tão pequena em relação à do núcleo que, geralmente, não é considerada.
Página 172
A soma do número de prótons e do de nêutrons é denominada número de massa. Ele é dado pelas fórmulas apresentadas a seguir.
ou
em que:
- A é o número de massa;
- p é o número de prótons no núcleo do átomo;
- n é o número de nêutrons no núcleo do átomo;
- Z é o número atômico.
Observe esses símbolos na notação a seguir, considerando que X representa um elemento químico qualquer.
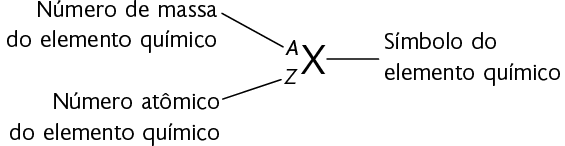
Questão 19. Qual é o número de prótons e de nêutrons do elemento químico ouro ? Faça os cálculos no caderno.
Você estudou que um elemento químico é caracterizado pelo seu número atômico, que é fixo para cada elemento. No entanto, isso não vale para o número de massa, que pode variar entre os átomos de uma amostra natural de determinado elemento químico. Isso ocorre porque os átomos podem ter números variados de nêutrons.
Como exemplo, podemos citar o carbono . Existem quinze tipos diferentes de átomos de carbono. Porém, apenas três são naturais: o carbono-12 , o carbono-13 e o carbono-14 . Neles, os números atômicos são iguais, mas o número de massa varia. Por isso, eles são chamados isótopos.
Sugestões complementares
Acesse o simulador Monte um átomo, disponível no site PhET – Interactive simulations, da University of Colorado Boulder. Esse simulador oferece três opções: "Construir átomo", "Símbolo" e "Jogo". Nelas, você pode, por exemplo, adicionar partículas a um átomo e descobrir a qual elemento químico ele se refere, explorar a representação dos átomos e descobrir o elemento químico relativo a determinadas informações.
Disponível em: https://oeds.link/AQomX1. Acesso em: 7 jun. 2022.
Página 173
Alquimia
Entre os séculos III a.C. e XVI d.C., foram desenvolvidas diversas técnicas cujo objetivo era promover a transformação da matéria. O conjunto delas foi convencionalmente chamado alquimia e recebeu influência da filosofia grega, do misticismo oriental e da tecnologia egípcia.
Os alquimistas combinavam conhecimentos de diferentes áreas, como astrologia, Filosofia, misticismo, Arte, metalurgia, Física, Química, Medicina e religião. Os principais objetivos dos praticantes da alquimia era encontrar a pedra filosofal, que teria o poder de transformar metais em ouro, e produzir o elixir da vida eterna, capaz de curar qualquer doença.
Enquanto buscavam alcançar esses objetivos, os alquimistas colaboraram imensamente para o desenvolvimento de muitas técnicas químicas, além de terem descoberto diferentes elementos e substâncias químicas. Alguns equipamentos e técnicas utilizados atualmente em laboratórios são criações dos alquimistas, como a trituração, a sublimação e a destilação. Os alquimistas foram inspiração inclusive para a Arte. Observe a pintura a seguir.

A passagem da alquimia para a Química se caracterizou pela introdução de procedimentos relacionados aos métodos científicos, favorecendo, assim, uma ciência aberta, racional, precisa e livre de misticismo.
a) De acordo com o texto, podemos afirmar que os conhecimentos elaborados pelos alquimistas apresentavam embasamento científico?
Página 174
Atividades
Faça as atividades no caderno.
1. Associe cada um dos estudiosos apresentados a seguir (1 a 4) às descrições de seus respectivos modelos atômicos (A a D). Para isso, forme os pares de letras e números.
1. Rutherford
2. Thomson
3. Rutherford-Bohr
4. Dalton
A. Propôs que os átomos eram estruturas semelhantes a esferas maciças, homogêneas, indivisíveis e indestrutíveis.
B. Propôs que o átomo era uma esfera carregada positivamente. Imersas nessa esfera estão partículas com carga negativa, os elétrons, que podiam ser facilmente removidas dos átomos.
C. Propôs que o átomo consiste em um pequeno núcleo com partículas positivas – os prótons –, envolto por uma região em que os elétrons estão em constante movimento.
D. Propôs que os elétrons, que se distribuem em torno do núcleo, não estão distribuídos de forma aleatória. Essas partículas de carga negativa realizam movimentos circulares em regiões mais definidas, chamadas níveis de energia.
2. A imagem a seguir é a representação de um átomo com base no último modelo estudado neste capítulo, observe.
Representação com elementos não proporcionais entre si. Cores-fantasia.

Fonte de pesquisa: TREFIL, James; HAZEN, Robert M. Física viva: uma introdução à física conceitual. Tradução: Ronaldo Sérgio de Biasi. Rio de Janeiro: LTC, 2006. v. 3. p. 19.
Identifique a alternativa que apresenta a associação correta dos nomes das regiões indicadas na imagem.
a) A - eletrosfera; B - elétrons; C - níveis de energia ou camadas; D - núcleo; E - próton; F - nêutron.
b) A - eletrosfera; B - níveis de energia ou camadas; C - elétron; D - núcleo; E - nêutron; F - próton.
c) A - núcleo; B - níveis de energia ou camadas; C - elétron; D - eletrosfera; E - nêutron; F - próton.
d) A - eletrosfera; B - níveis de energia ou camadas; C - elétron; D - núcleo; E - próton; F - nêutron.
Página 175
3. Leia o trecho da reportagem a seguir e em seguida responda às questões.
[...] vamos relembrar, de modo simples, a essência da luminescência. Esse fenômeno ocorre quando um material (orgânico, inorgânico, composto etc.) absorve energia na forma de luz. Ao fazer isso, os elétrons dos átomos que formam o material ficam excitados e "saltam" para uma camada eletrônica mais energética.
Ao retornarem a camada "original" (dita de valência), essas partículas devolvem ao meio - agora, na forma de luz visível - a energia absorvida.
[...]
JÚNIOR, Severiano Alves; SILVA, José Yago Rodrigues. Sensores luminescentes: confiáveis para detectar explosivos?. Ciência Hoje, Rio de Janeiro, Instituto Ciência Hoje, n. 356, jul. 2019. p. 12.
a) Qual dos modelos atômicos estudados neste capítulo consegue explicar o fato apresentado no trecho da reportagem?
b) Quando o átomo absorve e emite determinada quantidade de energia, ele se transforma em algum tipo de íon? Justifique sua resposta.
4. O estudo dos átomos não se encerrou com a proposição do modelo atômico de Rutherford-Bohr. Ao longo dos anos, diversos pesquisadores investigaram essa partícula, como a física alemã Maria Goeppert-Mayer (1906-1972).

Junte-se a um colega e façam um levantamento biográfico dessa pesquisadora. Em seguida, elaborem um texto dissertativo sobre biografia de Goeppert-Mayer. Ele deve conter, necessariamente, as informações listadas a seguir.
Informações sobre a vida da pesquisadora.
Dificuldades que enfrentou para desenvolver seus estudos na época.
Visão que a sociedade tinha da mulher nesse período.
Parte do átomo cujo estudo rendeu a Goeppert-Mayer o Prêmio Nobel de Física.