Página 190
CAPÍTULO
8 Transformações da matéria
Observe as imagens a seguir.


Questão 1. Qual é a principal diferença
entre o ouro mostrado na imagem A e B?
Como estudamos, a matéria é tudo aquilo que tem massa e ocupa lugar no espaço, apresentando diferentes propriedades. Além disso, a matéria também pode passar por transformações físicas ou químicas.
Por exemplo, como você pode ter notado, na imagem A, o ouro está no estado físico líquido. Isso ocorre após a substância no estado físico sólido ser aquecido, atingindo aproximadamente . No estado líquido, ele pode ser colocado em uma forma e ser resfriado novamente, tornando-se sólido, como mostrado na imagem B.
As transformações do ouro retratadas nas imagens A e B são físicas, pois, apesar de ele mudar de estado físico, continua tendo a mesma composição química.
Já as transformações químicas envolvem mudanças na composição das substâncias. Nelas, uma ou mais substâncias são transformadas em uma ou mais substâncias quimicamente diferentes das originais.
Por exemplo, quando deixamos um objeto de ferro exposto ao ar atmosférico, sem proteção, o gás oxigênio e a água existentes no ar podem reagir com o ferro . Como resultado, forma-se uma nova substância: o óxido de ferro(III) , conhecido como ferrugem.

Página 191
Estados físicos da matéria
Como estudamos, a matéria pode mudar de estado físico sem alterar a sua composição química.
Na imagem a seguir, é possível perceber a água presente no ambiente em diferentes estados físicos. Em todos esses estados físicos, ela mantém suas propriedades químicas, pois permanece sendo a mesma substância. Porém, as propriedades físicas são diferentes, uma vez que elas dependem do estado físico da matéria.

O vapor de água presente no ar (A) representa a água no estado físico gasoso.
O iceberg (B) representa a água no estado físico sólido.
Já o lago (C) representa o estado líquido da substância.
Os diferentes estados físicos estão relacionados à organização, às interações e aos movimentos das partículas que compõem a matéria. Cada uma das mudanças de estado físico da matéria recebe um nome, como indicado na imagem a seguir.
Representação com elementos não proporcionais entre si. Cores-fantasia.
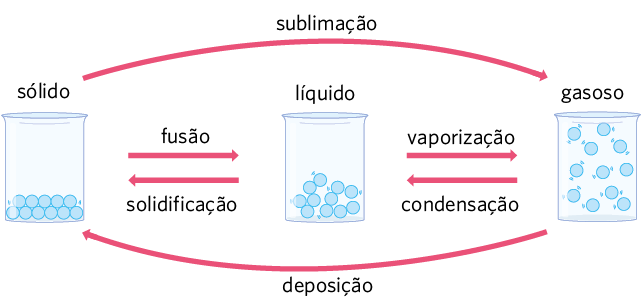
Fonte de pesquisa: TREFIL, James; HAZEN, Robert M. Física viva: uma introdução à física conceitual. Tradução: Ronaldo Sérgio de Biasi. Rio de Janeiro: LTC, 2006. v. 1. p. 247.
Página 192
A seguir, vamos estudar as propriedades físicas da matéria em cada estado físico.
Estado físico líquido
No estado físico líquido, as partículas da matéria encontram-se próximas entre si, mas apresentam maior liberdade para se deslocar e menor força de atração em relação às partículas que compõem a matéria no estado físico sólido. Além disso, no estado físico líquido, o material tem volume definido e suas partículas se movimentam rapidamente, distribuindo-se de modo menos ordenado. Isso permite que os líquidos assumam o formato do recipiente que os contém.
Observe as imagens a seguir.
Representação com elementos não proporcionais entre si. Cores-fantasia.

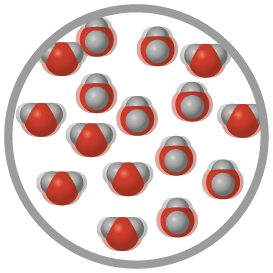
Copo com água no estado físico líquido (imagem A) e representação das moléculas da água no estado físico líquido (imagem B).
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 7.
Note que a água no estado físico líquido adquire o formato do copo (imagem A) e que suas moléculas se distribuem de maneira desordenada e realizam movimentos rápidos (imagem B).
Estado físico sólido
No estado físico sólido, em geral, as partículas encontram-se mais próximas entre si (com exceção da água) e dispostas de maneira mais organizada do que quando estão no estado físico líquido. Assim, no estado físico sólido, as partículas não são livres para realizar grandes movimentos, vibrando menos intensamente que as no estado físico líquido.
Nos sólidos, as forças de atração entre partículas são mais intensas do que nos líquidos. Essa forte interação dificulta a troca de posições das partículas, mantendo seu formato e seu volume definidos.
Página 193
Confira o exemplo do ferro no estado físico sólido.
Representação com elementos não proporcionais entre si. Cores-fantasia.


Barras de ferro (imagem A) e representação da organização dos átomos de ferro no estado físico sólido (imagem B).
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. Tradução: Noveritis do Brasil. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 233.
Como você pôde perceber na imagem B, as partículas de ferro estão bem próximas entre si, resultando em formato e volume bem definidos, o que caracteriza o estado físico sólido. No entanto, há uma exceção significativa dessa regra: a água. Diferentemente do que ocorre em outras substâncias, as partículas que a constituem no estado físico sólido se organizam de modo a gerar espaços vazios, levando a um aumento de volume e, consequentemente, a uma redução de densidade.
Observe a seguir.
Representação com elementos não proporcionais entre si. Cores-fantasia.

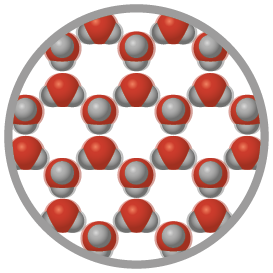
Cubos de gelo (imagem C) e representação das moléculas de água no estado físico sólido (imagem D).
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 7.
Podemos verificar esse comportamento anômalo✚ da água quando colocamos gelo em um copo com água. Nesse caso, o gelo, que corresponde ao estado físico sólido da água, flutua por apresentar menor densidade do que a água no estado líquido.
Glossário
Página 194
Outra situação é quando colocamos uma garrafa cheia de água no congelador por algumas horas. A passagem da água do estado líquido para o estado sólido resulta em um aumento de volume. Como resultado, em alguns casos, pode ocorrer o rompimento da garrafa.
Questão 2. Converse com um colega a
respeito do motivo de os icebergs flutuarem nos corpos de água.
Estado físico gasoso
No estado físico gasoso, as partículas da matéria encontram-se mais afastadas entre si do que nos estados físicos sólido e líquido. Por essa razão, elas apresentam menor força de atração e maior liberdade para se deslocar do que aquelas nos outros dois estados físicos da matéria. Esse deslocamento ocorre de modo desordenado, e a interação das partículas se dá, principalmente, por colisões.
Por ter maior liberdade de deslocamento, as partículas da matéria no estado físico gasoso ocupam todo o volume do recipiente que a contém, não apresentando volume e formato definidos.
Observe a seguir.
Representação com elementos não proporcionais entre si. Cores-fantasia.

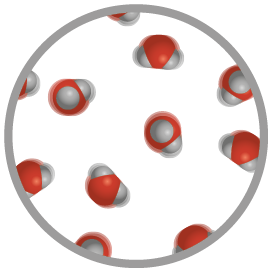
Chaleira com água em ebulição (imagem A) e representação da organização das moléculas de água no estado físico gasoso (imagem B). Na imagem A, a névoa que sai da chaleira não é o vapor de água em si, pois ele não é visível a olho nu. O que é visível são as gotículas de água que estão sendo carregadas por esse vapor.
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 7.
Como mostrado na imagem B, as moléculas de água encontram-se bem afastadas umas das outras, caracterizando o estado físico gasoso. Os materiais nesse estado físico, como o vapor de água e vários gases, apresentam alta compressibilidade, ou seja, podem ser comprimidos, reduzindo seu volume. Ao reduzir o volume de um gás, a distância entre suas partículas diminui, o que causa maior interação entre elas.
A matéria pode mudar de um estado físico para outro. A seguir, vamos estudar algumas dessas mudanças.
Página 195
Fusão e solidificação
A mudança de estado físico sólido para o estado físico líquido é chamada fusão.
Observe as imagens a seguir.


Para que a fusão aconteça, a matéria deve receber energia, o que resulta no aumento da temperatura da matéria. Por exemplo, para fundir o ferro, a temperatura deve ser elevada até . Para ocorrer a fusão, deve-se chegar à chamada temperatura de fusão. Assim como o ferro, cada matéria tem um ponto de fusão específico.
Como estudamos, de modo geral, no estado físico sólido, as partículas da matéria encontram-se mais próximas umas das outras, e as forças de atração entre elas são mais intensas. Quando a matéria recebe energia térmica de uma fonte de calor, suas partículas passam a se movimentar mais intensamente, até que a força de atração existente entre elas não seja suficiente para mantê-las próximas.
Nesse caso, as partículas começam a se distanciar, e a matéria, que estava no estado sólido, torna-se líquida, adquirindo o formato do recipiente que a contém.
Observe a seguir.
Representação com elementos não proporcionais entre si. Cores-fantasia.

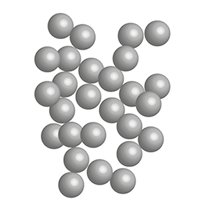
Representação da organização das partículas de ferro no estado físico sólido (C) e no estado físico líquido (D), em temperatura ambiente.
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. Tradução: Noveritis do Brasil. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 233.
O oposto à fusão também ocorre na matéria. A mudança de estado físico líquido para o estado físico gasoso é chamada solidificação. Assim como na fusão, essa mudança é influenciada pela temperatura.
Página 196
Para que ocorra a solidificação, é necessário reduzir a temperatura da matéria. Dessa maneira, à medida que a matéria no estado físico líquido cede energia térmica para o ambiente ou para outro corpo, a movimentação das partículas diminui. Isso possibilita que as forças de atração entre elas unam essas partículas, praticamente fixando-as.
Para que ocorra a solidificação da matéria, deve-se chegar à chamada temperatura de solidificação, que é específica para cada matéria.
Vaporização e condensação
A mudança de estado físico líquido para o estado físico gasoso é chamada vaporização. Ela pode ocorrer de maneiras distintas. Vamos estudar algumas delas a seguir.
Quando uma panela com água é colocada sobre a chama de um fogão, depois de certo tempo, ocorre a formação de bolhas no interior do líquido.
Isso caracteriza a ebulição. Nesse processo, a matéria recebe energia térmica, aumentando a sua temperatura, o que resulta no movimento intenso de suas partículas.
Além disso, a tendência de escape das partículas também aumenta, até que se formem bolhas em todo o líquido, como mostra a imagem B.
Representação com elementos não proporcionais entre si. Cores-fantasia.

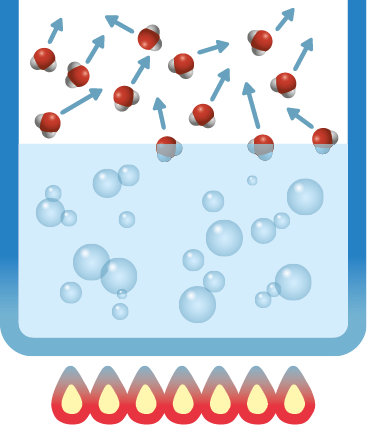
Panela com água em ebulição sobre a chama de um fogão (imagem A) e representação do processo de ebulição da água (imagem B). Nesse esquema, as estruturas acima da superfície da água líquida do recipiente representam as moléculas de água, enquanto as setas mostram o sentido em que elas se movem, nesse caso, de modo aleatório.
Fonte de pesquisa: TERMODINÂMICA química. Portal Laboratórios Virtuais de Processos Químicos. Disponível em: https://oeds.link/qpuqZ1. Acesso em: 27 abr. 2022.
Página 197
A evaporação é o processo mais lento da vaporização e ocorre na superfície dos líquidos, diferentemente da ebulição, que ocorre em todo o volume do líquido.
Podemos identificar a evaporação, por exemplo, quando, após a chuva, a água sobre a calçada ou o asfalto é aquecida pelo calor proveniente do Sol e evapora.

A evaporação também ocorre na secagem das roupas que deixamos no varal. As moléculas de água com maior energia se desprendem da parte líquida e se transformam em vapor de água, que se dissipa no ambiente. Como resultado desse processo, elimina-se a água dos tecidos e ocorre a secagem das roupas.
Durante o aquecimento da matéria, caso as partículas perto da superfície do líquido se agitem suficientemente para vencer as forças de atração exercidas pelas partículas vizinhas, elas se desprendem do líquido e se espalham na atmosfera na forma gasosa.
Representação com elementos não proporcionais entre si. Cores-fantasia.
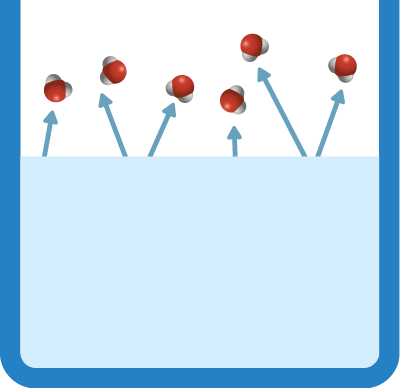
Fonte de pesquisa: TERMODINÂMICA química. Portal Laboratórios Virtuais de Processos Químicos. Disponível em: https://oeds.link/eyL7TR. Acesso em: 27 abr. 2022.
O oposto à vaporização também ocorre na matéria. A mudança de estado físico gasoso para o estado físico líquido é chamada condensação.
A condensação ocorre quando as partículas da matéria no estado físico gasoso cedem energia para o ambiente ou outros corpos com temperatura menor. Como resultado, essas partículas passam a se movimentar mais lentamente, aproximando-se umas das outras e refazendo as ligações intermoleculares. Isso faz ocorrer a mudança do estado físico gasoso para o estado físico líquido.
Página 198
Sublimação e deposição
A matéria pode passar do estado físico sólido diretamente para o estado físico gasoso, sem passar pelo estado físico líquido. Essa mudança de estado é chamada sublimação. O oposto também pode ocorrer, com a matéria passando do estado físico gasoso direto para o estado físico sólido, a chamada deposição.
A liofilização é um processo de desidratação que utiliza a sublimação. Esse processo é empregado para conservar alimentos, princípios ativos de medicamentos e vacinas, entre outras aplicações.
Na liofilização, o produto é congelado e, em seguida, encaminhado a uma câmara de vácuo, na qual sofre variações de temperatura. Como resultado, a água passa diretamente do estado sólido para o gasoso (sublimação). Isso provoca a desidratação do material, mantendo suas propriedades.

Em locais de baixas temperaturas, pode ocorrer um fenômeno conhecido como geada. Nele, o vapor de água (estado físico gasoso) presente no ar passa diretamente para o estado físico sólido, ao entrar em contato com uma superfície com baixa temperatura. Assim, a geada é um exemplo de deposição.

Fatores que influenciam nas mudanças de estados físicos
Questão 3. Quando citamos as temperaturas
de fusão e de ebulição da água,
consideramos os valores ao nível do mar. Por
que é importante a informação "ao nível do mar"?
Como estudamos anteriormente, a diferença entre os estados físicos da matéria está nas suas propriedades. Alguns fatores, como temperatura e pressão, podem fazer essas propriedades serem modificadas, interferindo na mudança de estado físico da matéria.
A seguir, vamos estudar a influência da temperatura e da pressão na mudança de estado físico da matéria.
Página 199
Para uma determinada condição de pressão, as mudanças de estado físico da matéria ocorrem em temperaturas específicas. No entanto, uma mudança de pressão pode alterar as temperaturas de fusão e de ebulição dessas substâncias.
A água, por exemplo, quando é submetida a um aumento de pressão, funde-se em temperaturas menores que e entra em ebulição em temperaturas maiores que . Uma maneira de observarmos isso é utilizando o chamado diagrama de fases. Trata-se de um gráfico que apresenta os diferentes estados físicos da matéria em função da temperatura e da pressão. Observe a seguir.
Diagrama de fases da água
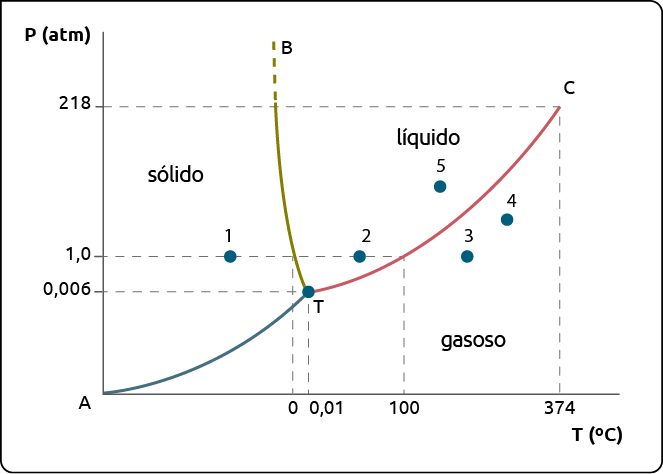
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 489.
As curvas do diagrama de fases mostram as mudanças de estado físico da matéria: a curva B é a curva de fusão, a C é a curva de vaporização, e a A é a curva de sublimação.
No ponto 1 temos água no estado sólido. Mantendo a pressão constante e aumentando a sua temperatura, chegamos ao ponto 2, ou seja, a água passa para o estado líquido. Se continuarmos a aumentar a temperatura e a manter a pressão constante, podemos chegar ao ponto 3, no qual a água se encontra no estado gasoso.
O ponto do diagrama indicado com a letra T é chamado ponto triplo, que é uma combinação de pressão e temperatura na qual os estados físicos sólido, líquido e gasoso coexistem em equilíbrio.
Questão 4. Partindo do ponto
4
do diagrama, quais são as maneiras de possibilitar que a água passe para o
estado físico líquido?
Questão 5. Quais são as possíveis maneiras
de a amostra que está no ponto
5 passar para o estado
físico sólido?
Página 200
Tomando como base o diagrama de fases, podemos explicar, por exemplo, o uso das panelas de pressão, utensílio doméstico que tem como finalidade diminuir o tempo necessário para cozinhar os alimentos de maneira segura.
Observe a seguir como funciona uma panela de pressão.
Representação com elementos não proporcionais entre si. Cores-fantasia.
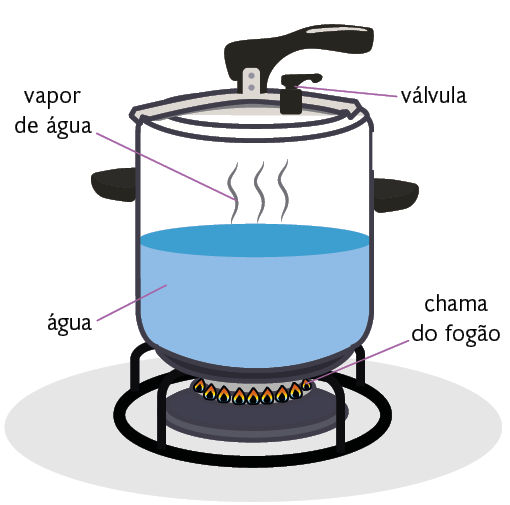
A panela de pressão tem a tampa vedada e uma válvula que controla a pressão interna do vapor, por meio da liberação contínua de vapor para o ambiente.
À medida que a panela esquenta, a pressão em seu interior aumenta e maior é a dificuldade para que as moléculas de água se desprendam do líquido e passem para o estado físico gasoso. Isso ocorre porque elas precisam vencer a pressão exercida sobre a superfície do líquido para poder evaporar.
Quanto maior é a pressão no interior da panela, maior é a temperatura que a água pode atingir.
A válvula presente na tampa da panela permite que a pressão interna desse utensílio seja maior que a externa. Dessa maneira, a pressão de vapor aumenta no interior da panela de pressão e a água entra em ebulição em uma temperatura de cerca de . A maior temperatura de ebulição da água faz os alimentos serem cozidos a temperaturas mais altas e, portanto, mais rapidamente.
Outra situação em que podemos perceber a influência da temperatura e da pressão na mudança de estados físicos da matéria está relacionada à altitude.
À medida que a altitude aumenta, a pressão atmosférica diminui, fazendo a água entrar em ebulição em temperaturas abaixo de .
Por exemplo, a cidade de La Paz, na Bolívia, fica a uma altitude de , e o ponto de ebulição da água nessa cidade é de , o que afeta o tempo de cozimento dos alimentos.

Página 201
Atividades
Faça as atividades no caderno.
1. Explique a organização das partículas da matéria nos estados físicos líquido, sólido e gasoso.
2. Identifique os estados físicos e as transformações físicas indicados pelas letras A a I.
Representação com elementos não proporcionais entre si. Cores-fantasia.
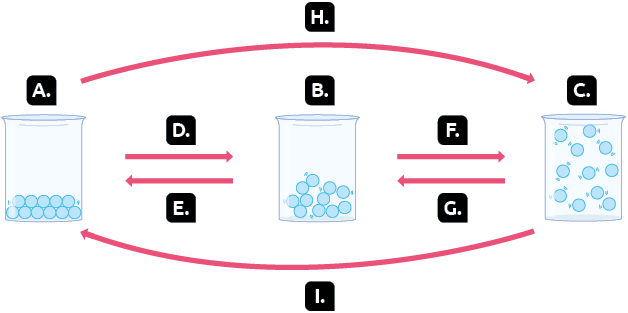
Fonte de pesquisa: TREFIL, James; HAZEN, Robert M. Física viva: uma introdução à física conceitual. Tradução: Ronaldo Sérgio de Biasi. Rio de Janeiro: LTC, 2006. v. 1. p. 247.
3. Em dias com baixa umidade relativa do ar, algumas pessoas apresentam certa dificuldade para respirar por conta do tempo seco. Por esse motivo, indica-se colocar recipientes com água nos ambientes em que a pessoa estiver.
a) Explique a possível melhora nas condições do ambiente na presença de recipientes com água.
b) Com base na organização das partículas dos materiais, explique como ocorre o processo que você citou no item a.
4. Identifique a alternativa incorreta e, em seguida, reescreva essa alternativa no caderno, corrigindo-a.
a) A ebulição ocorre de maneira mais rápida que a evaporação. Além disso, somente na ebulição há a formação de bolhas.
b) Na condensação, as partículas da matéria no estado físico gasoso cedem energia para outras matérias ou outros corpos com temperatura menor, passando a se movimentar mais lentamente e permitindo que as forças de atração unam suas partículas.
c) Para que ocorra a fusão, é necessário reduzir a temperatura da matéria e, para a solidificação, é preciso aumentá-la.
d) A passagem da matéria do estado físico sólido diretamente para o estado físico gasoso é chamada sublimação, enquanto seu oposto recebe o nome de deposição.
Página 202
5. Leia o trecho de reportagem a seguir e responda às questões propostas.
[...]
A combinação de derretimento do gelo e expansão da água está fazendo com que o nível do mar suba, representando uma ameaça para cidades costeiras, incluindo várias capitais do mundo.
[...]
SMINK, Veronica. Aquecimento global: por que é preocupante que os polos da Terra estejam cada vez menos brancos. BBC News Brasil, 5 nov. 2021. Disponível em: https://oeds.link/8cBtRN. Acesso em: 27 abr. 2022.
a) Qual é a mudança de estado físico relacionada ao derretimento do gelo?
b) Com base na organização das partículas dos materiais, explique como ocorre o processo que você citou no item a.
c) Por que o aumento do nível do mar ameaça as cidades costeiras?
6. Wagner, que mora no município de São Paulo, aproveitou um final de semana para viajar até Santos, um município no litoral do estado de São Paulo. Na manhã de domingo, já em Santos, foi preparar um café e percebeu que a água demorou um pouco mais para ferver do que em sua casa. Visto que Wagner sempre utilizava a mesma quantidade de água para preparar seu café e que a chama do fogão cede calor à água com a mesma intensidade em ambos os locais, responda às questões propostas.
Representação com elementos não proporcionais entre si. Cores-fantasia.

a) Wagner estava certo em sua percepção? Justifique sua resposta.
b) Qual é a relação que existe entre a altitude e a pressão atmosférica?
c) Qual é a relação entre pressão e temperatura de ebulição?
Página 203
Transformações químicas da matéria
Observe as imagens a seguir.
Imagens não proporcionais entre si.


Como citado no início deste capítulo, as transformações químicas, também chamadas reações químicas, são aquelas mudanças nas quais ocorre formação de novas substâncias por meio da alteração e/ou combinação das substâncias iniciais.
Ao analisar as imagens A e B, é possível perceber que, ao aquecer o açúcar, ele muda de cor e de textura, transformando-se em uma calda caramelizada. Isso indica que ele passou por uma transformação química, pois se tornou um outro material.
Em uma reação química, as substâncias que reagem e dão origem a novas substâncias são chamadas reagentes. As novas substâncias formadas com base nesses reagentes são chamadas produtos. A formação do produto ocorre por meio do rearranjo dos átomos dos reagentes.
Representação das transformações químicas
Como estudamos, os elementos químicos são representados por símbolos. O carbono, por exemplo, é representado pela letra C maiúscula.
Os compostos químicos, por sua vez, são representados por fórmulas químicas. Observe a seguir a fórmula química do etanol.
O etanol, utilizado como combustível de veículos, é composto por dois átomos de carbono , seis átomos de hidrogênio e um átomo de oxigênio .
As reações químicas podem ser representadas por meio de equações químicas, que descrevem resumidamente o que está acontecendo na reação. Observe a equação química da fotossíntese, apresentada a seguir.
A fotossíntese é um exemplo de reação química. Na presença da luz solar, as plantas transformam gás carbônico e água em glicose e gás oxigênio.
Página 204
Para descrevermos em detalhes o que deve ser representado em uma equação química, vamos considerar a transformação do fermento químico, que ocorre durante o preparo de um bolo. O fermento químico tem como componente principal o sal hidrogenocarbonato de sódio , comercialmente conhecido como bicarbonato de sódio.

Ao aquecer a massa do bolo, esse reagente sofre uma transformação química, resultando em alguns produtos, como o carbonato de sódio , a água e o dióxido de carbono, também chamado gás carbônico.
A transformação química que ocorre com o fermento químico pode ser representada de acordo com a equação química a seguir.
O número localizado antes das substâncias é conhecido como coeficiente estequiométrico. Ele indica a proporção das substâncias que participam da reação química, tanto nos reagentes quanto nos produtos. Nesse exemplo, o número 2.
O número subscrito representa a quantidade de átomos de cada elemento químico presente na substância. Nesse exemplo, os números 2 e 3 subscritos.
As letras apresentadas entre parênteses indicam o estado físico das substâncias: nesse exemplo, o estado físico sólido e o estado físico gasoso .
A seta separa os reagentes — posicionados antes da seta — dos produtos — posicionados após a seta — e indica o sentido da reação química.
A letra grega delta acima da seta indica que foi necessário o aquecimento para que a reação ocorresse.
Questão 6. Quantos átomos de oxigênio há
no reagente da equação química
de transformação do fermento?
Muitas vezes, as informações sobre o estado físico dos reagentes e dos produtos são inseridas nas equações químicas e apresentadas ao lado direito da substância por meio das indicações a seguir.
- indica estado sólido.
- indica estado líquido.
- indica estado gasoso.
- indica estado aquoso, quando a substância está diluída em água.
Página 205
Algumas reações necessitam de condições específicas para ocorrer. Por isso, são inseridos símbolos acima ou abaixo da seta para informá-las. Leia-os a seguir.
- A letra i indica a passagem de corrente elétrica.
- A letra grega lambda indica a presença de luz.
- A letra grega delta indica o aquecimento.
A lei da conservação da massa
O químico francês Antoine-Laurent de Lavoisier (1743-1794) observou em seus experimentos que, em uma reação química, a massa total dos reagentes e dos produtos se mantinha constante. Com base nisso, ele formulou a lei da conservação da massa, publicada em 1789.

Ela afirma que, se colocarmos reagentes químicos em um recipiente fechado, a massa, após ocorrer a reação química, é conservada, não havendo perdas ou ganhos de massa no produto final.
Para verificarmos esse fato, considere a reação química que ocorre entre o sódio e a água, formando o hidróxido de sódio e o gás hidrogênio .
Vamos analisar a massa dos reagentes e dos produtos dessa reação. Para isso, basta somarmos as massas atômicas aproximadas dos átomos que compõem as substâncias envolvidas nela.
|
Elemento químico |
Massa atômica |
|---|---|
|
23 |
|
|
1 |
|
|
16 |

em que é a unidade de massa atômica.
Página 206
No estudo das reações químicas, do ponto de vista atômico, a lei também é aplicada, ou seja, nenhum átomo é criado ou destruído nas reações químicas. Por isso, quando representamos uma reação química por meio de uma equação química, é necessário que exista a mesma quantidade de átomos nos reagentes e nos produtos. Quando a equação química atende a esse requisito, dizemos que ela está balanceada. Se não atender, devemos realizar seu balanceamento para que ela represente adequadamente a reação química.
A lei das proporções definidas
Nas indústrias, por exemplo, a quantidade dos reagentes utilizada na fabricação de produtos é definida cuidadosamente. Para assegurar que essas proporções de reagentes sejam mantidas durante a fabricação de produtos diversos, é utilizada a lei das proporções definidas, enunciada pelo químico francês Joseph Louis Proust (1754-1826).

De acordo com ela, a massa de um composto químico e as massas de seus elementos obedecem a uma proporção definida. No caso de uma reação química, o excesso de uma das substâncias não altera a quantidade da substância formada, pois ele não participa da reação.
Verifique a seguir um exemplo.
O óxido de zinco é um composto muito utilizado em pomadas contra assaduras. A reação de oxidação do zinco segue a lei de Proust. De acordo com ela, a massa de cada elemento do composto obedece a uma proporção definida.
|
Reação de oxidação do zinco |
Massa aproximada |
Composição aproximada |
|---|---|---|
Analisando o quadro, podemos observar que qualquer amostra de óxido de zinco tem 80,3% de sua massa formada por zinco e 19,7%, por oxigênio. Essa proporção é fixa e determina a proporção-limite em que cada uma das substâncias reage para formar o composto.
Isso significa que se, a quantidade de um dos reagentes ( ou ) for maior que o limite suportado para a formação do , a quantidade excedente não reagirá.
Página 207
Balanceamento das equações químicas
De acordo com as leis que você conheceu anteriormente, uma equação química que representa uma reação química deve conter a mesma quantidade de reagentes e de produtos, ou seja, ela deve estar balanceada.
Questão 7. Qual é a função dos
coeficientes em uma equação química?
O balanceamento consiste em determinar os coeficientes das substâncias nos reagentes e nos produtos de tal forma que a quantidade de átomos seja conservada em ambos os lados (reagente e produto) da equação química. O método mais utilizado para identificar os coeficientes é por tentativa e erro.
Para estudarmos esse método, vamos nos basear no exemplo a seguir.
O gás butano é um dos componentes do gás liquefeito do petróleo (GLP). Em sua reação de combustão, ele reage com o gás oxigênio, formando o gás carbônico e a água.
Analisando essas informações, podemos identificar que os reagentes são o gás butano e o gás oxigênio, e os produtos são o gás carbônico e a água, todos no estado gasoso.

Observe a seguir esses dados transcritos na equação química de combustão do gás butano.
Note que a quantidade de átomos presentes nos reagentes é diferente da quantidade de átomos formados nos produtos, ou seja, essa equação não está balanceada. Observe o quadro a seguir.
|
Reagentes |
Produtos |
||
|---|---|---|---|
|
Elemento químico |
Quantidade de átomos |
Elemento químico |
Quantidade de átomos |
|
4 |
1 |
||
|
10 |
2 |
||
|
2 |
3 |
||
Agora, vamos balancear essa equação. Para facilitar o processo, vamos realizá-lo por etapas.
Página 208
Etapa 1
Inicialmente, vamos balancear o carbono. Como há 4 átomos de carbono nos reagentes e apenas 1 no produto, colocamos um coeficiente 4 no lado direito da equação, em .
Dica!
O balanceamento das substâncias simples pode ser deixado para a última etapa, pois, nesses casos, alteramos a quantidade de apenas um tipo de átomo envolvido. Nesse exemplo, isso ocorre com o gás oxigênio.
Etapa 2
Agora, vamos balancear o hidrogênio. Como há 10 átomos de hidrogênio nos reagentes da equação e apenas 2 nos produtos, colocamos um coeficiente 5 em .
Etapa 3
Nessa etapa, os átomos de oxigênio são os únicos que não estão balanceados, pois há 2 átomos de oxigênio nos reagentes da equação e 13 nos produtos. Para balancear, inserimos um coeficiente fracionário de em .
Etapa 4
Geralmente, não se costuma manter coeficientes fracionários em equações químicas. Dessa forma, para eliminá-los, basta multiplicarmos os demais coeficientes por 2, número que corresponde ao denominador do coeficiente do gás oxigênio.
Agora, a equação química de combustão do butano está balanceada.
Questão 8. Em seu caderno, elabore um quadro apresentando o número de átomos de cada um dos elementos químicos dos reagentes e dos produtos. Em seguida, compare esses dados com os do quadro apresentado no final da página anterior e elabore uma conclusão.
Uma equação química fornece informações sobre a composição das substâncias envolvidas na reação. Já o seu balanceamento indica a proporção de reagentes e de produtos.
Página 209
Atividades
Faça as atividades no caderno.
1. Observe a transformação química a seguir.
Agora, julgue as afirmativas a seguir em verdadeiras ou falsas, corrigindo as falsas em seu caderno.
a) Essa transformação ocorre por ação da luz.
b) Um dos produtos da reação química é a prata no estado líquido.
c) A equação apresentada não está balanceada.
d) Nessa transformação química temos a produção de cloro gasoso.
2. O óxido de cálcio , conhecido como cal virgem, é muito utilizado na construção civil como componente no preparo da argamassa.
A reação química entre o óxido de cálcio e a água é uma etapa conhecida como "queima da cal". Nesse processo, ocorre liberação de grande quantidade de calor. O produto dessa reação é o hidróxido de cálcio , vendido comercialmente como cal hidratada.

a) Escreva, no caderno, a reação química que ocorre durante a produção da cal hidratada.
b) Em seu caderno, calcule a massa do hidróxido de cálcio. Considere as seguintes massas atômicas: ; ; .
c) Sabendo que um construtor civil deseja preparar de hidróxido de cálcio, qual é a massa de óxido de cálcio e de água que ele necessita para essa produção?
3. O dicromato de amônio é um sólido laranja que, quando aquecido, decompõe-se produzindo gás nitrogênio , vapor de água e óxido de cromo(III) , um sólido verde. Copie a equação química dessa reação em seu caderno, realize o balanceamento dela e substitua os símbolos pelo estado físico de cada uma das substâncias.
Página 210
Reversibilidade das transformações químicas
Você já estudou que, em uma transformação química, os reagentes combinam entre si, dando origem a outras substâncias — os produtos.
Existem reações químicas que podem ocorrer nos dois sentidos, ou seja, os reagentes podem formar os produtos e os produtos podem reagir formando os reagentes. Essas reações são chamadas reversíveis. Vamos analisar um exemplo.
Por exemplo, na formação de estalagmites e estalactites em cavernas com solos calcários, quando a água passa por esse solo, ocorre a dissolução de carbonato de cálcio , com a presença de dióxido de carbono. Como a transformação pode ocorrer no sentido inverso, à medida que a água se acumula no teto das cavernas, ela vai gotejando e evaporando, e o carbonato de cálcio se deposita, formando as estalactites no teto. No chão da caverna, as gotas que ainda contêm carbonato de cálcio dissolvido formam as estalagmites.
Imagens não proporcionais entre si.

As transformações químicas que ocorrem apenas em um sentido são chamadas irreversíveis, como a queima do carvão mineral.

Nessa reação química, o carbono reage com o gás oxigênio e forma o gás carbônico.
Algumas funções químicas
Observe a imagem a seguir.

Questão 9. Qual é o principal componente
do sal de cozinha e qual é a sua
fórmula química?
Questão 10. Quais dos ingredientes
utilizados pela
pessoa como tempero na salada são ácidos?
Página 211
Antes, durante e após o preparo de uma salada, utilizamos diversos materiais com características diferentes. Por exemplo, para lavar as folhas de alface e os tomates, usamos água; para temperar esses alimentos, podemos utilizar sal de cozinha, azeite, limão ou vinagre; para lavar o recipiente após o consumo da salada, usamos água e sabão.
Na situação relatada, podemos perceber a presença de uma variedade de compostos químicos. Os que têm características semelhantes podem ser agrupados nas chamadas funções químicas. A seguir, vamos estudar algumas funções químicas inorgânicas, que se caracterizam por não apresentarem o carbono como principal elemento químico.
Ácidos
Muitas vezes, em nosso cotidiano, ouvimos falar de ácidos. O limão e o vinagre utilizados para temperar uma salada, por exemplo, têm ácidos em sua composição, assim como a laranja, a uva e a maçã.
Confira a seguir alguns exemplos de ácidos e algumas de suas aplicações.
- O ácido clorídrico compõe o suco gástrico, que é liberado no estômago humano. Esse ácido auxilia na digestão de alguns alimentos.
- O ácido sulfúrico é aplicado em muitos processos industriais e está presente em baterias de automóveis.
- O ácido carbônico é um dos constituintes das bebidas gaseificadas.
Os ácidos têm algumas particularidades que, juntas, caracterizam essa função. Conheça algumas delas a seguir.
- Reagem com diversos metais, produzindo gás hidrogênio.
- Reagem com rochas calcárias, produzindo gás carbônico.
- Adquirem coloração avermelhada ao entrar em contato com o papel de tornassol✚ azul.
- Permitem a passagem de corrente elétrica em solução aquosa.
Glossário
Existem diversas maneiras de definir os ácidos. A definição de ácido elaborada pelo químico sueco Svante August Arrhenius (1859-1927), por volta de 1887, define os ácidos como compostos covalentes que ionizam✚ em meio aquoso, formando cátions hidrogênio . Observe um exemplo a seguir.

Página 212
Bases
As bases estão presentes em alguns produtos utilizados no dia a dia. Confira a seguir alguns exemplos de bases e algumas de suas aplicações.
- O hidróxido de cálcio, conhecido popularmente como cal hidratada, é utilizado no preparo de argamassa e na correção da acidez do solo.
- O hidróxido de magnésio , conhecido como leite de magnésia, é um medicamento utilizado para diminuir a acidez do estômago e como laxante.
Arrhenius definiu as bases como compostos iônicos que se dissociam✚ em meio aquoso, formando ânions hidróxido .
Glossário
Um exemplo de base é o hidróxido de sódio, conhecido popularmente como soda cáustica. Essa base é bastante usada na fabricação de alguns tipos de sabão.

As bases constituem um grupo de substâncias que têm algumas propriedades particulares. Conheça algumas delas a seguir.
- Reagem com ácidos, neutralizando-os.
- Adquirem coloração azul ao entrar em contato com o papel de tornassol vermelho.
Cuidado!
Embora você já deva ter experimentado o sabor azedo de alguns ácidos, como o do limão e o do vinagre, não devemos tocar nem experimentar substâncias que não conhecemos; muitas delas são corrosivas e tóxicas e causam sérios danos à saúde.
Medindo a concentração de ácidos e bases
Arrhenius também observou que os ácidos podem ser "fracos" ou "fortes" e que essa condição está relacionada com a quantidade de íons que eles liberam em solução aquosa. Quanto maior essa concentração, mais "forte" será o ácido.
O ácido acético , em solução aquosa, tem maior tendência a permanecer em sua forma molecular do que se ionizar. Por isso, ele é considerado um ácido fraco.
Página 213
Em solução aquosa, a molécula de ácido clorídrico se ioniza, liberando uma grande quantidade de íons . Por isso, ele é considerado um ácido forte.
Do mesmo modo, o que determina se uma base é "forte" ou "fraca" é a sua tendência a se dissociar em íons . Quanto maior a concentração de íons , mais "forte" será a base.
O hidróxido de zinco , em solução aquosa, tem menor tendência a se dissociar. Por isso, ele é considerado uma base fraca.
Em solução aquosa, o hidróxido de sódio se dissocia, liberando uma grande quantidade de íons . Por isso, ele é considerado uma base forte.
Existem diversas maneiras de determinar a acidez ou a basicidade de uma substância. Uma delas é pelo uso de papel indicador, que muda de cor de acordo com a propriedade ácido-básica da substância. Devido à sua imprecisão, seu uso é aconselhado apenas para a identificação do caráter ácido ou básico da substância. Em laboratórios utilizam-se métodos mais precisos, como a medição da concentração de íons por meio de um equipamento chamado peagômetro (pHmetro). Após realizar a leitura, esse equipamento exibe um valor que varia entre 0 e 14 na escala de pH.
A escala de pH
No desenvolvimento de alguns produtos, como xampu, é importante que se determine com precisão sua acidez. Em casos como esse, geralmente se utiliza uma escala numérica que permite relacionar a concentração de íons a valores numéricos, facilitando a determinação da acidez ou da basicidade de uma substância. Essa escala é conhecida como pH.
A maioria das soluções que fazem parte do nosso cotidiano se encontram na faixa de pH entre 0 e 14. À temperatura de , uma solução com é considerada neutra, ou seja, ela não é considerada nem ácida nem básica. A água pura é um exemplo de substância neutra.
As substâncias cujo pH tem valores menores que 7 são consideradas ácidas. Já as cujo pH tem valor maior que 7 são consideradas básicas.
Página 214
Quanto mais próximo de 0, maior a acidez da substância, e quanto mais próximo de 14, maior a sua basicidade.
Representação com elementos não proporcionais entre si. Cores-fantasia.

Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 717.
A. 0,1: ácido clorídrico
B. 0,8: ácido sulfúrico, presente nas baterias de automóveis
C. 2,0: suco de limão
D. 2,4: vinagre
E. 4,5: tomate
F. 5,5: água da chuva
G. 6,4: leite
H. 7,0: água pura
I. 8,5: clara de ovo
J. 9,0: bicarbonato de sódio
K. 10,0: sabonete líquido
L. 10,5: leite de magnésia
M. 11,6: solução de amônia (amoníaco)
N. 12,6: água sanitária
O. 13,0: soda cáustica
Sais
Há substâncias cujas características não nos permitem classificá-las como ácidos nem como bases. É o caso do cloreto de sódio , por exemplo. Em solução aquosa, sua ionização não produz cátions (principal característica para ser classificado como ácido) nem ânions (principal característica para ser classificado como base). Mas, então, a que grupo pertence o cloreto de sódio?
O cloreto de sódio é uma substância classificada como sal.
Os sais são compostos iônicos nos quais o cátion provém de uma base e o ânion provém de um ácido. Os sais são formados pela reação de neutralização, que ocorre quando ácido e base reagem.
O cloreto de sódio, por exemplo, é formado na reação de neutralização entre o hidróxido de sódio e o ácido clorídrico. Leia a seguir.
Página 215
Quando um sal se dissolve em água, ele se ioniza, ou seja, seus íons se separam. Observe.
Em um sal, a soma das cargas dos íons é igual a zero, ou seja, o número de cargas positivas é igual ao de cargas negativas.
Além do cloreto de sódio, outros sais estão presentes em diversos produtos. Conheça a seguir alguns deles e algumas de suas aplicações.
- O cloreto de magnésio , um dos muitos compostos dissolvidos na água do mar.
- O sulfato de sódio , usado na produção de detergentes.
- O carbonato de cálcio, utilizado para corrigir a acidez do solo e o principal componente da casca de ovo.
- O hipoclorito de sódio , usado na produção de água sanitária, produto utilizado, por exemplo, para desinfecção em geral.
- O sulfato de cálcio , utilizado na produção de giz escolar e de gesso para a ortopedia e construções.

Óxidos
Óxido é um composto binário✚ formado pelo oxigênio e outro elemento químico que não seja o flúor . Conheça a seguir alguns exemplos de óxidos e algumas de suas aplicações.
Glossário
- O óxido de cálcio , conhecido popularmente como cal virgem, é utilizado na construção civil para preparação de argamassas.
- O monóxido de dihidrogênio , mais conhecido como água, é essencial para os seres vivos e as atividades desenvolvidas pelo ser humano.
- O dióxido de silício , principal componente da areia, é utilizado na fabricação do vidro. A pigmentação do vidro é obtida por meio da adição de óxidos metálicos durante o processo de fabricação.

Página 216
O tema é ...
Diversidade cultural
A lenda do Boitatá e o fogo-fátuo
A Química é uma ciência que investiga a natureza por meio das propriedades, composição e transformações da matéria. Os conhecimentos reunidos por essa ciência auxiliam na compreensão de diferentes fenômenos do cotidiano.
As lendas, que são narrativas transmitidas pela tradição oral através dos tempos, também tratam de explicar alguns fenômenos. Elas são oriundas de diversas partes do mundo, refletindo diferentes crenças e tradições. No entanto, misturam fatos reais com fantasiosos e vão sendo recontadas e modificadas de geração em geração.
Um exemplo de lenda brasileira é a do Boitatá, termo em tupi que significa cobra de fogo. Ao longo do tempo, essa lenda sofreu várias modificações. O texto a seguir apresenta um trecho dessa lenda.
Texto 1
Boitatá
Chamado muitas vezes de Boitatá, esta criatura é outro dos personagens obrigatórios de qualquer coletânea fantástico-zoológica do Brasil.
Apesar do nome, o Boitatá nada tem a ver com bois, mas com uma cobra transparente que irradia uma luz ofuscante nas noites tristes das matas brasileiras [...].
O Boitatá, dizem, alimenta-se somente dos olhos das suas vítimas, a ponto de seu corpo translúcido ficar repleto de olhos chamejantes. Para escapar à sua fúria, o corajoso deve munir-se de uma boa dose de sangue-frio: permanecer parado e de olhos fechados é o que basta para fazer a serpente se desinteressar dele. Se não funcionar, sugere-se a tática mais rude de arremessar-lhe um objeto de ferro. [...]
FRANCHINI, Ademilson S. As 100 melhores lendas do folclore brasileiro. Porto Alegre: L&PM, 2011. p. 166.
Representação com elementos não proporcionais entre si. Cores-fantasia.

Página 217
Agora, conheça outro texto que aborda o mesmo fenômeno tratado na lenda, publicado em um jornal, mas com base em conhecimentos científicos.
Texto 2
Mistérios explicados pela Ciência
[...]
Os portugueses acreditavam que se tratava de uma cobra de fogo [...], mas já existem explicações científicas para provar que toda essa lenda é apenas uma manifestação química da natureza.
Como você sabe, corpos em decomposição atraem uma série de bactérias que aceleram o processo. Com a decomposição, ocorre o acúmulo dos gases metano e fosfina. Aos poucos, esses gases vão à superfície e, ao entrarem em contato com o ar, entram em combustão.
O verdadeiro nome desse fenômeno é fogo-fátuo e ele não dura mais do que poucos segundos. [...]
[...] como o fogo faz com que as pessoas se assustem, é muito comum que quem está perto das chamas saia correndo. Nessa situação, o deslocamento de ar faz com que o fogo-fátuo siga os pés da pessoa, causando a impressão de que é uma cobra flamejante. [...]
Mistérios explicados pela Ciência. O Jornal, Maceió, 5 dez. 2011, p. 6.
Agora, responda às questões a seguir em seu caderno.
1. Qual é o objetivo dessa lenda?
2. De acordo com o texto 2, qual é a relação entre a Química e a compreensão científica do fogo-fátuo?
3. Na lenda do Boitatá, quais fatos podem ser relacionados a explicações científicas apresentadas no texto 2?
4. Em
grupos de até quatro alunos, pesquisem em livros e na internet sobre lendas brasileiras. Depois, cada equipe
deverá escolher uma delas para elaborar uma explicação com base em
conhecimentos científicos.
Após realizar a pesquisa, elaborem uma forma de apresentá-la. Vocês podem produzir um cartaz, uma história em quadrinhos, um texto, um vídeo ou outro recurso que vocês considerem atraente e interessante. Se possível, converse com o professor para escolher um local da escola em que seja possível compartilhar os trabalhos com a comunidade escolar.
Página 218
Hora de investigar
O indicador ácido-base é um composto que muda de cor quando colocado em contato com um ácido ou com uma base. Existem indicadores sintéticos e naturais, como é o caso das antocianinas presentes no repolho roxo.
a) O que acontece com a coloração de uma mistura ácida ou de uma mistura básica quando esta entra em contato com um indicador ácido-base? Registre sua resposta no caderno.
Materiais
- repolho roxo
- de vinagre
- de leite de magnésia
- conta-gotas
- colher de sobremesa
- recipiente de
- de água
- copos transparentes de
- liquidificador
- peneira
- etiquetas autoadesivas
- caneta
Como proceder
A. Separe cerca de 10 folhas de repolho roxo e pique, com as mãos, pedaços não muito grandes.
B. Coloque o repolho roxo picado no liquidificador e acrescente de água.
C. Peça a um adulto que bata essa mistura no liquidificador por cerca de 2 minutos, até que todo o repolho seja triturado.
D. Se necessário, após realizar a etapa C, peça a um adulto que mexa a mistura com uma colher, tampe o liquidificador novamente e bata a mistura por mais 1 minuto.
E. Coe a mistura obtida no liquidificador. Para isso, posicione a peneira sobre o recipiente e despeje, cuidadosamente, o conteúdo do liquidificador.
Dica!
Para coar a mistura de repolho roxo com água, coloque pausadamente parte da mistura na peneira. Aguarde até que o nível na peneira diminua e vá acrescentando o restante da mistura.

Página 219
F. Separe os copos transparentes de e numere-os (1 e 2) utilizando as etiquetas autoadesivas e a caneta.
G. No copo 1, coloque de leite de magnésia e acrescente de água. No copo 2, coloque de vinagre e acrescente de água.
H. Na mistura existente no copo 1, acrescente duas colheres de sobremesa da solução extraída do repolho roxo. Mexa e perceba o que acontece.

I. Lave a colher com água corrente e, no copo 2, acrescente duas colheres da solução extraída do repolho roxo. Mexa e perceba o que acontece.
J. Utilizando o conta-gotas, pingue algumas gotas da solução do copo 1 na do copo 2. Mexa a mistura com a colher de sobremesa e verifique o que acontece.
Cuidado!
Não ingira os líquidos utilizados na realização desta atividade, nem coloque as mãos nos olhos ou na boca após manusear os objetos. Após realizar a atividade, lave bem as mãos.
Minhas observações
1. No procedimento H, o que foi observado na mistura do copo 1 ao ser adicionada a solução de repolho roxo?
2. No procedimento I, o que foi observado na mistura do copo 2 ao ser adicionada a solução de repolho roxo?
3. No procedimento J, o que foi observado na mistura do copo 2 ao ser adicionada a mistura do copo 1?
4. Realize uma pesquisa sobre indicadores naturais como o repolho roxo e identifique qual das misturas contém ácido e qual delas contém base.
Elaborando nossas conclusões
1. Compare seus resultados com o de um colega. Os resultados obtidos foram semelhantes? Quais fatores podem interferir nesses resultados?
Vamos ampliar a investigação!
1. Em grupo de quatro integrantes, teste outros alimentos, como sucos de laranja, de caju e de banana, iogurte natural e leite. Faça uma pesquisa na internet sobre as propriedades nutricionais desses alimentos e monte um livreto. Em cada página, insira as informações pesquisadas e escreva um breve comentário sobre o pH identificado durante sua investigação. Apresente o livreto aos demais colegas.
Página 220
Atividades
Faça as atividades no caderno.
1. Cite algumas características que diferenciam uma substância ácida de uma substância básica.
2. Um composto bastante utilizado na culinária em massas de bolos e pães é o bicarbonato de sódio. Quando ele é aquecido há liberação de gás carbônico no interior da massa.
A equação para essa transformação está descrita a seguir.
a) Qual é o objetivo da adição do bicarbonato de sódio na massa?
b) Qual é o tipo de transformação que ocorre com o bicarbonato de sódio?
3. Algumas cidades, como São Paulo, adotaram medidas com o objetivo de diminuir o fluxo de veículos nas vias, evitando congestionamentos e diminuindo a emissão de gases poluentes na atmosfera, como o dióxido de enxofre , o dióxido de nitrogênio e o dióxido de carbono. Uma dessas medidas é o rodízio de veículos, que restringe a circulação de alguns veículos de acordo com a numeração de sua placa.

Sobre os gases emitidos pelos veículos, responda às questões a seguir.
a) O que esses gases têm em comum na sua composição?
b) A qual função química esses gases pertencem? Justifique.
c) Que outras medidas poderiam ser tomadas para a diminuição da emissão desses gases?
Página 221
4. Uma pessoa com dores no estômago consultou um médico, que lhe indicou um antiácido à base de hidróxido de magnésio para diminuir o excesso de acidez provocada pelo ácido clorídrico do estômago.

a) Como é chamada a reação química que ocorre entre o antiácido e o no estômago?
b) Descreva o que acontece nesse tipo de reação química.
c) Pesquise e escreva no caderno a reação balanceada entre o hidróxido de magnésio e o ácido clorídrico.
5. No Brasil, o sal de cozinha utilizado para consumo humano deve ser iodado. Para isso, é adicionado a ele o iodato de potássio . Essa medida foi adotada para diminuir e prevenir doenças causadas pela falta de iodo, como o bócio.

a) Considere um sal de cozinha contendo apenas cloreto de sódio e iodato de potássio. Quais íons são liberados ao misturá-lo à água?
b) Classifique o iodato de potássio quanto à sua função química e justifique sua resposta.
c) Além do sal de cozinha, o cloreto de sódio pode estar presente na composição de outros alimentos. Pesquise rótulos de produtos industrializados em sua residência e cite alimentos que contenham esse sal.
Página 222
6. Uma aluna de Química derrubou ácido sulfúrico na bancada do laboratório. Para neutralizá-lo, ela espalhou hidróxido de cálcio sólido sobre ele. Observe a reação química que ocorreu.
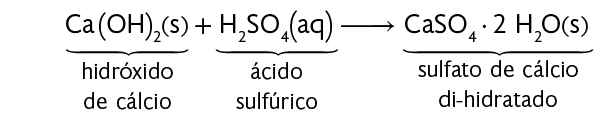
a) Quais tipos de funções químicas temos nos reagentes?
b) Como é chamada a reação química que ocorre entre o hidróxido de cálcio e o ácido sulfúrico?
c) Na reação química apresentada, ocorre a formação de qual substância?
d) Que tipo de função química o produto dessa reação representa?
7. Liberado principalmente na combustão incompleta de alguns combustíveis fósseis, o monóxido de carbono é um gás poluente que, quando inalado, pode ser prejudicial à saúde humana.
A hemoglobina é uma molécula presente nas células do sangue chamadas hemácias. Essa molécula é capaz de captar o gás oxigênio e transportá-lo pelo corpo. Observe a reação química a seguir.
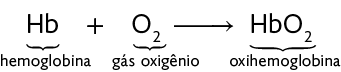
No entanto, o monóxido de carbono pode se ligar à hemoglobina com maior facilidade que o gás oxigênio. Observe a reação química a seguir.
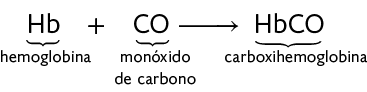
Assim, quando a carboxihemoglobina é formada, o transporte do gás oxigênio pelo corpo pode ser prejudicado.
a) A qual função química pertence o monóxido de carbono?
Página 223
O que eu estudei?
Faça as atividades em uma folha de papel avulsa.
1. Analise sua resposta à questão que apresenta as afirmativas sobre o elefante-africano macho, apresentada no início do tema Massa e peso. Verifique se você precisa, corrigi-la ou complementá-la.
2. Elabore uma linha do tempo com os principais modelos e estudos atômicos. Em seguida, faça um esquema representando cada um desses modelos atômicos e escreva as principais características de cada um deles.
Versão adaptada acessível
2. Faça uma lista com os principais modelos e estudos atômicos em ordem cronológica.
3. Junte-se a um colega e analisem a tabela periódica. Cada um de vocês deverá escolher um elemento químico para juntos construírem um modelo da estrutura do átomo que caracteriza cada um desses elementos. Esse modelo deve ser elaborado com materiais recicláveis e incluir informações sobre número de átomos, de nêutrons, de níveis de energia e de elétrons.
4. Junte-se a um colega de turma. Em seguida, separem 5 pedaços de papel e escrevam em cada um deles o símbolo de um elemento químico da tabela periódica. Troquem com outra dupla os seus pedaços de papel, procurem o símbolo representado em cada um deles na tabela periódica e escrevam: o nome do elemento, o número atômico, a massa atômica, o número do período a que ele pertence e o nome do grupo. Cite também a classificação desses elementos de acordo com as cores da tabela, mencionando as principais características dessas classificações.
5. Em uma folha de papel avulsa, elabore um quadro diferenciando as ligações iônicas, covalentes e metálicas e cite um exemplo para cada uma delas.
6. Explique com suas palavras o que são transformações físicas e transformações químicas.
7. Faça um esquema em uma folha de papel avulsa que represente a organização das partículas de um material nos estados físicos sólido, líquido e gasoso. Em seguida, escreva uma legenda explicativa para esse esquema.
Versão adaptada acessível
7. Explique com suas palavras como é a organização das partículas de um material nos estados físicos sólido, líquido e gasoso, respectivamente.
8. No tempo de um minuto, em um pedaço de papel, explique a frase de Lavoisier "Na natureza nada se cria, nada se perde, tudo se transforma", com base no que você estudou sobre a lei de conservação das massas.
9. Defina as funções químicas: ácidos, bases, sais e óxidos, de acordo com Arrhenius. Em seguida, cite uma aplicação de cada uma dessas funções.
10. Explique como é possível determinar a acidez e a basicidade de uma substância.